
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение постоянной Ридберга
Атом водорода является простейшим атомом, состоящим из протона, в кулоновском поле которого движется один электрон. Естественно поэтому первые исследования, связанные с построением атомной модели, были посвящены атому водорода, и, в частности, изучению его спектров. Еще в XIX веке было замечено, что спектр водорода можно представить в виде нескольких серий, лежащих в разных спектральных областях, но, тем не менее, имеющих сходную структуру (рис.10). Каждая оптическая серия состоит из ряда линий, расстояние между которыми по мере продвижения в сторону коротких волн и заканчивается границей, соответствующей линии с минимальной
Швейцарский ученый Иоганн Бальмер изучил серию, четыре линии которой лежат в видимой части спектра (а остальные - в ультрафиолетовой). Эмпирически он нашел формулу, позволявшую подсчитать длину волны любой линии этой серии, путем подстановки в нее целых чисел
где п =3,4,5. Эта серия получила название серии Бальмера. Последняя формула была несколько видоизменена шведским спектроскопистом Иоганнесом Ридбергом, записавшим ее через волновые числа
где R=4/В - постоянная Ридберга. Оказалось, что все остальные серии могут быть описаны аналогичными формулами, отличающимися величинами первого члена в скобках:
где номера т =1,2,3,4,5 определяет название серии (т= 1 – серия Лаймана т =2 - серия Бальмера, т =3 – серия Пашена, т =4 – серия Бреккета, т =4 – серия Пфунда), п = т+1, т+2. Ритц ввел в рассмотрение понятие спектрального терма Т (т) ~R/m2 и сформулировал принцип, названный его именем, согласно которому волновое число любой спектральной линии водорода можно представить как комбинацию некоторых двух термов
Датский физик Нильс Бор, анализируя спектры различных атомов, сформулировал постулаты, согласно которым: 1) атомы могут находиться лишь в определенных (дискретных) энергетических состояниях, в которых они не поглощают и не излучают энергию, и 2) излучение и поглощение света атомом может происходить лишь скачком при переходе из одного состояния в другое, при этом излучается (или поглощается) квант света с энергией Е=hν, причем
hν= En - Em (5) где En, Em - некоторые дискретные значения энергии атома. излучается (или поглощается) квант света с энергией Е=hν, причем hν= En - Em (5) где En, Em - некоторые дискретные значения энергии атома. Сравнивая (6) с (4), получим
откуда
Формула (7) позволяет вычислить энергию любого энергетического состояния водорода по известным значениям R, h, с и номеру уровня п. Всю совокупность изложенных данных удобно проиллюстрировать с помощью энергетической диаграммы, получившей название диаграммы Гротриана (рис. 11). Стрелками указаны переходы, соответствующие возникновению различных серий водородного атома. В настоящей работе мы определяем с помощью спектрального аппарата длины волн трех линий серии Бальмера, лежащих в видимой части спектра. Эти три линии – красная, зеленая и фиолетовая возникают благодаря переходам электрона из состояния с п =3,4,5 на уровень с п =2. Определив длины волн этих линий, можно вычислить постоянную Ридберга, воспользовавшись формулой (2):
где п =2, а ℓ =3,4,5,…
|
|||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 669; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.254.35 (0.009 с.) |
 длиной волны. Яркость линий одной серии уменьшается при уменьшении длины волны. Вышеперечисленные свойства характерны для всех серий.
длиной волны. Яркость линий одной серии уменьшается при уменьшении длины волны. Вышеперечисленные свойства характерны для всех серий. (1)
(1) =1/λ
=1/λ (2)
(2) (3)
(3) (4)
(4)
 ,
, (7)
(7)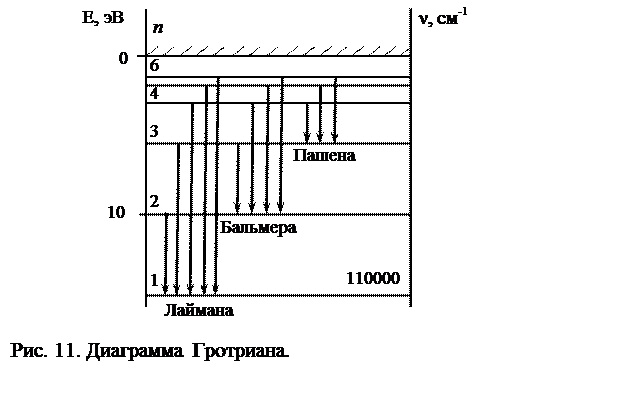
 (8)
(8)


