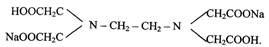Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1 Определение рН с помощью универсального индикатора и рН-метраСтр 1 из 2Следующая ⇒
Опыт 1 Определение рН с помощью универсального индикатора и рН-метра Приборы и реактивы: штатив с пробирками; универсальная индикаторная бумага; стаканчик вместимостью 100 см3; рН-метр; цилиндр мерный вместимостью 10 (25) см3. Порядок выполнения. Для ориентировочного определения рН можно пользоваться универсальными индикаторными бумажками. Для этого. волоску индикаторной бумаги поместите в пробирку, содержащей примерно 5 см3 исследуемой воды. Окраску индикаторной бумаги сравните со шкалой рН. Более точное значение рН определите с помощью рН-метра. Для этого -50 см3 исследуемой воды поместите в стаканчик, опустите электроды и измерьте значение рН в сооответствии с инструкцией пользования рН-метром. Опыт 2 Цветность Цветность природных вод обусловлена присутствием гуминовых веществ и комплексных соединений Fe(III). Приборы и реактивы: цилиндры или колбы вместимостью 100 см3; раствор № 1 - 0,0875 г K2Cr307 и 2,0 г CoSO4 7Н2О растворяют отдельно в дистиллированной воде, затем смешивают, добавляют 1 см3 H2SO4 (конц.) и доводят дистиллированной водой до 1 дм3; раствор № 2 - 1 см3 H2SO4 доводят дистиллированной водой до 1 дм3. Шкалу цветности (градус) готовят, смешивая растворы № 1 и № 2 в соотношениях, указанных в табл. 1. Таблица 1
Порядок выполнения. Если вода мутная ее фильтруют через фильтр "синяя лента". В цилиндр (колбу) однотипные с теми, в которых приготовлена шкала цветности, налейте 100 см3 исследуемой воды и, посматривая сверху, на белом фоне при достаточном боковом освещении (дневном, искусственном), подберите раствор шкалы с тождественной окраской. Опыт 3 Цвет (окраска) и мутность При загрязнении водоемов стоками промышленных предприятий, вода может иметь окраску не свойственную цветности природной воды. Для источников хозяйственно-питьевого водоснабжения окраска не должна обнаруживаться в склянке высотой 20 см, для водоемов культурно-бытового назначения - 10 см. Порядок выполнения. Заполните две пробирки исследуемой водой до высоты 10 - 12 см. Определите цвет и мутность воды, рассматривая пробирку сверху на белом и, соответственно, темном фоне при достаточном боковом освещении (дневном, искусственном). Подчеркните нужное в табл. 2, 3.
Опыт 4 Запах Приборы и реактивы: колбы вместимостью 250 см3; водяная баня. Запах воды водоемов не должен превышать 2 баллов, обнаруживаемых непосредственно в воде или после ее хлорирования. Определение основано на органолептическом исследовании характера и интенсивности запаха воды при 20 °С и 60 °С. Запах воды обусловлен наличием в ней летучих пахнущих веществ, которые попадают в нее естественным путем или со сточными водами. По характеру запахи бывают естественного и искусственного происхождения. Запахи естественного происхождения находят по классификации.
Таблица 2
Таблица 3
Запахи искусственного происхождения называют по соответствующим веществам: камфорный, хлорфенольный, бензиновый, хлорный и т.п. Порядок выполнения. Заполните колбу исследуемой водой на 1/3 объема и закройте пробкой. Взболтайте содержимое колбы. Откройте колбу и осторожно, неглубоко вдыхая воздух, сразу же определите характер и интенсивность запаха. Если запах сразу не ощущается или запах неотчетливый, испытание можно повторить, нагрев воду в колбе до температуры 60 OС (подержав колбу в водяной бане с горячей водой). Интенсивность запаха воды определите по пятибалльной системе со-гласно табл. 4. Таблица 4
Обработка результатов опытов и выводы
Занесите полученные результаты в табл. 5. Приведите данные для каждой точки отбора пробы (каждого анализа). Таблица 5
На основании проведенных исследований сделайте вывод об экологическом состоянии водоема (о качестве воды).
Лабораторная работа 2 ЖЕСТКОСТЬ ВОДЫ И СПОСОБЫ ЕЕ УСТРАНЕНИЯ Цель работы: определение временной и общей жесткости воды. Устранение жесткости воды с помощью катионитов. Жесткость воды - совокупность свойств, вызванных содержанием в воде ионов Са2+и Mg2+. Жесткость, обусловленная содержанием в воде гидрокарбонатов кальция (Са(НСО3)2) и магния (Mg(HCO3)2), называется временной. Она, может быть устранена кипячением воды, так как при кипячении гидрокарбонаты разлагаются и переходят в карбонаты Са(НСО3)2 = ↓СаСО2 + CO2↑ + Н2О; Mg(НСО3)2 = ↓MgСО3 + CO2↑ + Н2О; Карбонат магния гвйдхмшзуется по уравнению 2MgCO3 + Н2О = (MgOH) 2CO3 + СО2. Другие соли кальция и магния не разрушаются при нагревании, они обуславливают постоянную жесткость воды. Общая жесткость вода равна сумме временной и достоянной жесткости. За единицу жесткости принято число миллиэквивалентов (мэкв) катионов Са2+ и Mg2+, содержащихся в 1 дм3 воды. Так как массы одного мэкв ионов Са2+ и Mg2+ соответственно равны 20,04 мг и 12,16 мг, то общую жесткость воды (Ж, мэкв/дм3) вычисляют по формуле Ж = [Ca2+]/20,04 + [Mg2+]/12,16, где [Са2+] и [Mg2+] - концентрации ионов Са2+ и Mg2+, мг/дм3. Вода по величине жесткости (Ж) классифицируется следующим образом: мягкая, Ж < 3 мэкв/дм3; средняя Ж < 3 - 6 мэкв/дм3; жесткая Ж < 6 - 10 мэкв/дм3; очень жесткая Ж > 10 мэкв/дм3. Определение временной (карбонатной) жесткости вода основано на реакции взаимодействия соляной кислоты с растворимыми в воде гидрокарбонатами и карбонатами. Титрование проводят в присутствии метилоранжа, изменяющего свою окраску в точке эквивалентности. Метод определения общей жесткости основан на титровании пробы воды раствором трилона Б, представляющего собой двузамещенную натриевую соль этилендиаминтетрауксусной кислоты
Трилон Б образует прочные комплексные соединения при рН ~ 9 с ионами Са2+ и Mg2+. В качестве индикаторов используются оксинитрокра-сители, например, хромоген черный или хром темно-синий, изменяющие свою окраску в точке эквивалентности. Приборы и реактивы; прибор для удаления общей жесткости воды, фарфоровая ступка, бюретка вместимостью 25 см3, цилиндры мерные вместимостью 10, 50, 100 см3: колба коническая вместимостью 300 см3 -3 шт., микрошпатели, спиртовка, штатив с пробирками; мурексид + NaCl(l:5). Растворы: карбоната натрия, оксалата аммония, хлорида бария, нитрата серебра - 0,05 н; хлорида кальция - 0,01 н; трилона Б - 0,05 н; кислоты соляной - 0,1 н; аммиачной буферной смеси: хромогена черного, метилового оранжевого.
Обработка результатов опыта Опишите состав, структуру, влажность почвы и занесите полученные результаты в табл. 20.
Необходимо указать: в графе «структура почвы» – рассыпчатая, комковая, каменистая и др.; в графе «состав почвы» – наличие и количество инородных включений, преобладающий тип почвы и др. Опыт 1 Определение рН с помощью универсального индикатора и рН-метра Приборы и реактивы: штатив с пробирками; универсальная индикаторная бумага; стаканчик вместимостью 100 см3; рН-метр; цилиндр мерный вместимостью 10 (25) см3. Порядок выполнения. Для ориентировочного определения рН можно пользоваться универсальными индикаторными бумажками. Для этого. волоску индикаторной бумаги поместите в пробирку, содержащей примерно 5 см3 исследуемой воды. Окраску индикаторной бумаги сравните со шкалой рН. Более точное значение рН определите с помощью рН-метра. Для этого -50 см3 исследуемой воды поместите в стаканчик, опустите электроды и измерьте значение рН в сооответствии с инструкцией пользования рН-метром. Опыт 2 Цветность Цветность природных вод обусловлена присутствием гуминовых веществ и комплексных соединений Fe(III). Приборы и реактивы: цилиндры или колбы вместимостью 100 см3; раствор № 1 - 0,0875 г K2Cr307 и 2,0 г CoSO4 7Н2О растворяют отдельно в дистиллированной воде, затем смешивают, добавляют 1 см3 H2SO4 (конц.) и доводят дистиллированной водой до 1 дм3; раствор № 2 - 1 см3 H2SO4 доводят дистиллированной водой до 1 дм3. Шкалу цветности (градус) готовят, смешивая растворы № 1 и № 2 в соотношениях, указанных в табл. 1. Таблица 1
Порядок выполнения. Если вода мутная ее фильтруют через фильтр "синяя лента". В цилиндр (колбу) однотипные с теми, в которых приготовлена шкала цветности, налейте 100 см3 исследуемой воды и, посматривая сверху, на белом фоне при достаточном боковом освещении (дневном, искусственном), подберите раствор шкалы с тождественной окраской.
Опыт 3 Цвет (окраска) и мутность При загрязнении водоемов стоками промышленных предприятий, вода может иметь окраску не свойственную цветности природной воды. Для источников хозяйственно-питьевого водоснабжения окраска не должна обнаруживаться в склянке высотой 20 см, для водоемов культурно-бытового назначения - 10 см. Порядок выполнения. Заполните две пробирки исследуемой водой до высоты 10 - 12 см. Определите цвет и мутность воды, рассматривая пробирку сверху на белом и, соответственно, темном фоне при достаточном боковом освещении (дневном, искусственном). Подчеркните нужное в табл. 2, 3.
Опыт 4 Запах Приборы и реактивы: колбы вместимостью 250 см3; водяная баня. Запах воды водоемов не должен превышать 2 баллов, обнаруживаемых непосредственно в воде или после ее хлорирования. Определение основано на органолептическом исследовании характера и интенсивности запаха воды при 20 °С и 60 °С. Запах воды обусловлен наличием в ней летучих пахнущих веществ, которые попадают в нее естественным путем или со сточными водами. По характеру запахи бывают естественного и искусственного происхождения. Запахи естественного происхождения находят по классификации.
Таблица 2
Таблица 3
Запахи искусственного происхождения называют по соответствующим веществам: камфорный, хлорфенольный, бензиновый, хлорный и т.п. Порядок выполнения. Заполните колбу исследуемой водой на 1/3 объема и закройте пробкой. Взболтайте содержимое колбы. Откройте колбу и осторожно, неглубоко вдыхая воздух, сразу же определите характер и интенсивность запаха. Если запах сразу не ощущается или запах неотчетливый, испытание можно повторить, нагрев воду в колбе до температуры 60 OС (подержав колбу в водяной бане с горячей водой). Интенсивность запаха воды определите по пятибалльной системе со-гласно табл. 4. Таблица 4
Обработка результатов опытов и выводы
Занесите полученные результаты в табл. 5. Приведите данные для каждой точки отбора пробы (каждого анализа). Таблица 5
На основании проведенных исследований сделайте вывод об экологическом состоянии водоема (о качестве воды).
Лабораторная работа 2 ЖЕСТКОСТЬ ВОДЫ И СПОСОБЫ ЕЕ УСТРАНЕНИЯ Цель работы: определение временной и общей жесткости воды. Устранение жесткости воды с помощью катионитов. Жесткость воды - совокупность свойств, вызванных содержанием в воде ионов Са2+и Mg2+. Жесткость, обусловленная содержанием в воде гидрокарбонатов кальция (Са(НСО3)2) и магния (Mg(HCO3)2), называется временной. Она, может быть устранена кипячением воды, так как при кипячении гидрокарбонаты разлагаются и переходят в карбонаты Са(НСО3)2 = ↓СаСО2 + CO2↑ + Н2О; Mg(НСО3)2 = ↓MgСО3 + CO2↑ + Н2О; Карбонат магния гвйдхмшзуется по уравнению 2MgCO3 + Н2О = (MgOH) 2CO3 + СО2. Другие соли кальция и магния не разрушаются при нагревании, они обуславливают постоянную жесткость воды. Общая жесткость вода равна сумме временной и достоянной жесткости. За единицу жесткости принято число миллиэквивалентов (мэкв) катионов Са2+ и Mg2+, содержащихся в 1 дм3 воды. Так как массы одного мэкв ионов Са2+ и Mg2+ соответственно равны 20,04 мг и 12,16 мг, то общую жесткость воды (Ж, мэкв/дм3) вычисляют по формуле Ж = [Ca2+]/20,04 + [Mg2+]/12,16, где [Са2+] и [Mg2+] - концентрации ионов Са2+ и Mg2+, мг/дм3. Вода по величине жесткости (Ж) классифицируется следующим образом: мягкая, Ж < 3 мэкв/дм3; средняя Ж < 3 - 6 мэкв/дм3; жесткая Ж < 6 - 10 мэкв/дм3; очень жесткая Ж > 10 мэкв/дм3. Определение временной (карбонатной) жесткости вода основано на реакции взаимодействия соляной кислоты с растворимыми в воде гидрокарбонатами и карбонатами. Титрование проводят в присутствии метилоранжа, изменяющего свою окраску в точке эквивалентности. Метод определения общей жесткости основан на титровании пробы воды раствором трилона Б, представляющего собой двузамещенную натриевую соль этилендиаминтетрауксусной кислоты
Трилон Б образует прочные комплексные соединения при рН ~ 9 с ионами Са2+ и Mg2+. В качестве индикаторов используются оксинитрокра-сители, например, хромоген черный или хром темно-синий, изменяющие свою окраску в точке эквивалентности. Приборы и реактивы; прибор для удаления общей жесткости воды, фарфоровая ступка, бюретка вместимостью 25 см3, цилиндры мерные вместимостью 10, 50, 100 см3: колба коническая вместимостью 300 см3 -3 шт., микрошпатели, спиртовка, штатив с пробирками; мурексид + NaCl(l:5). Растворы: карбоната натрия, оксалата аммония, хлорида бария, нитрата серебра - 0,05 н; хлорида кальция - 0,01 н; трилона Б - 0,05 н; кислоты соляной - 0,1 н; аммиачной буферной смеси: хромогена черного, метилового оранжевого.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 577; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.171.136 (0.069 с.) |