Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Документация судебно-химического анализа».Стр 1 из 12Следующая ⇒
Курсовая работа по токсикологической химии на тему: «Химико-токсикологический анализ (качественный и количественный) веществ кислого и слабоосновного характера. Методы обнаружения и определения лекарственных веществ при проведении судебно-химического анализа. Документация судебно-химического анализа». Выполнил: студент 4 курса группы 09лф2 Малыгин Р.В Проверил: к.х.н. доцент, Киреев С.Ю.
Пенза, 2013 Содержание: Введение Химико-токсикологический анализ: общие сведения План проведения химико-токсикологического анализа · Осмотр присланного на анализ объекта · Предварительные испытания с объектом · Подготовка объектов к изолированию ядовитых веществ Изолирование токсических веществ путем экстракции и сорбции · Очистка вытяжек из биологического материала на первом этапе изолирования · Очистка экстрактов на втором этапе изолирования Изолирование лекарственных и наркотических веществ амфифильными растворителями · Изолирование подкисленным спиртом · Изолирование нейтральным ацетоном · Изолирование подкисленной водой · Изолирование подщелоченной водой Методы обнаружения ядовитых веществ в извлечениях из объектов 7. Методы предварительного анализа. Аналитический скрининг · ТСХ-скрининг в нормально-фазовом варианте · Газожидкостная хроматография · Иммунохимические методы скрининга лекарственных и наркотических веществ · Аналитический скрининг с помощью химических реакций Методы подтверждающего анализа · Методы высокоэффективной жидкостной хроматографии (ВЭЖХ) · Методы ИК- и УФ-спектроскопии · Хроматомасс-спектрометрия · Люминесцентный метод анализа · Микрокристаллоскопический метод Документация судебно-химического анализа
Введение
Токсикологическая химия – наука о молекулярных и физиологических механизмах действия токсических веществ и продуктов их метаболизма, химических методах их изолирования, идентификации и количественного определения в различных объектах. Главной задачей токсикологической химии является доказательство наличия токсического вещества в различных объектах исследования.
Непосредственной целью токсикологической химии как прикладной науки является разработка объективных методов обнаружения и количественного определения химических соединений, которые могут быть применены к объектам химико-токсикологического (судебно-химического) анализа. Основные задачи, которые решает токсикологическая химия, можно определить следующим образом: 1. Разработка новых и усовершенствование применяемых методов изолирования и очистки извлечений из различны объектов на потенциально опасные для человека и животного химические соединения и их метаболиты. 2. Внедрение в практику химико-токсикологического анализа новых чувствительных и специфических реакций, методов обнаружения и количественного определения токсических веществ и их метаболитов. 3. Совершенствование и разработка методов судебно-химической экспертизы вещественных доказательств на ядовитые, сильнодействующие, наркотические и другие вещества. 4. Разработка экспресс-методов анализа биологических жидкостей с целью диагностики острых отравлений, выбора и коррекции методов их лечения. 5. Разработка новых методов анализа для аналитической диагностики алкогольного, наркотического и токсикоманического опьянения. 6. Оценка и необходимая информация о степени токсичности и «токсической ситуации», связанной с поступлением чужеродных соединений в организм человека или животного. Многие из перечисленных задач стояли перед токсикологической химией на протяжении столетия. Развитие химии и технологии включает в оборот все новые и новые соединения и ставят перед токсикологической химией задачи по их обнаружению и определению в различных биологических объектах. [1, 4] План проведения химико-токсикологического анализа
Необходимость составления плана анализа определяется тем, что объекты исследования нельзя продублировать. При острых отравлениях ядовитыми веществами кровь, моча и другие жидкости организма человека быстро изменяются, и повторных их анализ даст совершенно другие результаты. При смертельных отравлениях вещественные доказательства вторично не могут быть представлены.
Составление плана химико-токсикологического анализа зависит от природы и характера объекта исследования, поставленных перед экспертом вопросов, содержания сопроводительных документов и результата наружного осмотра объекта. План ХТА должен быть построен так, чтобы наиболее рационально и с малой затратой времени решить главную задачу – обнаружить и определить количественно ядовитые вещества и (или) их метаболиты в исследуемых объектах. Составление плана проводится в соответствии с Приказом МЗ РФ №289 от 5.10.1989 г. и Приказом МЗ РФ №161 от 24.04.2003 г. в следующем порядке:
Предварительные испытания с объектом
Предварительные испытания преследуют цель сократить время исследования объекта, что особенно важно при ненаправленном анализе. Такие испытания позволяют сузить круг веществ в окончательном испытании и определить направление его основного исследования. Обычно для предварительных испытаний подбирают групповые реакции, обладающие высокой чувствительностью. С их помощью можно обнаружить не только токсические, но и терапевтические дозы принятых веществ, а иногда и естественно содержащиеся в объекте соединения. Поэтому делать вывод, что найденное вещество явилось причиной отравления, только по результатам предварительных испытаний недопустимо. Положительный результат предварительных испытаний указывает на то, что в исследуемом объекте может быть найдено одно вещество или группа веществ, которые дают такие же реакции. В этом случае в план анализа включается основное исследование на эту группу соединений с использованием специальных приемов, методов и подтверждающих реакций. Отрицательный результат предварительных испытаний указывает на отсутствие соответствующих веществ в исследуемом объекте, и данное вещество (или группа веществ) исключается из плана анализа, после окончания экспертизы делается заключение о его (или их) необнаружении. Подготовка объектов к изолированию ядовитых веществ
Внутренние органы (печень, почки, мышечная ткань). Органы измельчают до размеров кусочков 0,5*0,5*0,5 см. Естественно, что более мелкое измельчение приводит к увеличению экстракционной поверхности и одновременно к значительному увеличению количества балластных эндогенных соединений (белков, ферментов, продуктов распада белковых молекул, пигментов и др.) в извлечении. При этом химик вынужден будет применить особые способы очистки, что приведет к потере токсических веществ, особенно при их следовых количествах в объекте. Рекомендуется использовать также вымораживание объекта при температуре -30-400С. При этом в органах образуются льдинки, которые разрывают клетки, ткани и способствуют выходу токсических веществ в окружающую среду, что увеличивает процент изолирования искомых соединений. Можно использовать лиофилизацию, т. е. высушивание объекта при низких температурах в вакууме. Это приводит к потере объектом воды и получению при изолировании более чистых извлечений. Если объект законсервирован спиртом, его осторожно удаляют. В случае подозрения на отравление летучими соединениями мышьяка, ртути объект подщелачивают перед удалением спирта карбонатом натрия.
Для анализа берут навеску объекта 5, 25, 50 или 100 г (зависит от конкретной методики). Кровь. Ядовитые вещества и их метаболиты в крови находятся в свободном виде или могут быть связаны с белками (альбуминами, глобулинами). При пробоподготовке крови к экстракции используют приемы, позволяющие разрушить комплекс анализируемого вещества с белком. Для этой цели рекомендованы следующие методы: 1. Добавление к крови смешивающихся с водой органических растворителей (этилового, метилового спиртов, ацетонитрила, ацетона). Их количество в 10 раз превышает объем крови. Эффективность очистки от белков зависит от величины диэлектрической проницаемости используемого растворителя. При понижении диэлектрической проницаемости сила притяжения между молекулами растворенных веществ возрастает. В результате под влиянием ацетона и спиртов (этилового и метилового) происходит агрегация молекул белковых веществ крови, понижается растворимость и происходит выпадение их в осадок. 2. Добавление химических агентов для коагуляции белков: кислот (трихлоруксусной, хлорной), солей тяжелых металлов (например, солей бария). 3. Термическая обработка крови. Этот метод используют для ядовитых веществ, которые не разлагаются при повышенной температуре. Он не рекомендуется при анализе объекта, содержащего термолабильные соединения. Процесс пробоподготовки крови к анализу – весьма ответственная операция, при которой возникает опасность адсорбции значительного количества анализируемого вещества на скоагулированном белке. Моча. С мочой токсические вещества выделяются как в неизменном состоянии, так и в виде метаболитов и конъюгатов с серной, уксусной, глюкуроновой кислотами. Пробоподготовка мочи к экстракции токсических веществ и их метаболитов включает проведение разрушения конъюгатов с указанными кислотами. Для этой цели проводят неспецифический кислотный или специфический ферментативный гидролиз. Кислотный гидролиз является более быстрым и простым в осуществлении. Однако вследствие неспецифичности реакции расщепления ковалентной связи и жестких условий проведения в среде концентрированной кислоты при кипячении в течение длительного времени или при нагревании в автоклаве под давлением, образуется большое количество побочных продуктов. Экстракция органическим растворителем из полученного гидролизата дает высокий фон и много посторонних пиков при проведении анализа методом газовой хроматографии. Кислотный гидролиз проводится в герметично закрытых сосудах, которые помещают в водяные бани или специальные нагревательные блоки. Можно использовать кипячение с обратным холодильником или нагревание при 100-1250С в автоклаве под давлением 12-15 пси.
Ферментативный гидролиз проводится в присутствии одного или смеси ферментов β-сульфатазы и β-глюкуронидазы в мягких условиях, что уменьшает образование побочных продуктов, и гидролизат получается более чистым. Существенным недостатком методами являются необходимость соблюдения строгих условий гидролиза: рН, температуры, состава буфера, активности ферментов, - а также длительность процесса (12-20 ч). Легче гидролизуются конъюгаты, образованные через кислород фенольного гидроксила, более длительно – конъюгаты, связанные через кислород спиртовой (гидроксильной) группы. Слюна. Для снижения активности ферментов слюну при хранении замораживают. Перед экстракцией ее разбавляют водой очищенной в отношении 1:3, после чего экстрагируют токсические вещества органическими растворителями при соответствующем значении рН. Волосы, ногти. Для удаления внешних загрязнений волосы и ногти отмывают 2М раствором хлороводородной кислоты и метанолом (или этанолом), затем сушат при комнатной температуре и отбирают для анализа навеску 30-40 мг.[1, 4, 6, 9]
Метод Стаса-Отто Метод предложен в 1851 г. бельгийским химиком Ж.С. Стасом для изолирования никотина из внутренних органов трупа. В 1856 г. Юлий и Роберт Отто ввели в этот метод очистку от примесей с помощью органических растворителей. В настоящее время он известен как метод Стаса-Отто. На протяжении многих десятилетий этот метод подвергался различным модификациям с учетом факторов, влияющих на изолирование ядовитых веществ. В настоящее время метод применим для выделения не только алкалоидов, но и веществ кислотного, слабоосновного характера, в том числе синтетических лекарственных и наркотических средств. Схема метода 1-й этап. Навеску объекта массой 100 г настаивают три раза по 24 часа с 96% этиловым спиртом, подкисленным щавелевой кислотой до рН=2,5-3,0. Спиртовые вытяжки упаривают при 400С и в полученном остатке многократно осаждают белки 96% спиртом. Очищенный остаток растворяют в 20-25 мл воды.
2-й этап. Водный раствор последовательно экстрагируют хлороформом при рН=2 и рН=8-10 после подщелачивания 25% раствором аммиака. В экстракт при рН=2 переходят вещества кислотного и слабоосновного характера. В экстракт при рН=8-10 переходят вещества основного характера. Оценка метода Достоинство метода состоит в том, что он позволяет извлекать вещества различной природы. Кроме того, этиловый спирт вызывает осаждение белков, что очень важно при работе с трупным материалом. Недостатком метода являются его длительность выполнения и возможны потери искомых веществ за счет адсорбции их белками при осаждении и фильтровании. Однако несмотря на это и на появление новых методов изолирования, метод Стаса-Отто не теряет значения, особенно при исследовании объектов, подвергшихся сильным гнилостным изменениям.
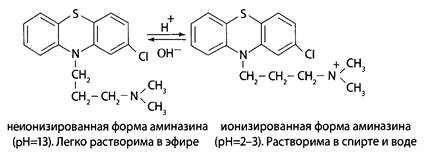
Метод Е.М. Саломатина. Экстракция подкисленным спиртом хорошо обоснована Е.М. Саломатиным при определении производных фенотиазина в биологических объектах. Обладая слабыми основными свойствами, производные фенотиазина при рН=2-3 образуют ионизированную форму, а при рН>7 – неионизированную.
Используя эти свойства, удалось выделить и очистить от примесей анализируемые соединения и их основные метаболиты - сульфоксиды. Схема метода 1-й этап. Объект заливают 96% этиловым спиртом, подкисляют щавелевой кислотой до рН=2-3 и настаивают 3 раза по 2 ч. Спиртовые вытяжки упаривают при 400С до густоты сиропа. В остатке осаждают белки 96% спиртом, фильтруют и выпаривают досуха. Очищенный остаток растворяют в 100 мл воды, нагретой до температуры 40-600С, охлаждают и фильтруют. 2-й этап. Фильтрат экстрагируют дважды диэтиловым эфиром при рН=2-3. Затем водную фазу подщелачивают 50% раствором гидроксида натрия и вновь экстрагируют диэтиловым эфиром. Объединенные эфирные вытяжки взбалтывают с 0,5 М раствором серной кислоты и полученный кислый водный реэкстракт используют для обнаружения производных фенотиазина. Оценка метода По данным автора, метод позволяет достичь максимальной экстракции при изолировании и уменьшить потери исследуемых веществ как при изолировании, так и при экстракции.
Метод Степанова-Швайковой 1-й этап. Навеску растительного объекта массой 5 г заливают водой очищенной (1:12), подкисляют щавелевой кислотой до рН=2-2,5 и настаивают 2 ч. Водную вытяжку центрифугируют в течение 30 мин при 3000 об./мин. Прозрачную жидкость отделяют от осадка. 2-й этап. Центрифугат экстрагируют последовательно хлороформом при рН=2, затем при рН=10 после подщелачивания 25% раствором аммиака.
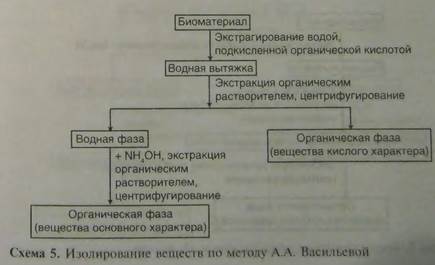
Метод А.А. Васильевой 1-й этап. Навеску измельченного биологического объекта массой 100 г заливают водой очищенной (1:2), подкисляют щавелевой кислотой до рН=2-2,5 и настаивают 2 раза: 2 ч и 1 ч при периодическом взбалтывании. Водную вытяжку процеживают через двойной слой марли и центрифугируют. Надосадочную прозрачную жидкость отделяют.
2-й этап. Центрифугат экстрагируют последовательно хлороформом при значениях рН=2, затем при рН=10 после подщелачивания 25% раствором аммиака. Оценка методов. Методы Степанова-Швайковой и Васильевой уменьшают время на выполнение анализа по сравнению с методом Стаса-Отто в 3-4 раза и позволяют изолировать меньшие количества ряда алкалоидов. Они не требуют затраты этилового спирта, но не пригодны при анализе сильно загнивших объектов.
Метод В.Ф. Крамаренко
1-й этап. Навеску измельченного объекта массой 100 г заливают 0,02 М раствором серной кислоты (рН=2,5) и настаивают 2 раза: 2 ч и 1 ч. Водные вытяжки центрифугируют, отделяют от осадка, насыщают сульфатом аммония и вновь центрифугируют. Центрифугат (рН=2,5) экстрагируют диэтиловым эфиром с целью очистки. 2-й этап. Водную фазу после подщелачивания до рН=8,5-9 раствором гидроксида натрия экстрагируют 4 раза хлороформом. Оценка метода. В методе максимально учтены химические свойства алкалоидов и органических оснований. Поэтому условия изолирования и последующей экстракции оптимальны для определения алкалоидов.
Метод В.И. Поповой 1-й этап. Измельченный объект массой 100 г заливают 80 мл 0.02 М раствора серной кислоты (рН=2-3) и настаивают 3 раза: 2 ч, 1 ч и 1 ч. Водную вытяжку процеживают через тройной слой марли и центрифугируют в течение 25-30 мин при скорости 3000 об./мин. Надосадочную жидкость отделяют и очищают с помощью гель-хроматографии. С этой целью был предложен гель сефадекс G-25. Барбитураты с колонки элюируют с помощью 0,02 М раствора серной кислоты. 2-й этап. Элюат подвергают концентрированному экстрагированию путем повторной экстракции хлороформом или диэтиловым эфиром. Оценка метода. Метод обеспечивает хорошую очистку извлечений. Он применим при исследовании объектов, подвергшихся гнилостным изменениям, однако может использоваться для изолирования ограниченного числа веществ, в частности барбитуратов.
Метод П. Валова
1-й этап. Измельченный объект массой 100 г заливают 180 мл подщелоченной воды (рН=10) и настаивают в течение 30 мин. Щелочную вытяжку центрифугируют. Надосадочную жидкость (центрифугат) подкисляют серной кислотой до рН=2. В полученном растворе с помощью вольфрамата натрия при нагревании осаждают белки и смесь вновь центрифугируют. 2-й этап. Барбитураты из центрифугата экстрагируют диэтиловым эфиром при значении рН=2. Эфирный слой отделяют и проводят реэкстракцию водным раствором гидроксида натрия. Щелочной водный экстракт подкисляют серной кислотой до рН=2 и барбитураты извлекают равным объемом диэтилового эфира. Такая повторная экстракция позволяет получить чистые извлечения. Оценка метода. Метод эффективен, позволяет выделить 50-90% барбитуратов и получить достаточно чистые извлечения. Недостатком метода является сорбция некоторых барбитуратов белками. [3,4,8 ]
Пламенно-ионизационный детектор (ПИД).
Принцип действия основан на измерении тока, возникающего при ионизации молекул органических веществ в пламени водорода. При горении чистого водорода ионы почти не образуются, поэтому электропроводность водородного пламени очень низка. Органические вещества, сгорающие в пламени водорода, образуют ионы или радикалы. Появление заряженных частиц обуславливает электропроводность пламени. Увеличение электропроводности повышает силу ионного тока, которая отображается на хроматограмме в виде пика. Чувствительность ПИД – 10-910-12 г. На кривой разделения каждому пику свойственны следующие параметры. Высота пика (2) – это расстояние от вершины пика до его основания (3). Площадь пика (4) – площадь, заключенная между контуром пика и его основанием. Основание пика (3) – отрезок нулевой линии (1) между крайними точками пика.
Качественной характеристикой в газожидкостной хроматографии считаются: · Время удерживания вещества. Это время от момента введения смеси веществ в дозатор до момента вычерчивания максимума пика самописцем. При постоянных условиях анализа характерно для данного вещества. · Относительное время удерживания. Это отношение времени удерживания исследуемого вещества к времени удерживания стандарта. · Объем удерживания. Эту величину получают путем умножения времени удерживания на объемную скорость газа-носителя. Это общий объем подвижной фазы, необходимый для удаления данного вещества из колонки. · Относительный объем удерживания. Его определяют в присутствии стандартного вещества путем деления найденного времени удерживания компонентов на время удерживания стандартного вещества после вычитания времени удерживания инертного газа-носителя из обоих значений времени удерживания. · Удельный удерживаемый объем. Это объем удерживания на 1 г неподвижной жидкой фазы. Эта величина является константой, подобной точке кипения, и более надежна для идентификации. · Индекс удерживания (I). Индекс удерживания предложен Ковачем в 1958 г. Он основан на логарифмической шкале, в которой нормальные парафины имеют значения индексов удерживания, в 100 раз превышающее число атомов углерода в их молекуле. Величины I/100 рассматривают как число атомов углерода в н-парафине, который определялся бы с интересующим веществом. Индекс удерживания – более воспроизводимая характеристика для вещества, чем относительный объем удерживания. Он пропорционален логарифму удельного объема удерживания. В основе идентификации веществ с помощью ГЖХ – сравнение индекса удерживания неизвестного вещества с индексом удерживания известного соединения.
Инфракрасная спектроскопия Спектр поглощения в инфракрасной области представляет собой сложную кривую с большим числом максимумов и минимумов. Спектральные характеристики (положение максимумов полос, их полуширина, интенсивность) индивидуальной молекулы зависят от масс составляющих ее атомов, геометрического строения, особенностей межатомных сил, распределения заряда и др. Поэтому ИК-спектры строго индивидуальны, что особенно ценно для идентификации вещества. Совокупность все полос поглощения, образующая ИК-спектр данного соединения, однозначно определяет его индивидуальность, используется для определения подлинности лекарственного (токсического) вещества и подтверждает его нахождение в извлечениях из объектов химико-токсикологического анализа. ИК-спектроскопия используется для обнаружения многих органических соединений, имеющих токсикологическое значение. Методика обнаружения веществ кислотного и основного характера сводится к следующему: сухой остаток после испарения органического растворителя (экстракта из биологического объекта) растирают с сухим мелкоизмельченным бромидом калия в соотношении 1:200 или 1:300 (зависит от марки прибора). Часть смеси переносят в специальную матрицу и прессуют. Полученный прозрачный диск помещают в прибор ИК-спектрофотометр и проводят измерения. Параллельно анализируют стандартный образец. Совпадение полос поглощения в обоих спектрах свидетельствует об идентичности веществ. Если отсутствует стандартный образец, то пользуются сборниками спектров (атласами), в которых приводятся спектры веществ и точные условия приготовления пробы для анализа. Метод отличается универсальностью, избирательностью и весьма характерен. Надежная идентификация токсических веществ с помощью этих методов может быть проведена только после тщательной очистки извлечений из объекта. ИК-спектр для папаверина
Хроматомасс-спектрометрия
Масс-спектрометрия, масс-спектральный анализ – метод анализа веществ путем определения масс (чаще отношения масс к заряду m/z) и относительного количества ионов, получаемых при ионизации исследуемых веществ или уже присутствующих в изучаемой смеси. Совокупность значений m/z и относительных величин токов этих ионов представляет собой график, который называют масс-спектром вещества. С помощью масс-спектрометрии можно измерить точную молекулярную массу органического соединения, рассчитать элементный состав, установить химическое и пространственное строение, изотопный состав, провести качественный и количественный анализ сложной смеси. В настоящее время используется сочетание хроматографического и масс-спектрометрического методов. Этот метод получил название хроматомасс-спектрометрии. Хроматомасс-спектрометры выпускаются в двух вариантах – в комбинации с газовым или газожидкостным хроматографом (соответственно ГХ или ГЖХ) для анализа веществ, находящихся в газовой фазе или в комбинации с высокоэффективным жидкостным хроматографом для анализа труднолетучих, полярных и термолабильных веществ. Если в лаборатории имеется только комплект ГХ – масс-спектрометр, то при анализе малолетучих (барбитураты и др.), полярных соединений и их метаболитов (опиаты и др.) для использования метода необходима дериватизация исследуемых веществ. Дериватизация позволяет исключить потери веществ из-за низкой летучести или сильной полярности. При анализе полярных соединений за счет дериватизации вещества превращаются в менее полярные и более летучие. Хроматомасс-спектрометр представляет собой сложный прибор, включающий ионооптическую, высоковакуумную системы, электронную аппаратуру для усиления и измерения ионных токов, а также хроматографический узел для разделения смеси. Исследуемую пробу вводят в хроматограф, где происходит разделение смеси веществ. Поток разделенных веществ с газом-носителем проходит через специальный сепаратор, который отделяет газ-носитель от вещества. Затем исследуемое соединение попадает в ионизационную камеру масс-спектрометра. В этой камере частицы веществ ионизируются и поступают в масс-анализатор, где они делятся по массам. Относительные значение сил токов, возникающих за счет ионов с разной массой, измеряются системой регистрации. Масс-спектр смеси веществ представляет собой ряд последовательно расположенных пиков веществ. Деление веществ по массам в анализаторе осуществляется под действием магнитного поля (чаще однородного). При прохождении пучка ионов через магнитное поле ионный пучок фокусируется на щель приемника. В процессе фокусировки пучок ионов с массой m отделяется от ионов с массой m+Dm. Этот процесс происходит в плоскости щели приемника на расстояние, которое определяется величиной дисперсии (или разделяющей способности) прибора. Таким образом, разрешающая сила хроматомасс-спектрометра – это мера его способности разделять два иона с определенной разницей масс. Детектор (регистрирующее устройство) в приборе осуществляет регистрацию электрических сигналов в определенной последовательности. Непрерывная запись полного ионного тока в течение всего времени хроматографического разделения представляет собой хроматограмму смеси. В момент появления максимумов на хроматограмме масс-спектрометр быстро записывает полный масс-спектр каждого компонента с интервалом в 1-2 с. Масс-спектр является качественной характеристикой разделяемой смеси и позволяет идентифицировать ее компоненты (предел обнаружения веществ 10-12 г/мл). Идентификация веществ, выделенных из биологического объекта, проводится по времени удерживания и соответствующему каждому пику на хроматограмме масс-спектру с определенной величиной отношения массы иона к его заряду. Хроматомасс-спектрометрия является универсальным методом, позволяющим работать с весьма сложными смесями, содержащими всего 10-10-10-14 г/мл определяемого компонента, что в миллиарды раз меньше требуемых количеств вещества для обычных масс-спектрометров. Это особенно ценно для определения следовых количеств ядовитых веществ в биологических жидкостях, волосах и в трупном материале.
Заключение
Результаты химико-токсикологического анализа зависят от правильного выбора объектов исследования, соблюдения правил химико-токсикологического анализа биологического материала на наличие токсических веществ, правильного выбора методов исследования и некоторых других факторов. Понимание причин, вызывающих нарушения в функционировании биохимических систем, путей превращения ядов позволяет найти правильное решение для их определения и интерпретации результатов химико-токсикологического анализа. Поэтому результаты химико-токсикологического анализа оцениваются в сочетании с данными осмотра больного, клиническими исследованиями, результатами судебно-химического и гистологического исследований. Использование совокупных данных позволяет поставить точный диагноз о природе ядовитого вещества и причине болезненного состояния человека или смертельных исходов.[4]
Список использованной литературы:
1. Токсикологическая химия: учебник для вузов/ под ред. Т.В. Плетеневой. – 2-е изд., испр. – М.: ГЭОТАР-Медиа, 2006. – 512 с. 2. Токсикологическая химия. Практикум/ Т.В. Плетенева. – М.: Эксмо, 2008. – 528 с. – (Медицинское образование). 3. Больбух Т.В.Основы токсикологической химии: учебное пособие (для студентов, обучающихся на биолого-химическом факультете по специальности «Химия»). - Горно-Алтайск: РИО ГАГУ, 2009. 4. Токсикологическая химия: учебник/ Т.Х. Вергейчик; под ред. Проф. Е.Н. Вергейчика. – М.: МЕДПресс – информ, 2009 – 400 с. 5. Швайкова Мария Дмитриевна. Токсикологическая химия. Издательство «Медицина», Москва, 1975. 6. Крамаренко В.Ф. Токсикологическая химия. – К.: Выща шк. Головное изд-во, 1989. – 447 с. 7. Приказ МЗ и СР РФ от 27.01.2006 №40 «Об организации проведения химико-токсикологических исследований при аналитической диагностике в организме человека алкоголя, наркотических средств, психотропных и других токсических веществ». 8. ТСХ-скрининг токсикологически значимых соединений, изолируемых экстракцией и сорбцией; учеб. пособие для самост. подгот. студентов, обучающихся по специальности «Фармация» - 060108 / Г.В. Раменская [и др.]; под ред. А.П. Арзамасцева. – М.: ГЭОТАР-Медиа,2010 – 240 с. 9. Токсикологическая химия. Метаболизм и анализ токсикантов: учебное пособие / под ред. проф. Н.И. Калетиной. – М.: ГЭОТАР-Медиа, 2008. – 1116 с.
Курсовая работа по токсикологической химии на тему: «Химико-токсикологический анализ (качественный и количественный) веществ кислого и слабоосновного характера. Методы обнаружения и определения лекарственных веществ при проведении судебно-химического анализа. Документация судебно-химического анализа». Выполнил: студент 4 курса группы 09лф2 Малыгин Р.В Проверил: к.х.н. доцент, Киреев С.Ю.
Пенза, 2013 Содержание: Введение
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 1930; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.104.248 (0.101 с.) |