
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация обратимых электродов.
Классификация обратимых электродов основана на свойствах веществ, участвующих в потенциалопределяющих процессах. Электроды первого рода. Это металлические электроды, обратимые относительно катионов (в том числе амальгамные) и металлоидные, обратимые относительно анионов (например, Se2-/Se). В таких электродах восстановленной формой является металл, а окисленной – ион этого металла. Если электрод обратим относительно катиона, то
Если электрод обратим относительно аниона, то
К электродам первого рода относятся также газовые электроды (водородный, кислородный, хлорный). Они могут быть обратимы по отношению к катиону или аниону. Металл в газовых электродах необходим для создания электронопроводящего контакта между газом и раствором, должен быть инертен по отношению к веществам, находящимся в растворе, и способен катализировать только один потенциалопределяющий процесс. Например, водородный электрод обратим по отношению к катиону. Уравнение электродного процесса в кислой среде
может быть записано в упрощенном виде:
Потенциал водородного электрода определяется выражением
Примером газового электрода, обратимым по отношению к аниону, может быть хлорный электрод с потенциалопределяющей реакцией Электроды второго рода. Элетродом второго рода называют систему, в которой металл покрыт слоем его труднорастворимого соединения (соли, оксида и гидроксида), а в растворе находятся анионы, одноименные с анионами, содержащимися в этом труднорастворимом соединении:
Рассмотрим в качестве примера хлорсеребряный электрод, представляющий собой серебряную пластинку, покрытую слоем хлорида серебра и погруженную в раствор HCl):
В потенциалопределяющей реакции на этом электроде принимают участие как катионы, так и анионы. Электрохимическому процессу
сопутствует химическая реакция, приводящая к осаждению или растворению AgCl:
Суммарное уравнение реакции, согласно которой электрод обратим относительно аниона:
Реакции III соответствует следующее уравнение для расчета электродного потенциала:
Хлорсеребряный электрод можно рассматривать и как электрод первого рода, обратимый относительно катиона (реакция I), у которого активность ионов серебра в растворе определяется растворимостью AgCl. Потенциал электрода равен
Для труднорастворимой соли AgCl
Сочетание (9.23) и (9.24) приводит к следующему выражению:
Тогда
и связь стандартных потенциалов реакций I и III определяется уравнением
Стандартный потенциал хлорсеребряного электрода при 298.15 К равен
Другим примером электрода второго рода является каломельный электрод (рис. 8), состоящий из ртути, покрытой пастой, содержащей каломель, и соприкасающейся с раствором KCl:
потенциал каломельного электрода определяется выражением
Рис. 8. Каломельный электрод. 1 — ртуть, 2 — платиновая проволока, 3 — паста из каломели, 4 — стеклянная трубка, 5 — пробка, 6 — боковая трубка, 7 — сифон, 8 — раствор KCl. По концентрации применямого раствора KCl различают 0,1 н., 1 н. и насыщенный каломельные электроды. Последний используется наиболее широко. Зависимость его потенциала от температуры описывается уравнением
Вследствие устойчивости потенциалов электроды второго рода используются как электроды сравнения при потенциометрических измерениях. Для этой цели наиболее употребительны каломельный и хлорсеребряный электроды. Электроды третьего рода. Такой электрод представляет собой металл, на котором осаждены две труднорастворимые соли. Например, серебро, покрытое сначала хлоридом серебра, а затем хлоридом свинца. Электрод погружен в раствор растворимой соли свинца (PbNO3). Уравнение электродной реакции следующее:
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1638; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.119.17 (0.006 с.) |
 ,
,  .
.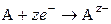 ,
,  .
.
 .
.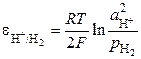 .
. .
. .
. .
. (I)
(I)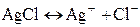 . (II)
. (II) . (III)
. (III) . (9.22)
. (9.22)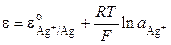 . (9.23)
. (9.23) . (9.24)
. (9.24) . (9.25)
. (9.25)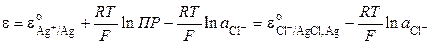 (9.26)
(9.26) . (9.27)
. (9.27)
 . Потенциалопределяющая реакция:
. Потенциалопределяющая реакция: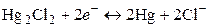 ;
; .
.

 .
.


