
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поверхностные явления и адсорбция
Теоретическая часть Рассмотрим систему, состоящую из находящихся в контакте жидкой и газовой фаз, и две молекулы, принадлежащие жидкой фазе:
2 – расположенную на поверхности жидкости. Силы сцепления, действующие со стороны окружающих молекул на молекулу 1, уравновешивают друг друга, и их равнодействующая равна нулю. Рассмотрим молекулу 2, расположенную на границе раздела фаз. В этом случае со стороны граничащих фаз действуют силы разного значения, так как силы притяжения единицы объема жидкости много больше, чем единицы объема воздуха. Равнодействующая межмолекулярных сил в поверхностном слое не равна нулю и направлена внутрь жидкости, где силы притяжения больше. Силы притяжения втягивают молекулы жидкости с поверхности вглубь объема, уменьшая площадь поверхности до минимально возможной при данных условиях (шарообразная форма мелких капель находящихся в свободном состоянии). Для увеличения поверхности жидкости нужно преодолеть силу внутреннего притяжения и совершить определенную механическую работу. Если увеличение поверхности производится при постоянных давлении и температуре, то оно сопровождается увеличением поверхностной энергии системы (энергии Гиббса). Изменение поверхностной энергии Гиббса с изменением величины поверхности при постоянных Р и Т равно: Δ G = σ · ΔS, где σ – поверхностное натяжение, единица измерения σ согласно системе СИ – Дж/м2. Согласно второму закону термодинамики, энергия Гиббса системы самопроизвольно стремится к минимуму. У индивидуальных жидкостей уменьшение поверхностной энергии Гиббса осуществляется в основном за счет сокращения поверхности (слияния мелких капель в более крупные). Понизить поверхностную энергию дисперсная система (состоящая из дисперсной фазы и дисперсионной среды) может, уменьшив площадь поверхности раздела. Для этого частицы должны укрупниться. Слияние частиц дисперсной фазы и их укрупнение называется коагуляцией. Укрупненные частицы под действием собственной тяжести начинают выпадать в осадок. Этот процесс медленный и носит название седиментации. В результате коагуляции и седиментации частицы дисперсной фазы выпадают в осадок. В результате образуется система, содержащая осадок и над ним растворитель, а дисперсная система как таковая перестает существовать. Данный путь понижения поверхностной энергии ведет к разрушению дисперсной системы.
Второй путь понижения поверхностной энергии – это сорбция. Сорбция – это поглощение газов, паров и растворенных веществ твердыми веществами и жидкостями. Различают: 1) адсорбцию – поглощение поверхностью твердого тела или поглощение на границе раздела жидкость–жидкость и жидкость–газ (пар); 2) абсорбцию – объемное поглощение жидкостью или твердым телом; 3) хемосорбцию – поглощение с образованием химических соединений; 4) капиллярную конденсацию, выражающуюся в образовании жидкой фазы в порах и капиллярах поглотителя. Поглотитель – вещество сорбент (адсорбент); поглощенное вещество – сорбат (адсорбат).
 Процесс адсорбции твердым адсорбентом растворенного вещества из жидкого раствора определяется природой адсорбтива (вещества, которое может адсорбироваться). Рассмотрим строение поверхностно-актив-ных веществ (ПАВ). Они обладают дифильной природой благодаря тому, что состоят из двух частей: полярной, проявляющей гидрофильные свойства, и неполярной, обладающей гидрофобными свойствами. Процесс адсорбции твердым адсорбентом растворенного вещества из жидкого раствора определяется природой адсорбтива (вещества, которое может адсорбироваться). Рассмотрим строение поверхностно-актив-ных веществ (ПАВ). Они обладают дифильной природой благодаря тому, что состоят из двух частей: полярной, проявляющей гидрофильные свойства, и неполярной, обладающей гидрофобными свойствами.
Итак, адсорбция – это процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой или на границе раздела фаз. Для количественного описания адсорбции на границе раздела жидкость–газ используется уравнение Гиббса:
где Г – величина адсорбции, моль/м2; С – равновесная концентрация растворенного вещества, моль/л; Для ПАВ: Для поверхностно-инактивных веществ (ПИВ), адсорбция которых в поверхностном слое, напротив, повышает поверхностное натяжение (например, в присутствии сильных электролитов): Величина адсорбции на границе раздела твердое тело–жидкость, твердое тело–газ описывается с помощью уравнения Ленгмюра:
где Г – величина адсорбции, моль/м2; С – равновесная концентрация, моль/л, К – константа адсорбционного равновесия.
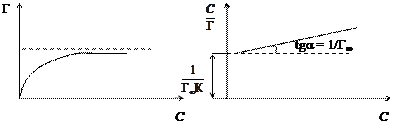
При малых концентрациях можно допустить, что 1 + К С» 1, тогда Г=Г¥×К С, следовательно, величина адсорбции растет пропорционально концентрации (начальный участок кривой), при больших концентрациях К С >> 1 и К С /1 + К С» 1, тогда Г = Г¥ (горизонтальный отрезок кривой). Это соотношение отвечает насыщению при высоких концентрациях, когда вся поверхность адсорбента покрывается мономолекулярным слоем адсорбата. Экспериментальные результаты обычно обрабатываются с помощью уравнения Ленгмюра, записанного в линейной форме:
По экспериментальным данным можно определить площадь, занимаемую одной молекулой (S 0): Уравнение Ленгмюра справедливо для мономолекулярной адсорбции на адсорбенте с энергетически эквивалентными адсорбционными центрами. Зависимость поверхностного натяжения раствора от концентрации поверхностно-активного вещества выражается также эмпирическим уравнением Шишковского: Δσ = σ0 − σ = А×ln(1 + К С), где σ0 и σ – поверхностное натяжение чистого растворителя и раствора на границе с воздухом (паром); А – константа; К – индивидуальная константа, характеризующая поверхностную активность вещества; С – концентрация вещества в растворе. Надо отметить, что уравнение адсорбции Гиббса и уравнение Лэнгмюра тождественны, так как они выражают распределение ПАВ между объемом одной из фаз и межфазной поверхностью. Эта взаимосвязь подтверждается тем, что, пользуясь уравнением Шишковского, можно перейти от уравнения Гиббса к уравнению Ленгмюра. С целью приближения к реальным условиям адсорбции принимается экспоненциальное распределение адсорбционных центров по энергиям. Величина адсорбции при этом условии определяется по эмпирическому уравнению Фрейндлиха: К С 1/ n = х / m, где х / m = Г, а К и n – эмпирические постоянные.
Логарифмируя уравнение Френдлиха, получают уравнение, позволяющее определить константы уравнения Фрейндлиха:
 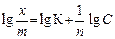 . .
где Г∞– предельная мономолекулярная адсорбция на твердом адсорбенте; k – константа уравнения; P – равновесное давление пара в окружающем пространстве при заданных условиях; Ps – давление насыщенного пара при данной температуре. Используя уравнение БЭТ в линейной форме при низкотемпературной адсорбции простых веществ (азот, аргон, криптон), можно вычислить удельную активную поверхность S уд по уравнению S уд = Г¥ S 0 NA, где S 0 – площадь, занимаемая одной молекулой газа или ПАВ в насыщенном монослое; NA – число Авогадро. Вопросы для самоконтроля 1. За счет чего возникает поверхностное натяжение? 2. Основные способы понижения поверхностного натяжения. 3. Что такое сорбция? Что называют адсорбцией, десорбцией? 4. Какие вещества называют дифильными. Почему? 5. ПАВ повышают или понижают поверхностное натяжение? Почему? Лабораторная работа № 8 ОПРЕДЕЛЕНИЕ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ Цель работы. изучение влияния природы и концентрации растворенного вещества на поверхностное натяжение раствора и на адсорбцию. Опыт 1. Определение поверхностно активных веществ сталагмометрическим методом Поверхностное натяжение измеряется методом отрыва капель – методом сталагмометрии. Выполнение работы. закрепите сталагмометр в штативе, следя за тем, чтобы нижняя площадка находилась в горизонтальной плоскости. На верхний конец сталагмометра наденьте каучуковую пробку с грушей и затяните жидкость выше метки. Затем посчитайте число капель жидкости, вытекающей из объема V от верхней метки до нижней. Повторите опыт три раза, найдите среднее значение, внесите данные в табл. 18. Рассчитайте поверхностное натяжение по формуле
где Таблица 18
Задание. Выполните все расчеты и заполните таблицу. В выводе напишите, что такое поверхностное натяжение и за счет чего возможно его изменение. Опыт 2. Построение калибровочной кривой зависимости поверхностного натяжения растворов лаурилсульфата от их концентрации Выполнение работы. приготовьте растворы лаурилсульфата (простого эфира 1-додеканола и серной кислоты) различной концентрации. Концентрация исходного раствора – 0,5 г/л. Остальные растворы готовьте методом последовательного разбавления исходного раствора (табл. 19). Поверхностное натяжение полученных растворов измерьте методом отрыва капель с помощью сталагмометра: определите число капель воды, содержащееся в таком же объеме раствора, как и вода. Измерения повторите по три раза при условии их хорошей воспроизводимости, найдите среднее значение по полученным данным, рассчитайте величину поверхностного натяжения по следующей формуле:
где s и Полученные результаты внесите в таблицу (табл. 19). Таблица 19
Задание. По полученным данным постройте изотерму поверхностного натяжения s = f (С), которая служит калибровочной кривой для определения концентрации раствора по известной величине поверхностного натяжения. В выводе напишите, как зависит поверхностное натяжение от концентрации раствора. Опыт 3. Изучение адсорбции солей лаурилсульфата на активированном угле Выполнение работы. в 5 стаканов на 100 мл отмерьте с помощью цилиндра по 20 мл раствора лаурилсульфата, подготовленных в опыте № 2, затем внесите одинаковое количество адсорбента – активированного угля по 1 таблетке массой 0,25 г (предварительно растертого в ступке). Процесс адсорбции проводите в течение 30 мин при периодическом перемешивании растворов до установления равновесного состояния в системе. По истечении 30 мин отфильтруйте раствор и измерьте поверхностное натяжение фильтрата сталагмометрическим методом. С помощью калибровочной кривой (опыт 2) по измеренному значению s определите концентрацию фильтрата – (равновесную концентрацию С равн). Затем рассчитайте величину адсорбции лаурилсульфата на активированном угле по уравнению
где X / m – величина адсорбции, г/г; С – концентрация раствора до адсорбции, г/л; С равн – концентрация раствора после адсорбции, г/л; Задание. Полученные результаты внесите в табл. 20. Таблица 20
Постройте график зависимости Г = f (C равн), изотерму адсорбции ПАВ на активированном угле. КОЛЛОИДНЫЕ СИСТЕМЫ Теоретическая часть Коллоидными или дисперсными системами называют системы с высокоразвитой поверхностью раздела между фазами. Дисперсные системы состоят как минимум из двух компонентов: · дисперсионной среды (ДС), которая играет роль растворителя и, следовательно, является непрерывной фазой; · дисперсной фазы (ДФ), распределенной в объеме ДС, в виде мелких кристаллов, твердых аморфных частиц, капель или пузырьков. Классификация систем в зависимости
Таким образом, коллоидными растворами называются такие гетерогенные системы, которые состоят из дисперсной фазы с размером частиц от 10–7 до 10–9 м и дисперсионной среды. В гидрофобных коллоидных растворах между дисперсной фазой и дисперсионной средой нет химического сродства и химического взаимодействия. Это означает, что между частицами дисперсной фазы и дисперсионной средой имеется поверхность раздела фаз, причем чем мельче частицы, тем эта поверхность больше. Строение коллоидной частицы Рассмотрим образование коллоидного раствора хлорида серебра. Если взять два раствора с достаточно высокой концентрацией солей, например, раствор хлорида калия и раствор азотнокислого серебра и слить их, то будем наблюдать образование грубодисперсной системы, в которой нерастворимая соль хлорида серебра выпадает из раствора в осадок. Однако если взять растворы этих солей очень разбавленными и слить в таком соотношении, что одно вещество будет находиться в избытке и выполнять роль стабилизатора, то мы получим микрогетерогенную систему, в которой хлорид серебра в силу каких-то причин не будет выделяться в виде осадка, а будет находиться во взвешенном состоянии: AgNO3 + KClизбыток = AgCl + KNO. Ионное уравнение: Ag+ + NO3– + K+ + Cl– = AgCl + K+ + NO3–. Агрегат, состоящий из m -го количества молекул нерастворимой твердой фазы AgCl, имея кристаллическое строение, будет выступать адсорбентом и адсорбировать на своей поверхности те ионы из раствора, которые способны достраивать кристаллическую решетку. Такими ионами из имеющихся в растворе K+, NO3–, Cl– могут быть только хлорид-ионы. Таким образом, n -е количество Cl–, адсорбирующихся на поверхности твердой фазы и сообщающих ей свой заряд, называются потенциалопределяющими ионами (ПОИ ):
Тогда ионы противоположного знака – противоионы (ПИ), имеющиеся в растворе, в силу электростатического притяжения будут располагаться в растворе рядом с заряженной поверхностью твердой фазы. Значит, на границе твердая фаза/раствор возникнет двойной электрический слой (ДЭС). Следует отметить, что внешняя обкладка ДЭС имеет диффузное строение, т.е. концентрация противоионов асимптотически приближается к нулю по мере удаления от твердой фазы. Поскольку все эти процессы происходят в растворе, то при относительном движении твердой фазы и жидкости (дисперсионной среды) плоскость скольжения лежит на некотором расстоянии (в 2 – 3 ионных или молекулярных радиусах) от твердой фазы. Часть противоионов (n – х) называется адсорбционной частью, а остальная х -часть находится за пределами границы скольжения, в диффузионном слое l. Таким образом, строение коллоидной частицы в краткой записи можно изобразить следующим образом: { m [AgCl] n Cl– (n - х)K+} х – х К+
ядро мицеллы диффузионный слой
адсорбционный слой состоит из ПОИ и (n – x)ПИ
гранула
мицелла Коллоидная частица – гранула, комплекс, заключенный в фигурные скобки, несет на себе заряд по знаку, определяемому потенциал-определяющим ионом, а по величине – определяемый разностью между потенциалопределяющими ионами и противоионами. Другая часть противоионов, диффузно распределяющаяся в растворе – х К+ – завершает строение мицеллы. Гранула заряжена, мицел- φ = (2,3 RT / nF) · lg(C 0 / C p),
Если поверхность скольжения твердой и жидкой фаз относительно друг друга в растворе проходит на границе адсорбционного и диффузионного слоев, то можно сказать, что на этой границе сохраняется часть потенциала, который связан с относительным перемещением фаз и называется электрокинетическим или ζ - (дзета) потенциалом. Величина ζ-потенциала существенно зависит от толщины диффузного слоя: чем меньше концентрация электролитов, тем больше толщина l и тем большее значение имеет ζ-потенциал. А это означает, что в разбавленных растворах коллоидные частицы несут на себе больший заряд, и именно он препятствует их объединению в более крупные агрегаты и выпадению в осадок. Значит ζ-потенциал является основным, но не единственным фактором, препятствующим агрегации коллоидных частиц и поддерживающим их во взвешенном состоянии. Золями (лиозолями, коллоидными растворами) называют такие высокодисперсные коллоидные системы, в которых дисперсионной средой является жидкость, например, если ДС – вода, то получают гидрозоль. Далее золи подразделяются на гидрофильные и гидрофобные. Гидрофильные золи образуются такими веществами, как крахмал, желатин, яичный желток и белок и многие красители. Приготовление гидрофильных золей, как правило, – процесс самопроизвольный, они термодинамически устойчивы и могут существовать длительное время при сохранении условий их образования. В гидрофильных золях вода играет двоякую роль: она является одновременно растворителем и стабилизатором. Молекулы воды, гидратируя частицы дисперсной фазы, не позволяют им подходить друг к другу и слипаться, т.е. они препятствуют процессу коагуляции. В этом заключается стабилизирующая роль воды. Гидрофобные золи образуются такими веществами, которые являются труднорастворимыми в жидкости, например, труднорастворимыми гидроксидами, оксидами, солями, металлами, а также многими органическими веществами. Приготовление гидрофобных золей требует специальных методов получения. Эти методы подразделяются на физические и химические. И физические, и химические методы подразделяются: · на дисперсионные, т.е. методы, измельчающие частицы вещества; · конденсационные, т.е. укрупняющие частицы труднорастворимого вещества.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 535; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.211.87 (0.085 с.) |
 1 – находящуюся в глубине своей фазы;
1 – находящуюся в глубине своей фазы;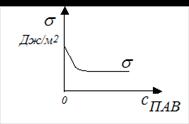 К поверхностно-активным относятся органические вещества следующих классов: спирты, альдегиды, карбоновые кислоты, нитро- и сульфопроизводные, амины, белки, мыла и моющие вещества, углеводородные радикалы которых (C2H5–; C17H35– и т.д) представляют собой неполярную гидрофобную часть поверхностно-активного вещества, которая может быть как угодно длинной. Функциональные группы: ОН–, –СООН и другие представляют полярную гидрофильную часть ПАВ. Примеры ПАВ: олеиновая кислота (С17H33COOH), твердое мыло (C17H35COONa). При адсорбции полярная часть молекулы ориентируется в сторону полярной фазы (обычно воды), неполярная часть (углеводородный радикал) выталкивается из полярной фазы, ориентируясь в направлении менее полярной фазы, например, воздуха, углеводородных или других органических жидкостей.
К поверхностно-активным относятся органические вещества следующих классов: спирты, альдегиды, карбоновые кислоты, нитро- и сульфопроизводные, амины, белки, мыла и моющие вещества, углеводородные радикалы которых (C2H5–; C17H35– и т.д) представляют собой неполярную гидрофобную часть поверхностно-активного вещества, которая может быть как угодно длинной. Функциональные группы: ОН–, –СООН и другие представляют полярную гидрофильную часть ПАВ. Примеры ПАВ: олеиновая кислота (С17H33COOH), твердое мыло (C17H35COONa). При адсорбции полярная часть молекулы ориентируется в сторону полярной фазы (обычно воды), неполярная часть (углеводородный радикал) выталкивается из полярной фазы, ориентируясь в направлении менее полярной фазы, например, воздуха, углеводородных или других органических жидкостей. ,
, – поверхностная активность вещества (межфазное натяжение).
– поверхностная активность вещества (межфазное натяжение).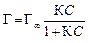 ,
,
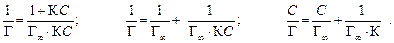
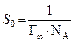 , где NA – число Авогадро.
, где NA – число Авогадро.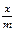
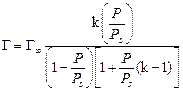 ,
, ,
,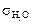 – при 20 °С = 72,56 × 103 Н/м.
– при 20 °С = 72,56 × 103 Н/м.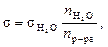
 – число капель воды; n р-ра – число капель раствора.
– число капель воды; n р-ра – число капель раствора. ,
,
 агрегат ПОИ ПИ ПИ
агрегат ПОИ ПИ ПИ где С 0 – концентрация (или активность) ионов на поверхности твердой фазы, моль/л; С р – концентрация (или активность) ионов в растворе, моль/л. По мере удаления от твердой фазы величина φ снижается и постепенно становится равной нулю.
где С 0 – концентрация (или активность) ионов на поверхности твердой фазы, моль/л; С р – концентрация (или активность) ионов в растворе, моль/л. По мере удаления от твердой фазы величина φ снижается и постепенно становится равной нулю.


