
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кристалізація бінарних сумішей
(СИСТЕМА NaNО3 – KNO3)
Завдання: 1. Одержати криві охолодження для чистих компонентів і сумішей відомого складу в координатах час — показання гальванометра. 2. Прокалібрувати термопару за чистими компонентами. 3. По калібрувальній кривій термопари визначити температури, що відповідають кристалізації кожного сплаву. 4. Побудувати діаграму стану системи і розібрати її за правилом фаз. Виконання роботи. Для дослідження можна використовувати метали і їхні сплави (Zn і Cd, Pb-Sn) чи суміші солей (NaNO3 -KNО3). Температуру вимірювати термопарою. Термопару необхідно проградуювати в умовах, близьких до умов досліду по температурах плавлення чистих речовин. Так, у системі KNО3—NaNО3 для калібрування термопари взяти чисті солі. Зібрати установку з пристрою, що нагріває, і термопари (холодні кінці якої опущені в лід, що тане), з'єднаної послідовно через магазин опору з гальванометром (мілівольтметром) (рис. 4.2). В одну пробірку насипають 10г ретельно розтертої і перемішаної евтектичної суміші KNО3 + NaNО3 (1:1), в іншу —10 г NaNО3, у третю — 10 г KNО3. Пробірку з евтектичною сумішшю закріпити в штативі й опустити в тигельну піч. Після розплавлення проби опустити термопару в пробірку. Термопара не повинна торкатися стінок і дна пробірки. Через кілька хвилин пробірку з розплавом швидко перенести в попередньо нагріту піщану баню чи в пробірку великого розміру (повітряну сорочку), затримуючи цим швидке охолодження, і закрити зверху азбестом. За допомогою секундоміру через 0,5 Такі ж досліди провести з чистими NaNО3 і КNО3. Температуру плавлення індивідуальних речовин визначати по горизонтальній ділянці на кривій охолодження. Побудувати калібрувальну криву в координатах показання гальванометра (вісь ординат) — температура (вісь абсцис) на міліметровому папері (1 мВ — 1см, 1°— 1 мм). Температури плавлення NaNО3 - 310°C; KNО3 - 337°C. Бажано, щоб стрілка гальванометра при температурі плавлення KNО3 показувала близько 80 поділок. Отримані точки з'єднати прямою, що служить для переводу показань приладу до дійсних значень температури
(рис. 4.3). Після визначення кривих охолодження чистих речовин і евтектичного складу аналогічно одержати криві охолодження сумішей, що містять 25 і 75% NaNО3 із загальною масою 10 г. Після повної кристалізації розчину зробити ще 3 Таблиця 4.3
По дослідним даним побудувати на міліметровому папері криві охолодження (1/2хв. - 1мм, 1 мВ - 1 см). На графік нанести всі точки, не з'єднуючи їх. Потім, прикладаючи лінійку, знайти характерні точки, чи згини горизонтальних ділянок. Криві охолодження не повинні перетинатися один з одним. По калібрувальній кривій для термопари інтерполяцією знайти дійсну температуру для точок згину. Дані занести в табл. 4.4. По дослідним даним побудувати діаграму стану температура-склад.
Таблиця 4.4
Контрольні питання 1. Сформулюйте правило фаз Гіббса. 2. Що таке фаза, компонент, ступінь свободи? 3. Вкажіть число фаз і число ступенів свободи для зазначеної фігуративної точки на діаграмі. 4. Як зображується графічно рівновага одноваріантних, двоваріантних і безваріантних систем? 5. У чому полягає фізико-хімічний метод аналізу? 6. На чому заснований термічний аналіз? Чи можна передбачати характер кривої охолодження? 7. Побудуйте криву охолодження для сплаву зазначеного складу. 8. Для заданого сплаву побудуйте шлях кристалізації, вкажіть температуру початку і кінця кристалізації. 9. Для сплаву зазначеної суміші визначте склад і масове співвідношення твердої і рідкої фаз при заданій температурі.
10. Сплави яких сполук будуть мати постійну температуру плавлення? 11. Що таке правило важеля? 12. Що таке евтектика? 13. Від чого залежить тривалість евтектичної зупинки? Розділ V РОЗЧИНИ
Закон розподілу. Система з двох практично незмішуючихся рідин і третього, розчинного в них компонента, буде біваріантною (С=3–2+1=2) при рівновазі між обома конденсованими фазами. Концентрація третього компонента в одній з фаз однозначно визначається концентрацією цього компонента в іншій фазі при даній температурі. Відповідно до закону розподілу Нернста, в ідеальній рівноважній системі відношення рівноважних концентрацій розчиненої речовини в двох рідинах, що незмішуються, є величина стала при даній температурі і називається коефіцієнтом розподілу К:
де С1 і С2 – рівноважні концентрації розчиненої речовини в обох фазах. При великій концентрації третього компонента у формулу Нернста (5.1) замість концентрацій вводять активності. Для малорозчинних речовин можна замість концентрацій використовувати розчинності і тоді рівняння (5.1) матиме вигляд:
де L1 і L2 — розчинність компонентів в тому чи іншому розчиннику. Коефіцієнт розподілу К не залежить від концентрації розчинів, якщо компонент в обох розчинниках знаходиться у вигляді однакових частинок і розчинена речовина не змінює розчинність рідин одна в одній. Якщо в одній з фаз розчинена речовина дисоціює, а в іншій асоціює, то коефіцієнт розподілу змінюється з концентрацією, при цьому рівняння (5.1) матиме вигляд:
де a — ступінь дисоціації у фазі 1; n — число молекул в асоційованому комплексі у фазі 2. Рівняння (5.3) є загальним аналітичним вираженням закону розподілу Нернста-Шилова. Якщо речовина не дисоціює і не асоціює, рівняння (5.3) переходить у рівняння (5.1). Якщо речовина асоціює тільки в другій фазі, то рівняння (5.3) перетвориться в:
де п — відношення середніх молекулярних мас у першому і в другому розчинниках: п = М1 /М2. Логарифмуючи рівняння (4.4), одержимо:
Якщо на осі ординат відкладати lgC1, а на осі абсцис — lgC2 то одержимо пряму, тангенс кута нахилу якої дорівнює n, а відрізок, що відтинається прямою на осі ординат - lgK. Рівняння (5.5) дозволяє, таким чином, графічно визначати n і К з експериментальних даних розподілу речовини між двома розчинниками при різних концентраціях його. Коефіцієнт розподілу використовується для експериментального визначення ступеня асоціації чи дисоціації розчиненої речовини в тому чи іншому розчиннику, активності розчинених речовин і інших подібних величин. Екстрагування. Закон розподілу широко використовується в процесах екстрагування — видалення речовини з розчину іншим розчинником, що не змішується з першим. Закон розподілу дозволяє розраховувати кількість видаленої речовини, що залишилася в розчині, після одно- і багаторазового видалення розчинником заданого об'єму при даній температурі:
де m1 - маса речовини, що залишились у розчиннику 1 після одноразового витягу його розчинником 2; V1 і V2 - об'єм розчинників 1 і 2; m0 - вихідна кількість речовини в розчиннику 1.
При багаторазовому витягу рівняння (5.6) має вигляд:
де n - число витягів.
З формули (5.7) видно, що екстрагувати краще послідовно невеликими порціями, чим однократно великим об’ємом розчинника. При екстракції коефіцієнтом розподілу умовно називають відношення концентрації розчину, з якого екстрагується розчинена речовина, до концентрації розчину, яким екстрагують. Присутність інших розчинених речовин часто впливає на процес екстрагування. При цьому можуть змінюватися властивості розчинника чи властивості розчиненої речовини. Так, розчинність органічних речовин у воді знижується при насиченні води неорганічною сіллю, що не розчиняється в органічному розчиннику («висолювання»). Розчинність слабких органічних кислот у воді знижують, додаючи мінеральні кислоти, що зменшують ступінь дисоціації слабких кислот.
Лабораторна робота №8 РОЗПОДІЛ РЕЧОВИНИ МІЖ ДВОМА РІДКИМИ ФАЗАМИ
Мета роботи: Визначення коефіцієнта розподілу бензойної кислоти між органічним розчинником і водою, а також константи асоціації бензойної кислоти в органічному розчиннику.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 223; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.86.134 (0.013 с.) |
 1хв. записати температуру сплаву, що охолоджується. Одному з працюючих стежити за показаннями гальванометра, іншому відраховувати час і вести запис. Після кристалізації розплаву (температурна зупинка) зробити ще 5
1хв. записати температуру сплаву, що охолоджується. Одному з працюючих стежити за показаннями гальванометра, іншому відраховувати час і вести запис. Після кристалізації розплаву (температурна зупинка) зробити ще 5 


 , чи
, чи 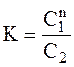
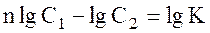 , чи
, чи 





