
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: решение экспериментальных задач по распознаванию неорганических веществ
Цель: формирование знаний учащихся по распознаванию неорганических веществ с помощью качественных реакций, закрепление умений по составлению уравнений реакций на свойства и получение веществ, решению экспериментальных задач. Время выполнения: 2 часа Теоретический материал Практически каждое неорганическое вещество можно определить с помощью характерных реакций. Эти реакции называются качественные. Принадлежность неорганического вещества к определенным классам соединений, их строение, степень чистоты устанавливаются с помощью элементного и функционального анализа. Качественный элементный анализ позволяет определить качественный состав молекул неорганического соединения; количественный элементный анализ устанавливает элементный состав соединения и простейшую формулу. Структура неорганического соединения может считаться окончательно доказанной, если осуществлен встречный синтез; проведен систематический химический анализ, включающий в себя: предварительные испытания, качественные реакции на функциональные и нефункциональные группы, получены различные производные; проведены спектральные методы анализа. Функциональный анализ и идентификация неорганических веществ начинаются с предварительных испытаний, включающих в себя: определение физических констант, пробу на сожжение, растворимость в воде и органических растворителях, качественный анализ. Принадлежность к классам неорганических веществ можно установить по их отношению к реагентам Опыт №1. Взаимодействие щелочных металлов с водой. Налить в фарфоровую чашку немного воды, опустить в нее кусочек натрия и быстро накрыть чашку воронкой. После окончания реакции прилить к полученному раствору 2-3 капли фенолфталеина. Составить уравнения протекающих реакций и сделать вывод относительно свойств щелочных металлов.
Опыт №2. Действие воды на металлический магний. Поместить в пробирку стружку металлического магния. Добавить немного воды и 2-3 капли фенолфталеина. Обратить внимание на то, что цвет практически не изменится. Затем следует нагреть пробирку. Отметить изменение окраски раствора. Сделать вывод относительно щелочных свойств магния и написать уравнения протекающих реакций.
Опыт №3. Амфотерность металлического алюминия. Поместить кусочек металлического алюминия в пробирку, прилить немного воды и 2-3 капли фенолфталеина. Убедиться в том, что ни в обычных условиях, ни при нагревании алюминий с водой не взаимодействует. Затем поместить в две другие пробирки по кусочку алюминия. В одну из них прилить разбавленную соляную кислоту, в другую – раствор крепкой щелочи NaOH. Пробирки нагреть. При этом наблюдается взаимодействие алюминия, как с кислотой, так и со щелочью. Написать уравнения протекающих реакций и сделать вывод о свойствах алюминия. Опыт №4. Неметаллические свойства серы. Кусочек серы поместить в пробирку и налить немного воды. Прибавить сначала 2-3 капли фенолфталеина, а затем столько же метилоранжа. Отметить, что сера не взаимодействует с водой в обычных условиях. Нагреть пробирку. Отметить что после нагревания взаимодействие серы с водой не происходит. Кусочек серы положить на железную ложечку, поджечь и опустить в коническую колбу, в которой было налито немного воды (не касаясь поверхности воды). После сгорания серы закрыть колбу пробкой и встряхнуть. Полученный раствор разделить на 3 пробирки и испытать различными индикаторами.
Опыт №5. Амфотерные свойства гидроксида олова (II). Поместить в пробирку 8-10 капель раствора Экспериментальная часть 1 этап. Проведите анализ состава каждого вещества Оборудование и реактивы.
фенолфталеин, гидроксид натрия, синяя лакмусовая бумажка, нитрат серебра, хлорид бария, пробирки. 2 этап. Выберите пути распознавания веществ. При помощи, каких реактивов вы будете определять эти вещества.
3 этап. Определите последовательность ваших действий. 4 этап. Правила ТБ. 5 этап. Выполнение экспериментальной части. Результаты работы внесите в таблицу 3. Таблица 3 – Результаты работы
6 этап. Сделайте вывод, используя ПОПС – формулу. «Я считаю, что…….» «Потому, что………» «Например…………» «Следовательно…….»
Контрольные вопросы: 1. Что такое индикатор? 2. Что называется идентификацией? 3. Какие существуют классы неорганических соединений? 4. Какие виды анализа веществ существуют?
Рекомендуемая литература: 1.1 – 1.5, 2.1 -2.9
Лабораторное занятие №3
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 433; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.131.72 (0.007 с.) |
 , добавить несколько капель
, добавить несколько капель 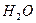 и раствор
и раствор  в воде, до полного осаждения осадка. Распределить содержимое на две пробирки и добиться растворения осадка в каждой из них с помощью: в одном случае 2М раствора HCl, в другом – 2М раствора NaOH. Составить уравнения реакций, зная, что при реакции гидроксида олова с NaOH образуется тетрагидроксостаннат натрия
в воде, до полного осаждения осадка. Распределить содержимое на две пробирки и добиться растворения осадка в каждой из них с помощью: в одном случае 2М раствора HCl, в другом – 2М раствора NaOH. Составить уравнения реакций, зная, что при реакции гидроксида олова с NaOH образуется тетрагидроксостаннат натрия 



