
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вывод химических формул. Расчеты по химическим уравнениям
Формулы веществ показывают, какие элементы и в каком количестве входят в состав вещества. Различают формулы простейшие и молекулярные. Простейшая формула выражает наиболее простой возможный атомный состав молекул вещества, соответствующий отношениям масс между элементами, образующими данное вещество. Молекулярная формула показывает действительное число атомов каждого элемента в молекуле.(для веществ молекулярного строения). Для вывода простейшей формулы вещества достаточно знать его состав и атомные массы образующих данное вещество элементов. ПРИМЕР 1. Найти простейшую формулу оксида хрома, содержащего 68,4 % (массовых) хрома. Решение. Обозначим числа атомов хрома и кислорода в простейшей формуле оксида соответственно через Х и У. Атомные массы хрома и кислорода равны 52 и 16. Поэтому массы хрома и кислорода в составе оксида относятся как 52Х: 16У. По условиям задачи это отношение равно 68,4: 31,6. Следовательно, 52Х: 16 У = 68,4: 31,6, откуда Х: У = 68,4/ 52: 1,98 / 16 = 1,32: 1,98. Чтобы выразить полученное отношение целыми числами, разделим оба его члена на меньший из них Х: У = 1,32 / 1,32: 1,98 / 1,32 = 1: 1,5; а затем умножая оба члена последнего на 2, получим: Х: У = 2: 3. Таким образом, простейшая формула оксида хрома Cr Для нахождения молекулярной формулы вещества необходимо кроме состава вещества знать его молекулярную массу. ПРИМЕР 2. Газообразное соединение азота с водородом содержит 12,5 % (масс.) водорода. Плотность соединения по водороду равна 16. Найти молекулярную формулу соединения. Решение. Находим отношение числа атомов азота Х к числу атомов водорода У в молекуле соединения: Х: У = 87,5 / 14: 12,5 / 1 = 6,25: 12,5 = 1: 2. Простейшая формула соединения NH М = 2 × 16 = 32. Таким образом, истинная молекулярная масса вещества вдвое больше вычисленной по его простейшей формуле. Следовательно, молекулярная формула соединения N В уравнении химической реакции каждая формула изображает один моль соответствующего вещества. Поэтому, зная мольные массы участвующих в реакции веществ, можно по уравнению реакции найти соотношение между массами веществ, вступающих в реакцию и образующихся в результате ее протекания. Если в реакции участвуют вещества в газообразном состоянии, то уравнение реакции позволяет найти их объемные отношения.
ПРИМЕР 3. Хлор может быть получен действие серной кислоты на смесь диоксида марганца с хлористым натрием. Реакция протекает по уравнению: 2 NaCl + MnO Какой объем хлора (условия нормальные) можно получить на 100 г хлорида натрия? Решение. Согласно уравнению реакции, из 2 молей NaCl получается 1 моль хлора. Рассчитав массу 2 молей NaCl (117), составим пропорцию: 117 г NaCl дают 22,4 л Сl Cледовательно: Х = 22,4 × 100 / 117 = 19,15 л ЗАДАЧИ 10-12 10. Найти простейшую формулу вещества, содержащего (по массе) 43,4% натрия, 11,3% углерода и 45,3% кислорода. 11. Найти молекулярную формулу вещества, содержащего (по массе) 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41. 12. К раствору, содержащему 6,8 г AlCl
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 230; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.224.197 (0.006 с.) |
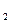 O
O  .
.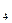 .
.



