
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 5. Приготовление раствора заданной молярной и нормальной концентрации из раствора с известной процентной концентрацией
Требуется приготовить 100 мл 0,1 М (0,1 н) раствора серной кислоты из ее 10%-го раствора. 1. Рассчитайте, пользуясь формулами из таблицы 1, какой объем кислоты необходимо взять для приготовления раствора серной кислоты указанной концентрации. 2. Отмерьте рассчитанный объем мерным цилиндром емкостью 10 или 25 мл. 3. В мерную колбу емкостью 100 мл примерно на ¾ ее объема налейте дистиллированную воду. Перемешивая жидкость круговыми движениями колбы, понемногу через воронку перелейте в нее всю кислоту из мерного цилиндра. 4. Сполосните воронку водой, выньте ее и дождитесь охлаждения колбы до комнатной температуры. 5. Добавляя дистиллированную воду, доведите уровень жидкости в колбе до метки. Последние порции воды добавляйте по каплям пипеткой. 6. Плотно закрыв колбу пробкой, перемешайте раствор, переворачивая несколько раз колбу вверх дном. Приготовленный 0,1 н раствор серной кислоты используйте в опыте 6.
Опыт 6. Определение концентрации серной кислоты методом Определение концентрации серной кислоты методом титрования осуществляется стандартным (титрованным) раствором щелочи (NaOH). Титриметрической реакцией является реакция нейтрализации раствора кислоты раствором щелочи. Конечную точку титрования устанавливают по изменению окраски кислотно-основного индикатора (фенолфталеина или метилового оранжевого). 1. Приготовьте 100 мл раствора серной кислоты заданной преподавателем концентрации (0,002 н.; 0,003н.; 0,004н.; 0,005н.) из исходного 0,1 н. раствора H2SO4. Для этого: 1.1 Рассчитайте объем (мл) исходного 0,1н раствора серной кислоты, необходимый для приготовления 100 мл раствора H2SO4 заданной преподавателем концентрации. Пример: Какой объем 0,1 н. раствора серной кислоты необходимо отмерить для приготовления 100 мл 0,003 н. раствора? Решение. Т.к. количество молей эквивалентов H2SO4 в исходном и приготовленном растворах одинаково, то, в соответствии с законом эквивалентов (формула (8)), объем исходного раствора
1.2 Перенесите рассчитанный объем 0,1н раствора серной кислоты в мерную колбу объемом 100 мл. Приливая дистиллированную воду, доведите объем раствора в колбе до 100 мл. 2. Определите объем титранта (0,1н раствора NaOH), израсходованного на титрование полученного в п.1 раствора H2SO4. Для этого:
2.1 Добавьте в колбу с приготовленным раствором серной кислоты 2-3 капли индикатора фенолфталеина. Отметьте окраску раствора. 2.2 Заполните бюретку 0,1н. раствора NaOH и доведите уровень жидкости в бюретке до нулевой отметки (при определении уровня жидкости в бюретке глаз наблюдателя и нижний край мениска жидкости должны находиться на одной горизонтальной плоскости). 2.3 Проведите титрование раствора кислоты, добавляя небольшими порциями раствор щелочи в колбу с кислотой. Раствор кислоты при этом непрерывно перемешивайте, держа горло колбы правой рукой. Кран (или зажим) бюретки открывайте левой рукой. 2.4 Конец титрования определите по появлению едва заметной, не исчезающей в течение 30 с, малиновой окраски фенолфталеина. (Окраску раствора удобнее наблюдать на белом фоне, поэтому подложите под колбу листок белой бумаги). Отметьте и запишите объем титранта (NaOH) в бюретке, пошедший на титрование V щ. 2.5 Добавьте еще одну каплю раствора щелочи. Если окраска раствора стала более заметной, значит, конечная точка титрования определена правильно. 3. Рассчитайте молярную концентрацию эквивалента приготовленного раствора кислоты
где V к – объем раствора серной кислоты, V к = 100 мл, 4. Сравните заданное значение концентрации раствора кислоты
5. Повторите действия п.п. 2 – 4, заменив фенолфталеин другим индикатором – метиловым оранжевым. Конец титрования определите по соответствующему изменению окраски индикатора (см. табл.2). 6. Напишите уравнение титриметрической реакции в молекулярной форме. Результаты измерений и расчетов занесите в таблицу 3.
Таблица 3 – Результаты измерений и расчетов
7. Объясните, чем вызваны расхождения в величинах концентрации одного и того же раствора, оттитрованного в присутствии разных индикаторов. При каких значениях рН раствора происходит изменение окраски использованных индикаторов? Какова относительная систематическая погрешность h с титрования заданного раствора в каждом случае? Контрольные вопросы и задания 1. Что представляют собой растворы? Что такое растворитель? Растворенное вещество? Приведите примеры растворов различного агрегатного состояния. 2. Дайте определение понятия «растворимость». 3. Что называется концентрацией раствора? Перечислите основные способы выражения концентрации растворенного вещества в растворе. 4. Как определяется молярная концентрация? Дайте понятие и приведите математическую формулу для расчета молярной концентрации. 5. Как определяется процентная концентрация? Дайте понятие и приведите математическую формулу для расчета процентной концентрации. 6. Как определяется нормальная концентрация? Дайте понятие и приведите математическую формулу для расчета нормальной концентрации. 7. Что такое титриметрия? В чем заключается принцип титрования? Напишите выражение основной расчетной формулы определения концентрации методом титрования. 8. Дайте понятие водородного показателя рН. 9. Какие соединения называют индикаторами? На каком свойстве индикаторов основано их применение? 10. Что такое показатель титрования рТ? Каково его значение для индикаторов метилового оранжевого и фенолфталеина? Лабораторная работа № 2
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 234; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.214.215 (0.006 с.) |
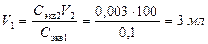 .
.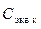 по формуле
по формуле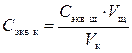 , (11)
, (11)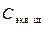 – концентрация титранта (щелочи);
– концентрация титранта (щелочи); 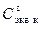 и определенное методом титрования значение концентрации приготовленного раствора
и определенное методом титрования значение концентрации приготовленного раствора 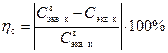 . (12)
. (12)


