
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Эквивалент и молярная масса эквивалента
Цель работы: ознакомление с понятием эквивалента вещества и методикой расчета, связанной с законом эквивалентов.
Эквивалент – это реальная или условная частица вещества, которая соответствует одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Эквивалент – величина безразмерная, эквиваленты элементов и их соединений могу; быть переменными величинами и поэтому для правильного определения эквивалента надо исходить из конкретной реакции, в которой участвует данное вещество. Например, при диссоциации уксусной кислоты: СН3СООН Û СНзСОО-+ Н+ один ион водорода образуется из одной молекулы уксусной кислоты. Следовательно, эквивалентом кислоты является молекула этой кислоты, что записывается следующим образом: Э(СН 3 СООН) = СН3СООН Для ионообменной реакции 2КОН + Н2SО4 = К2SO4 + 2Н2O одному иону водорода соответствует один моль КОН и один моль H2O. Следовательно, Э(КОН) = КОН и Э(Н2О) = Н2О. В окислительно – восстановительной реакции Fe3+ + 3e=Fe° один ион Fe3+ реагирует с тремя электронами и поэтому Э( В реакции Fe3+ + е = Fe2+ Э( Таким образом, зная суммарное уравнение кислотно-основной, ионообменной или окислительно-восстановительной реакции, можно установить химическую формулу эквивалента вещества, участвующего в реакции. Количество вещества измеряют в молях. Моль - количество вещества, содержащего 6,02 ·1023 структурных элементов: атомов, молекул, ионов, эквивалентов. Таким образом, моль эквивалентов – количество вещества, содержащего 6,02·1023 эквивалентов. Масса моля эквивалентов называется молярной массой эквивалента Мэ, г/моль. Молярные массы эквивалентов рассчитываются по формулам: 1) для простого вещества 2) для сложного вещества где М – молярная масса данного вещества; В – валентность функциональной группы; n – число функциональных групп в молекуле. Для кислот функциональной группой является ион водорода, для гидроксидов – ион гидроксила, для солей – ион металла. Например:
3) для расчета величины моля эквивалента вещества в окислительно – восстановительных реакциях применяют формулу расчета 1), но где В – это число электронов, участвующих в реакции.
Например, для реакции Fe3+ + 3e=Fe°
Для газообразных веществ пользуются величинами объема моля эквивалента. Например, в реакции окисления водорода Н2 – 2е = 2Н+ Эквивалент газообразного водорода - это половина его молекулы
поэтому один моль эквивалентов водорода занимает при нормальных условиях объем 22,4: 2= 11,2 л. Аналогично рассчитывается О2 + 4е = 20 -, т.е Раствор, содержащий один моль эквивалентов вещества в 1 дм3, называется нормальным и обозначается 1 N или 1 н. Закон эквивалентов: все вещества реагируют, друг с другом в эквивалентных количествах. Массы веществ, участвующих в реакциях пропорциональны молярным массам их эквивалентов:
т.е. количества молей эквивалентов участвующих в реакции веществ равны между собой. Закон эквивалентов для реакции мА + пВ = АмВм, протекающей в растворе, можно записать следующим образом: VANA = VBNB,, где: VA и vВ – объемы реагирующих растворов; nА и nВ – нормальные концентрации этих растворов.
Метод основан на измерении объема водорода, который, выделяется из кислоты при действии на нее металла. Применяемый для этой цели прибор состоит из двух бюреток, укрепленных на штативе и соединенных резиновой трубкой. В такой сообщающийся сосуд наливают воду приблизительно до половины бюреток. Одну из бюреток сверху закрывают пробкой с отводной трубкой, к которой присоединяют пробирку, где происходит реакция между кислотой и металлом. Другая бюретка служит приемником для воды, вытесняемой выделяющимся при реакции водородом. Выполнение опыта
1.Проверьте герметичность прибора. Для этого закройте пустую пробирку пробкой с отводной трубкой от бюретки. Не трогая бюретку с пробиркой, переместите другую бюретку так, чтобы уровень воды в ней стал на 5-10 см выше, чем в первой бюретке. Если разница в уровнях не изменяется, прибор исправен, "держит"; если уровни в бюретках выравниваются, прибор негерметичен, пропускает воздух, о чем следует заявить преподавателю.
2.Получите навеску металла у преподавателя и запишите ее массу в г. В пробирку налейте соляной кислоты 3:1 (на одну пятую пробирки). Протрите внутренние стенки пробирки фильтровальной бумагой. Поддерживая пробирку в наклонном положении, поместите навеску металла (не опуская в кислоту) на стенку у отверстия пробирки и закройте пробирку пробкой с отводной трубкой от бюретки. 3.Приведите воду в бюретках к одному уровню и отметьте уровень воды в открытой бюретке до реакции V1. Наблюдение производить по нижнему мениску жидкости с точностью до 0,1. 4.Стряхните металл в кислоту (смойте его кислотой). Наблюдайте выделение водорода и вытеснение воды из бюретки. 5.По окончании реакции дайте пробирке охладиться на воздухе, после чего снова приведите воду в бюретках к одному уровню. Запишите новый уровень воды в бюретке V2.
Запишите в журнал: 1.навеску металла, г 2…...уровень воды в бюретке до реакции, мл 3.yровень воды в бюретке после реакции, мл 4.температура, К 5.атмосферное давление, кПа (мм рт. ст.) 6.давление насыщенного водяного пара, кПа (мм рт. ст.) 7.давление водорода, кПа (мм рт. ст.)
По полученным данным рассчитайте:
1.объем выделившегося водорода по разности уровней воды до и после реакции. Объем выделившегося водорода определяют по разности уровней воды в любой из бюреток до и после опыта при давлении в закрытой бюретке, равном атмосферному. Давление газа в закрытой бюретке равно атмосферному, если вода в обеих бюретках находится на одном уровне. Даже при комнатной температуре пар над поверхностью воды обладает заметным давлением. Это следует учитывать при вычислении объема газа, собранного над водой. 2. Парциальное давление водорода. Для определения парциального давления водорода необходимо от общего (атмосферного) давления, под которым находится водород, вычесть давление насыщенного водяного пара h.): РН = Ратм - h Таблица. Давление насыщенного пара.
3.Объем водорода при нормальных условиях, используя уравнение газового состояния
где: vо – объем выделившегося водорода при н.у., мл; Р0 – парциальное давление водорода при н.у., равное 101,3 кПа (760 мм рт. ст.); Т0 - температура, 273 K; V – объем выделившегося водорода при условиях опыта, мл; Р – парциальное давление водорода при данных условиях, Па (мм рт. ст.); Т – температура опыта, К. 4.Теоретическую молярную массу эквивалента Mg, Al, Zn; 5.Опытную молярную массу эквивалента данного Вам металла, используя закон эквивалентов; m г металла вытесняют - V0 мл водорода х г металла вытесняют - 11200 мл водорода
Сравните полученную в п.5 молярную массу эквивалента Вашего металла с молярной массой эквивалента предполагаемых металлов (Mg, Al, Zn). Для какого металла ближе Ваше значение? Определите, какой металл был взят для реакции. Результаты проверить у преподавателя.
6.Ошибки опыта: а) абсолютную Dе=Мэ(теор) - МЭ(опытн) б) относительную
Запишите уравнение реакции взаимодействия Вашего металла с соляной кислотой.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 752; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.235.104 (0.018 с.) |
 ) = l/3Fe3+
) = l/3Fe3+
 ) = Fe3+
) = Fe3+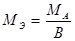 ;
; ,
, г/моль;
г/моль;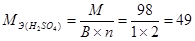 г/моль;
г/моль; г/моль;
г/моль; г/моль
г/моль г/моль
г/моль ,
,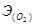
 и как следствие,
и как следствие,  ,
, ,
, , %
, %


