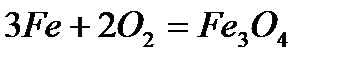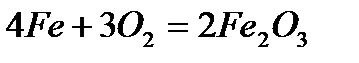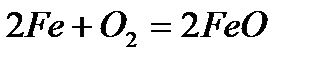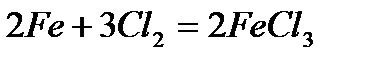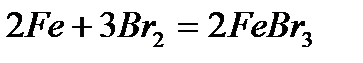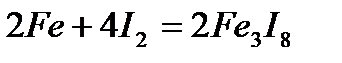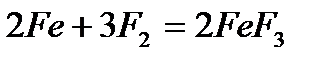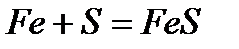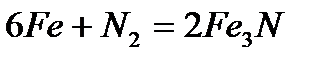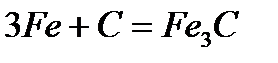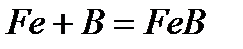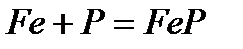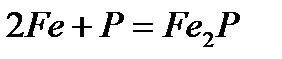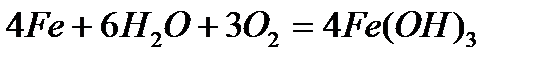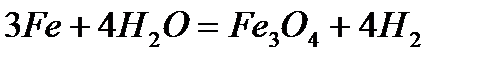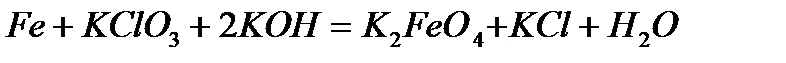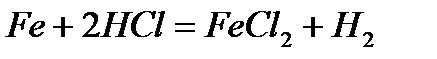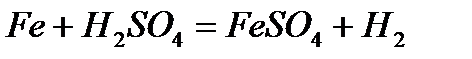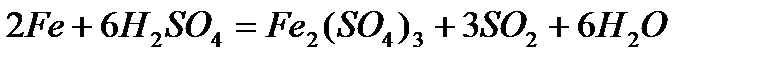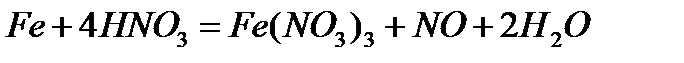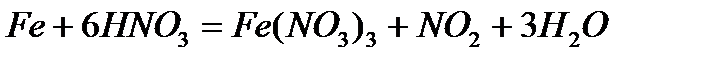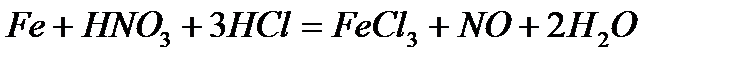Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Название материала, химический символСтр 1 из 2Следующая ⇒
Контрольная работа №1 Вариант 5. Железо Название материала, химический символ Железо, Fe Проводник, полупроводник, диэлектрик Проводник Строение атома (молекулы), тип структуры Порядковый номер = 26. Заряд ядра = количество протонов = количество электронов = 26. Число нейтронов = относительная атомная масса – порядковый номер = 56 – 26 = 30. Электронная формула: 1s22s22p63s23p64s23d6 Тип решетки - кубическая объёмноцентрированная. Относительная атомная (молекулярная) масса 55,847 а. е. м. (г/моль) Способы получения Железо, как и большинство металлов, редко встречается в природе в чистом виде, часто оно встречается в составе железо-никелевых метеоритов. Чистое железо в небольшом количестве получают восстановлением чистого оксида или гидроксида водородом или с помощью карбонильного процесса, который заключается в нагреве железа с монооксидом углерода под давлением. 1). Восстановление оксида водородом (при нагревании).
Железо получают в твердом виде, и в дальнейшем переплавляют в электрических печах. При этом процессе не происходит загрязнения железа примесями, которые встречаются в каменном угле. 2). Карбонильный процесс.
При карбонильном процессе железо получают в порошкообразном виде. Но наиболее широко железо применяется не в чистом виде, а в виде различных сталей. Первый этап превращения железной руды в сталь проводят в доменных печах, в которых железная руды восстанавливается коксом, а известь в это время удаляет песок и глину в шлаки (CaSiO3).
Физические свойства Железо – серебристо-белый металл с сероватым оттенком. В чистом состоянии пластичен; примеси повышают его твердость и, в тоже время, хрупкость. Железо обладает ярко выраженными магнитными свойствами. Температура плавления железа составляет 1538.85 °C, температура кипения — 2860.85 °C. Плотность его – 7.874 г/см3 (при 20 °C), удельное электросопротивление при 20 °C составляет 9.71 мкОм·см, а удельная теплопроводность – 92 Вт/м·К. 7. Химические свойства: · взаимодействие с кислородом - сгорание на воздухе
- сгорание в чистом кислороде
- пропускание кислорода или воздуха через расплавленное железо · взаимодействие с водородом С водородом железо не образует стехиометрических соединений, но поглощает его в значительных количествах. Гидриды железа существуют только при высоких давлениях водорода. · взаимодействие с галогенами при нагревании - горение в хлоре
- взаимодействие с бромом (при повышенном давлении его паров)
- с йодом
- со фтором
· взаимодействие с простыми веществами - взаимодействие с серой при нагревании
- взаимодействие с азотом при нагревании
- с углеродом
- взаимодействие с бором, спекание стехиометрических количеств чистых веществ при 1600 °C
- взаимодействие с фосфором при нагревании
· взаимодействие с водой - в воде в присутствии кислорода
- при 700-900 °C раскаленное железо реагирует с водяным паром
· взаимодействие со щелочами Железо не реагирует с разбавленными растворами щелочей. Возможно только взаимодействие железа с щелочными расплавами сильных окислителей
· взаимодействие с кислотами (концентрированная и разбавленная серная кислота, концентрированная и разбавленная азотная кислота, соляная кислота, «царская водка») - с соляной кислотой
- с разбавленной серной кислотой
- с концентрированной серной кислотой происходит пассивация (реакция происходит при нагревании)
- с разбавленной азотной кислотой
- с концентрированной азотной кислотой железо тоже происходит пассивация, при нагревании возможно взаимодействие.
- с «царской водкой»
8. Склонность к сплавообразованию. Железо образует множество сплавов. Различают сплавы железа с углеродом (легированные и нелегированные чугуны и стали), сплавы с особыми физико-химическими свойствами и ферросплавы. Чугуны обычно содержат более 2 % углерода, что обусловлено химическими процессами, происходящими в доменной печи. По назначению чугуны разделяют на предельные и литейные. Чугуны, содержащие более 4 % углерода, называют предельными, их переплавляют на сталь в конвертерах или печах. Литейные чугуны содержат 2.4 – 3.8 % углерода, их используют для изготовления чугунного литья. Стали содержат менее 1.5-2% углерода. Основные способы производства – кислородно-конвертный, мартеновский и электросталеплавильный. Различают стали общего назначения, автоматные, конструкционные (углеродистые и легированные), инструментальные (углеродистые и легированные), быстрорежущие и др. Сплавы с особыми физико-химическими свойствами. К ним относят сплавы с высоким содержанием различных элементов (до 50%) и некоторые виды стали. Среди них: инвар, ковар, платинит, элинвар и др. Ферросплавы. Для производства ферросплавов обычно используют руды необходимых элементов, содержащие железо. Способы выплавки ферросплавов - электротермический, металлотермический и доменный. Наиболее распространены ферросилиций, феррохром и ферромарганец. Стойкость к коррозии. В чистом виде железо обладает слабой коррозионной стойкостью. Однако при легировании его хромом возможно сильно повысить коррозионную стойкость, а добавки никеля позволяют повысить коррозионную стойкость железа и стали в щелочных растворах. Антимонид галлия Способы получения Получают GaSb сплавлением Ga с 5%-ным избытком Sb в атмосфере Н2, в кварцевых или графитовых контейнерах, после чего GaSb гомогенизируют зонной плавкой. Физические свойства Антимонид галлия – светло-серые кристаллы с металлическим блеском. Подвижность электронов составляет 4000 см²/(В·с), подвижность дырок – 800 см²/(В·с). Эффективная масса электронов проводимости: me = 0,45m0 (где m0 — масса свободного электрона). Плотность в твердом состоянии =5,66 г/см3, в жидком состоянии (при температуре плавления) — 6,06 г/см3; температура плавления tпл= 712 оС; равновесное давление паров в точке плавления — 10-2 Па. Коэффициент линейного расширения — 6,710-6К-1, твердость по минералогической шкале = 4,5, диэлектрическая проницаемость (низкочастотная) = 15,69. 7. Химические свойства: Антимонид галлия не растворяется в воде, слабо растворяется в концентрированной соляной кислоте и концентрированных растворах щелочей, но в царской водке скорость растворения значительно увеличивается. При растворении в кислотах выделяется токсичный стибин SbH3. Окисление антимонида галлия на воздухе начинается при температуре выше 400 оС. При окислении поверхность антимонида галлия адсорбирует значительно большее число атомов кислорода, чем другие соединения AIIIBV (за исключением антимонида алюминия). Диссоциация соединения с выделением паров сурьмы начинается после расплавления соединения в вакууме.
8. Склонность к сплавообразованию Сплав сурьмы с галлием легируют теллуром, марганцем и др. Стойкость к коррозии Так как GaSb не растворяется в воде и окисление происходит только при температуре 400 оС, это может говорить о его хороших коррозионных свойствах. Гетинакс Способы получения Гетинакс получают на основе целлюлозной бумаги. Эта технология включает: пропитку раствором смолы, дальнейшую сушку листов, их резку, сбор в пакеты и прессование под давлением 10-15 МПа при температуре 150-160 °С. После чего сформованный материал охлаждают под давлением. Детали из гетинакса изготавливают главным образом механическими способами: штампование или фрезерование. Для изготовления гетинакса используют модифицированные фенольные, анилиноформальдегидные и карбамидные смолы. Физические свойства Гетинакс – слоистый пластик. Обладает высокими электроизолирующими свойствами и высокой механической прочностью. Его плотность – 1.2 – 1.4 г/см3, удельное поверхностное сопротивление – 1010-1012 Ом, теплостойкость по Мартенсу 150-160 °С, прочность при растяжении 70-100 Мн/м2 (700-1000 кгс/см2 ), прочность при статическим изгибе (по основе) 80-140 Мн/м2 (800-1400 кгс/см2), удельная ударная вязкость 1.3-1.5 кдж/м2 (13-15 кгс (см/см2). Обладает высокими диэлектрическими свойствами, в нагретом состоянии легко поддается механической обработке (сверление, фрезерование, распиловка, штамповка). Электроизоляционные свойства материала сильно зависят от влажности и температуры окружающей среды. Во избежание значительного снижения электрического сопротивления гетинакса в условиях влажной атмосферы детали из него после механической обработки лакируются, за исключением влагостойкой марки ЛГ. Производится несколько марок гетинакса, которые различаются между собой составом и назначением. Гетинакс марки I – изготавливается основе фенолформальдегидной смолы и электроизоляционной пропиточной бумаги. Его толщина – 0.4 – 50 мм. Гетинакс этой марки обладает высокими механическими свойствами и поэтому хорошо поддается механической обработке. Отличается низким водопоглощением и сохранением электроизоляционных свойств при изменении влажности. Такой гетинакс рекомендуется применять в низковольтной технике до 1000 В и частотой тока 50 Гц. Предназначен для работы на воздухе в условиях нормальной относительной влажности окружающей среды (45 - 75 %) при температуре 15 - 35 °С и в трансформаторном масле.
Гетинакс марки V – на основе совмещенных эпоксидной и фенолформальдегидной смол (эпоксифенольное связующее) и электроизоляционной пропиточной бумаги. Толщина – 1.0-50 мм. Имеет высокие механические свойства и электроизоляционные показатели: повышенную электрическую прочность вдоль слоев и низкое значение тангенса угла диэлектрических потерь. Как электроизоляционный материал применяется в условиях нормальной относительной влажности воздуха и в трансформаторном масле при напряжении свыше 1000 В и частоте тока до 106 Гц. Гетинакс марки ЛГ лавсановый электротехнический представляет собой слоистый прессованный материал, состоящий из нескольких слоев полиэфирной бумаги (лавсановой), пропитанной термореактивным связующим. Изготавляется толщиной от 0,5 до 50 мм. Гетинакс используется в качестве электроизоляционного материала для работы на воздухе в условиях нормальной относительной влажности, а также в условиях повышенной влажности 93% при температуре 40°С. Длительно допустимые рабочие температуры от минус 65°С до 150°. 7. Химические свойства: Гетинакс не стоек к действию сильных кислот и щелочей, однако хорошо противостоит действию минеральных массе, растворителей и жиров. 8. Склонность к сплавообразованию Это пластик, поэтому нет речи о сплавообразовании Стойкость к коррозии Обладает хорошей коррозионной устойчивостью Список литературы 1. Угай Я. А. Общая и неорганическая химия: учеб. для вузов / Я. А. Угай.- 5-е изд., стереотип.- М.: Высш. шк., 2007 2. Глинка Н. Л. Общая химия: учеб. пособие для вузов / под ред. А. И. Ермакова. – М.: Интеграл-Пресс, 2005 3. Сорокин В. С. Материалы и элементы электронной техники: учеб. для вузов: в 2-х т. Т. 1. Проводники, полупроводники, диэлектрики / В. С. Сорокин, Б. Л. Антипов, Н. П. Лазарева.- М.: Академия, 2006 Контрольная работа №1 Вариант 5. Железо Название материала, химический символ Железо, Fe
|
||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 358; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.234.191 (0.032 с.) |
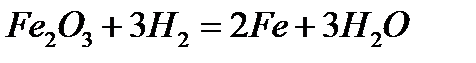
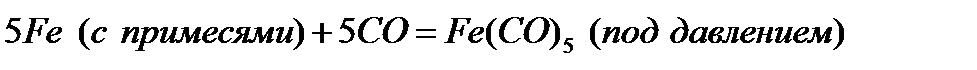
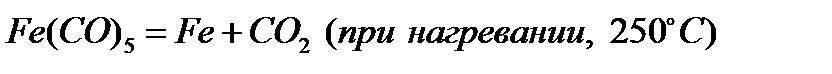
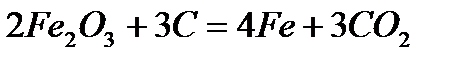
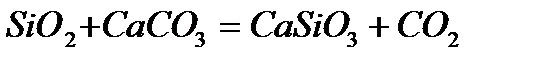
 Расплавленное железо отливают в формы или используют в виде слитков для дальнейшей переработки – отсюда название «литое железо». Эта форма железа раньше содержало до 4% углерода, наряду с примесями кремния, марганца, фосфора и серы, что придавало ему большую хрупкость. Для устранения хрупкости необходимо удалить примеси неметаллов. Этого можно добиться их окислением с гематитом в устаревшем в наше время процессе пудлингования. В результате образовывалось более чистое «сварочное железо». В настоящее же время, большая часть «литого железа» перерабатывается в сталь с 0.5 – 1.5 % содержанием углерода и очень малым содержанием серы и фосфора. В этом случае процесс окисления обычно ведут с помощью чистого кислорода или с использованием мартеновской и электродуговой печи. Малоуглеродистая сталь, получаемая таким образом, дешевле, чем сварочное железо и прочнее и легче поддается обработке, чем «литое железо».
Расплавленное железо отливают в формы или используют в виде слитков для дальнейшей переработки – отсюда название «литое железо». Эта форма железа раньше содержало до 4% углерода, наряду с примесями кремния, марганца, фосфора и серы, что придавало ему большую хрупкость. Для устранения хрупкости необходимо удалить примеси неметаллов. Этого можно добиться их окислением с гематитом в устаревшем в наше время процессе пудлингования. В результате образовывалось более чистое «сварочное железо». В настоящее же время, большая часть «литого железа» перерабатывается в сталь с 0.5 – 1.5 % содержанием углерода и очень малым содержанием серы и фосфора. В этом случае процесс окисления обычно ведут с помощью чистого кислорода или с использованием мартеновской и электродуговой печи. Малоуглеродистая сталь, получаемая таким образом, дешевле, чем сварочное железо и прочнее и легче поддается обработке, чем «литое железо».