
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Условия, в которых находится флуоресцирующее вещество
Растворитель может оказывать влияние на величину разности между lmax спектра поглощения вещества (или спектра возбуждения флуоресценции) и спектра испускания. При увеличении диэлектрической проницаемости растворителя эта разность, называемая Стоксовым сдвигом, увеличивается. Растворитель влияет также и на величину квантового выхода флуоресценции, увеличивая её или уменьшая. Например, квантовый выход флуоресценции эозина в воде равен 0,2, а в ацетоне - близок к 1. Влияние рН сказывается на флуоресценции тех веществ, в молекулах которых имеются функциональные группы, склонные к кислотно-основному взаимодействию. Например, фенол и его производные флуоресцируют в кислой среде, при ионизации фенольного гидроксила флуоресценция исчезает. Органические вещества, цвет и интенсивность флуоресценции которых изменяется при изменении рН, могут быть использованы в качестве кислотно-основных индикаторов (флуоресцеин, хинин и т.п.). При повышении температуры увеличивается вероятность безызлучательных переходов, поэтому интенсивность флуоресценции уменьшается. Однако, у некоторых веществ свечение прекращается уже при -100°С, другие продолжают слабо флуоресцировать даже при >100°С. Если поместить флуоресцирующее вещество в специальную среду и охладить до температуры кипения жидкого азота (или даже жидкого гелия), то можно добиться того, что спектр флуоресценции органического вещества станет линейчатым. Такое явление называется эффектом Шпольского. Использование данного эффекта значительно повышает избирательность анализа и снижает предел обнаружения. Интенсивность флуоресценции вещества и её квантовый выход могут снижаться в присутствии в растворе других веществ, называемых тушителями. Существуют, так называемые, универсальные тушители (например, O2), которые уменьшают флуоресценцию большинства веществ. Однако, чаще тушитель влияет на флуоресценцию одного вещества и не влияет на флуоресценцию другого (например, хлориды уменьшают интенсивность флуоресценции хинина), поскольку эффект тушения в разных случаях имеет различный механизм. Влияние концентрации тушителя на интенсивность флуоресценции вещества описывается уравнением Штерна-Фольмера
где Iq - интенсивность флуоресценции в присутствии тушителя, Сq - концентрация тушителя, k - константа тушения.
Механизм молекулярной фотолюминесценции. Флуоресценция и фосфоресценция При поглощении кванта света молекула вещества переходит из основного электронного состояния в возбуждённое. Одной из характеристик электронного состояния является мультиплетность
где S - суммарный спин данного электронного состояния.
Основное состояние молекулы обычно является синглетным. Возбуждённые состояния могут быть как синглетными, так и триплетными, причём возбуждённое триплетное состояние имеет немного меньшую энергию, чем соответствующее ему синглетное. Для описания физических процессов, которым подвергаются молекулы в возбуждённом состоянии, обычно используют энергетические диаграммы типа показанной на рис. 21.3. Когда молекула поглощает свет, она за очень короткое время (~10-15 с) переходит на какой-то колебательный и вращательный уровень одного из возбуждённых синглетных состояний (обычно S1 или S2). Далее с возбуждённой молекулой могут происходить 2 типа процессов: безызлучательные (показаны на диаграмме волнистой линией) и излучательные (показаны на диаграмме прямой линией). Молекула может отдавать свою энергию небольшими порциями (например, при столкновении с другими молекулами). При этом электрон возвращается с более высоких колебательных уровней на более низкие в пределах данного электронного уровня. Такой процесс называется колебательной релаксацией. Безызлучательный переход между состояниями, имеющими одинаковую энергию и одинаковую мультиплетность, называется внутренней конверсией. Безызлучательный переход между состояниями, имеющими одинаковую энергию, но разную мультиплетность называется интеркомбинационной конверсией. Флуоресценция - излучательный переход между состояниями, имеющими одинаковую мультиплетность. В подавляющем большинстве случаев флуоресценция сложных органических молекул обусловлена переходом с нулевого колебательного уровня возбуждённого состояния S1 на какой-то из колебательных уровней S0, реже S2 ®S0 (например, в молекуле азулена) и очень редко Sk ®Sm или Tm ®Tn. Флуоресценция - быстрый процесс (10-9 - 10-6 с).
Фосфоресценция - излучательный переход между состояниями, имеющими разную мультиплетность. Обычно фосфоресценции соответствует переход T1 ® S0. Переходы между состояниями с различной мультиплетностью имеют очень малую вероятность, то есть являются “запрещёнными”. Излучательный переход, обуславливающий фосфоресценцию, имеет ~ в 106 раз меньшую вероятность, чем переход, определяющий флуоресценцию, поэтому фосфоресценция имеет гораздо большую длительность (в среднем 10-3 - 10 с), чем флуоресценция. 78
|
|||||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 390; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.130.24 (0.005 с.) |
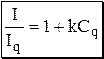
 ,
,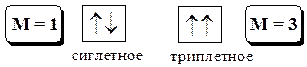
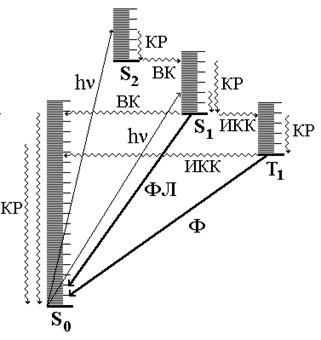 Рис. 21.3. Фотопроцессы в молекуле (диаграмма Яблонского)
КР - колебательная релаксация; ВК - внутренняя конверсия; ИКК - интеркомбинационная конверсия; ФЛ - флуоресценция; Ф - фосфоресценция.
Рис. 21.3. Фотопроцессы в молекуле (диаграмма Яблонского)
КР - колебательная релаксация; ВК - внутренняя конверсия; ИКК - интеркомбинационная конверсия; ФЛ - флуоресценция; Ф - фосфоресценция.



