Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
К занятиям по физической и коллоидной химииСтр 1 из 5Следующая ⇒
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ КУРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ МИНЗДРАВА РОССИИ Кафедра общей и биоорганической химии ЗАДАНИЯ ДЛЯ СТУДЕНТОВ ФАРМАЦЕВТИЧЕСКОГО ФАКУЛЬТЕТА НА САМОСТОЯТЕЛЬНУЮ ПОДГОТОВКУ К ЗАНЯТИЯМ ПО ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ (заочное отделение) КУРСК - 2012 г. Пояснительная записка 1. Цель и задачи дисциплины Цели дисциплины · Сформировать естественно-научное мировоззрение, понимание основных закономерностей различных физико-химических, биологических и иных явлений природы и технологических процессов. · Овладеть физико-химическими основами прогнозирования, разработки, контроля, оптимизации различных технологических процессов, особенно при получении, контроле качества, хранении, применении фармацевтических препаратов. · Обеспечить создание теоретической базы для дальнейшего изучения дисциплин, изучаемых при подготовке профессиональных кадров в области фармации. · Задачи дисциплины: · приобретение теоретических знаний в области основных закономерностей, определяющих направленность и скорость протекания физико-химических процессов, зависимость физико-химических свойств веществ от их химического состава, строения и от условий существования; · формирование у студентов современного представления о свойствах межфазных поверхностей и дисперсных систем, значении основных закономерностей поверхностных и коллоидно-химических явлений в вопросах получения устойчивых лекарственных форм; · изучение теоретических основ ряда физико-химических методов анализа, применяемых в фармации; · формирование умений пользоваться лабораторным оборудованием и реактивами с соблюдением правил техники безопасности; · развитие навыков интерпретации и оценки полученных результатов; · формирование навыков самостоятельной и научно-исследовательской работы.
2. Место дисциплины в структуре основной образовательной Программы (ООП) 2.1. Дисциплина «Ф изическая и коллоидная химия» относится к математическому, естественно-научному и медико-биологическому циклу дисциплин (С.2). 2.2. Основные знания, необходимые для изучения дисциплины, формируются:
- в цикле математических и естественно-научных дисциплин (математика, физика, общая и неорганическая химия, основы физической химии). 2.3. Дисциплина является предшествующей для изучения дисциплин: - органическая химия, - аналитическая химия, - фармацевтическая химия, - фармакогнозия, - биологическая химия, - фармакология, - токсикологическая химия, - фармацевтическая технология. 3. Требования к результатам освоения дисциплины 3.1. После освоения дисциплины студент должен: Знать: 1. основные начала термодинамики, термохимию, 2. значения термодинамических потенциалов (энергий Гиббса и Гельмгольца); 3. следствия из закона Гесса; 4. правила расчета температурного коэффициента; 5. химическое равновесие, способы расчета констант равновесия; 6. коллигативные свойства растворов; 7. влияние факторов на процессы деструкции лекарственных веществ; 8. способы расчета сроков годности, периода полупревращения лекарственных веществ; 9. основные понятия, механизм, виды катализа, роль промоторов, ингибиторов; 10. свойства и особенности поверхностно-активных веществ; 11. возможности использования поверхностных явлений для приготовления лекарственных форм; 12. основы фазовых и физических состояний полимеров, возможности их изменений с целью использования в медицине, фармации; 13. основные свойства высокомолекулярных веществ; факторы, влияющие на застудневание, набухание, тиксотропию, синерезис, коацервацию, пластическую вязкость, периодические реакции в механизме приготовления различных лекарственных форм.
Уметь: 1. определять физико-химические свойства лекарственных веществ; 2. выбирать оптимальный метод анализа вещества, используя соответствующие физические приборы и аппараты; 3. рассчитывать термодинамические функции состояния системы, тепловые эффекты химических процессов; рассчитывать константы равновесия, равновесные концентрации продуктов и исходных веществ; 4. готовить истинные, буферные и коллоидные растворы; 5. измерять физико-химические параметры растворов; 6. собирать простейшие установки для проведения лабораторных исследований; пользоваться физическим, химическим оборудованием, компьютеризированными приборами;
7. табулировать экспериментальные данные, графически их представлять, интерполировать, экстраполировать для нахождения искомых величин; 8. проводить элементарную статистическую обработку экспериментальных данных; 9. оформлять отчетную документацию по экспериментальным данным.
Владеть: 1. навыками интерпретации рассчитанных значений термодинамических функций с целью прогнозирования возможности осуществления и направления протекания химических процессов; 2. техникой экспериментального определения рН раствора при помощи индикаторов и приборов; 3. физико-химическими методиками анализа веществ, образующих истинные и дисперсные системы; 4. методиками анализа физических и химических свойств веществ различной природы; 5. навыками приготовления, оценкой качества, способами повышения стабильности дисперсных систем; 6. навыками проведения научных исследований для установления взаимосвязи физико-химических свойств и фармакологической активности; 7. техникой работы с приборами (фотоэлектроколориметр, спектрофотометр, рН-метр, кондуктометр, вискозиметр и др.); 8. методиками измерений значений физических величин; 9. навыками практического использования приборов и аппаратуры при физическом анализе веществ; 10. методами обработки текстовой и графической информации; 11. методами статистической обработки экспериментальных результатов химических исследований; 12. базовыми технологиями преобразования информации: текстовые, табличные редакторы; техникой работы в сети интернет для профессиональной деятельности; 13. методикой оценки погрешности измерений. 3.2. Процесс изучения дисциплины направлен на формирование следующих компетенций: а) общекультурные (ОК) способностью и готовностью анализировать социально значимые проблемы и процессы, использовать на практике методы гуманитарных, естественнонаучных, медико-биологических и клинических наук в различных видах профессиональной и социальной деятельности (ОК-1); б) профессиональные (ПК) способностью и готовностью проводить анализ лекарственных средств с помощью химических, биологических и физико-химических методов в соответствии с требованиями Государственной фармакопеи (ПК-35); способностью и готовностью интерперетировать и оценивать результаты анализа лекарственнных средств (ПК-36); способностью и готовностью проводить определение физико-химических характеристик отдельных лекарственных форм, в том числе таблеток, мазей, растворов для инъекций (ПК-37); способностью и готовностью работать с научной литературой, анализировать информацию, вести поиск, превращать прочитанное в средство для решения профессиональных задач (выделять основные положения, следствия из них и предложения) (ПК-48). ЗАНЯТИЕ №1 I. ТЕМА ЗАНЯТИЯ: "Бинарные жидкие системы с полной взаимной растворимостью. Законы Коновалова. Дистилляция".
II. ПЛАН ИЗУЧЕНИЯ ТЕМЫ: 1. Классификация бинарных жидких смесей по способности компонентов смеси растворяться друг в друге. 2. Общее и парциальное давление насыщенного пара. Закон Дальтона.
3. Идеальные растворы, их свойства. Закон Рауля для идеальных растворов. 4. Растворы с положительным и отрицательным отклонением от закона Рауля. Свойства растворов с положительным и отрицательным отклонениями. 5. Графики, отражающие зависимость общего и парциальных давлений насыщенного пара от состава для идеальных растворов и растворов с положительным и отрицательным отклонениями. 6. I-й закон Коновалова. 7. Диаграммы кипения в координатах давление-состав или температура-состав для идеальных смесей и систем с небольшим положительным или отрицательным отклонениями от закона Рауля. Принцип построения диаграмм кипения. 8. II-й закон Коновалова. Азеотропные смеси, их свойства. 9. Диаграммы кипения в координатах давление-состав или температура-состав для бинарных жидких растворов, компоненты которых образуют азеотропные смеси. 10. Физико-химические основы дистилляции бинарных жидких смесей различного типа. Виды дистилляции. 11. Состав остатка и дистиллята смесей различного типа при проведении дистилляции в оптимальных условиях. 12. Использование метода перегонки в фармации.
III. ЛИТЕРАТУРА: 1. В. А. Киреев. Краткий курс физической химии, 1978, с.302-318. 2. К. И. Евстратова, Н. А. Купина, Е. Е. Малахова. Физическая и коллоидная химия, 1990, с.69-70, 74-77, 82-84, 93-104.
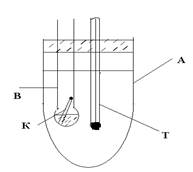
УСТРОЙСТВО ПРИБОРА ДЛЯ ОПРЕДЕЛЕНИЯ ТЕМПЕРАТУРЫ КИПЕНИЯ КАПИЛЛЯРНЫМ МЕТОДОМ И ПОСЛЕДОВАТЕЛЬНОСТЬ РАБОТЫ С НИМ
Прибор состоит из внешней широкой пробирки А, заполненной водой и играющей роль водяной бани, внутренней стеклянной трубки В, заканчивающейся тонкостенным шариком, который заполняется исследуемой жидкостью, термометра (Т) и капилляра (К), запаянного с одного конца. 1. Широкую пробирку на 3/4 заполнить водой и закрепить на штативе. 2. Внутреннюю трубку заполнить до половины шарика испытуемой жидкостью. В жидкость внести капилляр (30 мм длины) открытым концом вниз. Обратить внимание на то, что жидкость не заходит в капилляр. 3. К внутренней трубке прикрепить термометр так, чтобы ртутный резервуар термометра находился на уровне испытуемой жидкости. 4. Нагревать воду в пробирке над пламенем спиртовки при п о с т о я н н о м п о м е ш ив а н и и. Пронаблюдать выход пузырьков газа из капилляра – вначале это пузырьки воздуха, а затем, когда жидкость будет нагрета до температуры кипения – пузырьки паров жидкости. Нагревание прекратить, когда из открытого конца капилляра начнет выделяться быстрый поток пузырьков пара.
5. Дать бане остыть при постоянном помешивании. Обратить внимание на то, что по мере охлаждения системы скорость выхода пузырьков пара вследствие его конденсации в жидкость уменьшается. Когда выделение пузырьков из капилляра прекратится и жидкость начнет заходить в капилляр, сделать отсчет температуры, приняв ее за температуру кипения. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Физико-химическое определение понятию "температура кипения". 2. Практическое значение измерения температуры кипения. 3. Какая величина является непосредственно измеряемой в опыте при определении температуры кипения жидкости капиллярным методом? 4. Почему после погружения капилляра в жидкость открытым концом жидкость до ее нагревания не заходит в капилляр, а в конце опыта, после прекращения нагревания и охлаждения жидкости до температуры кипения, она заходит в капилляр? 5. Состав установки для определения температуры кипения капиллярным методом. 6. Назначение широкой пробирки в приборе. До какого объема она должна быть заполнена водой? 7. Сколько исследуемой жидкости следует внести во внутреннюю пробирку? 8. Назначение капилляра в приборе. 9. Каким концом погружается капилляр в жидкость? 10. Как должен быть расположен термометр при сборке прибора? 11. Основные этапы определения температуры кипения капиллярным методом. 12. В какой момент следует прекратить нагревание жидкости во внешнем сосуде? Почему? 13. Каков качественный состав пузырьков газа в момент прекращения нагревания? 14. Почему необходимо выполнить требование: нагревание и охлаждение жидкости во внешнем сосуде проводить при постоянном перемешивании жидкости? 15. Почему температуру, при которой жидкость заходит в капилляр, принимают за температуру кипения? ЗАНЯТИЕ №2
I. ТЕМА ЗАНЯТИЯ: "Фазовые равновесия в конденсированных системах. Закон распределения. Экстрагирование".
II. ПЛАН ИЗУЧЕНИЯ ТЕМЫ: 1. Эвтектические смеси: свойства, особенности кристаллизации. 2. Диаграмма плавкости для систем с одной эвтектикой: а) общий вид диаграммы; б) кривые ликвидуса и солидуса и их характеристики; в) поля диаграммы, характеристика полей. 3. Термический анализ. Кривая охлаждения. 4. Принципы построения диаграмм плавкости. 5. Значение свойств эвтектических смесей и фазовых диаграмм для фармации. 6. Закон распределения Нернста - содержание, словесная и математическая формулировки (в простейшем виде). 7. Условия выполнения закона распределения в простейшем виде. 8. Коэффициент распределения. Факторы, влияющие на его величину. Способы определения. 9. Особенности распределения третьего компонента при его ассоциации или диссоциации в одной из фаз. Вид уравнения для расчета "К". 10. Практическое использование закона распределения. 11. Экстрагирование - определение метода. 12. Этапы проведения процесса экстрагирования. 13. Условия, влияющие на полноту выделения вещества из раствора экстрагированием.
14. Требования, предъявляемые к экстрагенту при его выборе. 15. Уравнение для расчета массы оставшегося после экстрагирования и извлекаемого вещества при однократной и дробной экстракциях. 16. Назначение метода экстрагирования, его использование в фармации. 17. Физико-химические основы дистилляции бинарных жидких смесей различного типа. Виды дистилляции. 18. Состав остатка и дистиллята смесей различного типа при проведении дистилляции в оптимальных условиях. 19. Использование метода перегонки в фармации.
III. ЛИТЕРАТУРА: 1. В. А. Киреев, Краткий курс физической химии. 1978, с.327-328, 330-331. 2. К. И. Евстратова, Н. А. Купина, Е. Е. Малахова. Физическая и коллоидная химия. М., 1990, с.110-113.
IV. ТЕМЫ ПРАКТИЧЕСКИХ РАБОТ 1. Определение температуры плавления вещества капиллярным методом (Практический навык).
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Определение процессу "экстрагирования".
6. Экстрагент должен иметь низкую вязкость; 7. Экстрагент существенно должен отличаться по плотности от первого растворителя?
ЗАНЯТИЕ №3 I. ТЕМА ЗАНЯТИЯ: "Свойства буферных растворов. Буферная емкость. Электродные потенциалы и электродвижущая сила".
II. ПЛАН ИЗУЧЕНИЯ ТЕМЫ: 1. Ионное произведение воды. Водородный показатель (рН). 2. Нейтральная, кислая, щелочная среды. Значение рН в кислой, щелочной и нейтральной средах при 25 С. 3. Общая, активная и потенциальная кислотность (щелочность) в растворах слабых кислот (оснований). 4. Буферные растворы - определение понятия. Состав буферных растворов. 5. Уравнение для расчета рН кислотного или основного буферных растворов (уравнение Гендерсона-Гассельбаха). Вывод уравнения. 6. Факторы, определяющие рН буферных растворов. 7. Механизм буферного действия при добавлении кислот, щелочей и при разведении. 8. Зона буферного действия. Буферная емкость. 9. Факторы, влияющие на величину буферной емкости. Буферные кривые. 10. Практическое использование буферных растворов. 11. Электродный потенциал - определение понятия. Механизм возникновения электродного потенциала на металлической пластинке, погруженной в раствор своей соли. 12. Схематическая запись электрода (полуэлемента). Уравнение окислительно-восстановительной реакции, сопровождающей образование электродного потенциала. Уравнение Нернста для расчета величины электродного потенциала. 13. Факторы, от которых зависит величина электродного потенциала. Стандартный электродный потенциал. 14. Классификация электродов по механизму возникновения электродного потенциала и по применению. 15. Гальванический элемент. Устройство, принцип работы. 16. Уравнение химической реакции, сопровождающей работу химического гальванического элемента. 17. ЭДС гальванического элемента, ее расчет: а) по уравнению Нернста; б) по величинам электродных потенциалов электродов, образующих гальванический элемент; Определение ЭДС с помощью иономера универсального ЭВ-74. 18. Экспериментальное определение величины электродного потенциала. 19. Стандартный водородный электрод. Устройство, механизм действия. 20. Электроды сравнения: хлорсеребряный и каломельный. Устройство, механизм действия. 21. Электроды определения (индикаторные), используемые для измерения рН: а) водородный; б) хингидронный; в) стеклянный. Устройство, механизм их действия. 22. Потенциометрия. Потенциометрическое определение рН, принцип метода.
III. ЛИТЕРАТУРА: 1. К. И. Евстратова, Н. А. Купина, Е. Е. Малахова. Физическая и коллоидная химия, М., 1990, с.114-116, 124-125, 128-131,160-185, 1880189. 2. М. И. Равич-Щербо, В. В. Новиков. Физическая и коллоидная химия, М., 1975, с.90-100. 3. В. А. Киреев. Краткий курс физической химии. М., 1978, с.409-431, 433-438.
IV. ТЕМЫ ПРАКТИЧЕСКИХ РАБОТ: 1. "Зависимость рН буферных растворов от соотношения концентраций компонентов и разведения буфера". 1. Приготовить три ацетатных буферных раствора с различным соотношением концентраций компонентов. В три одинаковые по диаметру пробирки внести, отмерив пипеткой, заданные объемы растворов уксусной кислоты с концентрацией 0, 2 моль/л и соли ацетата натрия с концентрацией 0, 2 моль/л по схеме.
2. Рассчитать рН в каждом из трех буферных растворов. Для расчета рН использовать уравнение:
где
Т.к.
Для расчетов принять К = 1, 75 10-5
3. Каждый из приготовленных буферных растворов развести в 9 раз. В другие три одинаковые по диаметру пробирки отобрать по 1 мл каждого из приготовленных на первом этапе буфера и добавить по 8 мл дистиллированной воды. Содержимое пробирок тщательно перемешать. 4. Оценить значение рН буферных растворов, приготовленных на первом этапе (отличающихся по соотношению концентраций компонентов), по окраске индикатора. В каждую из трех пробирок первого ряда внести по 5 капель индикатора метилового красного (метил-рот). Содержимое перемешать. Сопоставить окраску индикатора в трех растворах. Сделать вывод о зависимости рН буфера от соотношения концентрации компонентов. 5. Оценить значение рН буферных растворов до и после разведения буферов в 9 раз по окраске индикатора. В каждую из 3 пробирок второго ряда внести по 5 капель индикатора метилового красного. Содержимое перемешать. Со- поставить окраску индикатора в растворах с заданным соотношением концентраций компонентов до и после разведения. Сделать вывод о влиянии разведения на рН буферного раствора.
2. "Потенциометрическое измерение рН с помощью стеклянного электрода"(Практический навык). рН – отрицательный десятичный логарифм активности (концентрации) ионов водорода. рН = -lg аН+. Потенциометрическое измерение рН основано на определении потенциала электрода, потенциал которого зависит от активности (концентрации) ионов водорода, или на измерении ЭДС гальванического элемента, составленного из электрода сравнения и индикаторного электрода (электрода определения, измерительного), потенциал которого зависит от активности или концентрации ионов водорода. В рН-метрии в качестве индикаторных электродов используют водородный электрод определения, хингидронный, стеклянный и др.электроды. В работе используется стеклянный электрод. Измерение рН проводят при помощи прибора "Иономера универсального ЭВ-74". ОПИСАНИЕ ПРИБОРА. Прибор состоит из 2-х узлов: гальванического элемента и потенциометра. Гальванический элемент собран из индикаторного стеклянного электрода, опущенного в исследуемый раствор, и электрода сравнения – насыщенного хлорсеребряного электрода. Потенциометр служит для измерения ЭДС гальванического элемента. На передней панели потенциометра имеется шкала прибора, позволяющая сделать отсчет рН раствора(рХ) или ЭДС гальванического элемента. Шкала прибора имеет две подшкалы – нижнюю, позволяющую определить приблизительное значение рН(или Е) и рассчитанную на 20 единиц, и верхнюю, разбитую на 5 единиц, с помощью которой измеряют точное значение рН(или Е). Верхняя шкала имеет 3 ряда цифр: верхний ряд – измерение температуры раствора от 00 до 1000С; нижний ряд – от 0 до 5; им пользуются, eсли измеряют рН (рХ) в интервалах от 4 до 9, от 9 до 14, от 14 до 19. Отсчет по этому ряду цифр производят следующим образом: определяют положение стрелки и к показанию стрелки прибавляют первую цифру предела. Например, интервал от 4 до 9; стрелка прибора дает показание 1,8; следовательно рН = 1,8 + 4 = 5,8. Средним рядом цифр пользуются при измерении рН в интервале от -1 до 4. На передней панели прибора находятся также следующие органы управления: 1. Тумблер "сеть". 2. Ручки переменных резисторов. "Калибровка"(ее используют для настройки прибора по буферным растворам с известным значением рН). 3. Ручка "Температура раствора". 4. 5 клавиш выбора рода работы. Анионы + /Катионы – При нажатом положении этой клавиши производят измерение активности катионов или отрицательных потенциалов (измерительного электрода гальванического элемента). При отжатом положении измеряют активность анионов или положительных потенциалов
"рХ(рН)" – При нажатом положении этой клавиши измеряют рН или активность ионов (рХ = – lgах+)
Пять клавиш выбора диапазона измерений I. Диапазон приблизительного измерения: -1–19 II. Диапазоны точных измерений от -1 до 4; от 4 до 9; от 9 до 14; от 14 до 19 Корректор нуля. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ. 1. Какие растворы называют буферными? 2. Назначение буферных растворов. 3. Каков состав буферных растворов? 4. Привести уравнение для расчета рН буфера, состоящего а) из слабой кислоты и соли, образованной этой кислотой и сильным основанием; б) из слабого основания и соли, образованной этим основанием и сильной кислотой; 5. От каких двух факторов зависит рН буферного раствора? 6. Какие величины можно определить, используя уравнение для расчета рН буферного раствора? 7. Какими двумя способами можно приготовить буферные растворы? 8. Как рассчитать объемы растворов кислоты (например CH3COOH) и соли (например CH3COONa), имеющих одинаковую исходную концентрацию, которые нужно смешать, чтобы приготовить определенный объем буферного раствора с заданным значением рН? 9. Зона буферного действия: качественная и количественная характеристики. 10. Буферная емкость. Зависимость ее от концентрации буфера и соотношения концентраций компонентов. 11. Имеется два буферных раствора. Значение рК слабого электролита в первом буферном растворе рК1= 4,76, во втором рК2= 3,8. Зоны буферного действия соответственно равны 3,76 - 5,76 и 2,8 - 4,8. Какой буферный раствор следует выбрать, если необходимо создать среду с рН = 4, 6? Ответ обосновать. 12. Дать определение понятию "водородный показатель" – рН. 13.Сформулировать принцип потенциометрического определения рН. 14. По какому признаку выбирают индикаторные электроды (электроды определения, измерительные) в рН-метрии. 15. Перечислить электроды, используемые в рН-метрии как индикаторные. 16. Из каких электродов состоит гальванический элемент, используемый в приборе "Иономер универсальный" при измерении рН раствора? Указать электрод определения и электрод сравнения в этом гальваническом элементе. 17. Как устроен стеклянный электрод? Для какого интервала значений рН он может быть использован? 18. К какой группе электродов по механизму возникновения потенциала относится стеклянный электрод? Каков механизм возникновения электродного потенциала стеклянного электрода? 19. Привести уравнения для расчета потенциала стеклянного электрода. Обозначить величины, входящие в это уравнение. 20. Преимущества и недостатки стеклянного электрода. 21. К какой группе электродов по механизму возникновения потенциала относится хлорсеребряный электрод? Как он устроен? 22. Из каких двух узлов состоит "Иономер универсальный"? Каково назначение потенциометра? 23. Какие органы управления находятся на передней панели прибора? Каково назначение каждого? 24. Шкала прибора: отсчет приблизительного и точного значения рН по шкале прибора. Точность отсчета рН по нижней и верхней шкале. 25. Каков диапазон шкалы приблизительного измерения рН. Каковы диапазоны шкалы точного измерения рН? 26. Основные этапы работы с прибором. 27. Как настроить иономер по температуре при ручной термокомпенсации? 28. Как провести калибровку прибора по буферному раствору? 29. Как определить рН исследуемого раствора, если прибор
ЗАНЯТИЕ №4
I. ТЕМА ЗАНЯТИЯ: "Адсорбция на границе твердое тело-газ, твердое тело-жидкость. Адсорбция из растворов электролитов. Ионообменная адсорбция."
II. ПЛАН ИЗУЧЕНИЯ ТЕМЫ: 1. Понятия "адсорбция", "адсорбент", "адсорбтив", "равновесная концентрация". 2. Способы количественного выражения адсорбции на твердом адсорбенте. Единицы измерения величины адсорбции. Экспериментальное измерение адсорбции на твердом адсорбенте. 3. Природа сил адсорбционного взаимодействия. Физическая и химическая (хемосорбция) адсорбция. 4. Изотерма адсорбции по Фрейндлиху. Уравнение Фрейндлиха. Константы в уравнении Фрейндлиха: их физический смысл и способ нахождения. 5. Изотерма мономолекулярной адсорбции по Ленгмюру. Уравнение Ленгмюра, физический смысл констант в этом уравнении. 6. Нахождение констант в уравнении Ленгмюра (по изотерме адсорбции и путем преобразования уравнения Ленгмюра в уравнение прямой). 7. Факторы, влияющие на величину адсорбции на твердом адсорбенте из газов или растворов. 8. Практическое использование процесса адсорбции в фармации. 9. Разновидности и особенности адсорбции из растворов электролитов. 10. Эквивалентная и избирательная адсорбция из растворов электролитов. 11. Правило Панета-Фаянса. 12. Зависимость адсорбции ионов от величины заряда и размера ионов. Лиотропные ряды. 13. Ионообменная адсорбция, ее особенности. Уравнение Никольского. 14. Иониты: классификация по химической природе матрицы, способу получения (по происхождению), по специфичности ионного обмена (по механизму ионного обмена). 15. Структура и свойства матрицы ионитов. 16. Функциональная (ионогенная) группа ионита. Функциональные группы катионитов и анионитов. Противоионы.. Схема ионного обмена, идущего на катионите и анионите. 17. Использование ионообменной адсорбции для деионизации воды, разделения смеси ионов. 18. Обменная емкость ионитов. 19. Использование ионообменной адсорбции в фармации и медицине.
III. ЛИТЕРАТУРА: 1. С. С. Воюцкий. Курс коллоидной химии, М., 1975, с.81-92, 137-145,146-153, 479-481. 2. К. И. Евстратова, Н. А. Купина, Е. Е. Малахова. Физическая и коллоидная химия, М., 1990, с.302, 325-329, 331-337, 338-346.
IV. ТЕМЫ ПРАКТИЧЕСКИХ РАБОТ: 1. "Адсорбция красителя активированным углем".
I. Провести адсорбцию фуксина на активированном угле. 1. В две колбы на 50 мл внести по 5 мл раствора фуксина и по 0, 25 г растертого активированного угля. 2. Провести адсорбцию в течение 5 минут, периодически встряхивая содержимое колб. 3. Отфильтровать содержимое колб, собрав фильтраты в две отдельные сухие пробирки. 4. Сравнив фильтраты с окраской исходного раствора фуксина, сделать вывод об адсорбции фуксина активированным углем.
II. Провести десорбцию фуксина. 1. После завершения фильтрования на первом этапе перенести воронки с фильтрами и активированным углем, на котором адсорбирован фуксин, в две другие сухие пробирки. На один из фильтров нанести 1 мл дистиллированной воды, на другой - 1 мл этилового спирта. 2. Собрать фильтраты. Сопоставить окраски полученных фильтратов с фильтратами, полученными на первом этапе. 3. Сделать вывод о десорбции фуксина.
2. "Деионизация воды"(Практический навык). Воду можно освободить от присутствующих в ней солей с помощью ионообменной адсорбции, последовательно пропустив воду через катионит в Н+-форме и анионит в ОН--форме (или наоборот). Этот процесс называется деионизацией или обессоливанием. Процесс деионизации воды, содержащей, например, хлорид калия, с помощью сульфо-катионита в Н+-форме и амино-анионита в ОН--форме можно представить следующей схемой: а) на катионите:
элюат I или
б) на анионите:
элюат I или
ПОСЛЕДОВАТЕЛЬНОСТЬ ПРОВЕДЕНИЯ ДЕИОНИЗАЦИИ ВОДЫ. 1. Зарядить катионит в колонке Н+-ионами (перевести в Н+-форму). Для этого, через колонку, заполненную набухшим катионитом, медленно пропустить 10 мл 1М раствора HCl. Промыть катионит дистиллированной водой до желтой окраски элюата по метиловому оранжевому. Контроль рН элюата проводить, нанося каплю элюата на предметное стекло и добавляя к ней каплю индикатора метилового оранжевого. 2. Зарядить анионит в колонке ОН--ионами (перевести в ОН--форму). Для этого через колонку, заполненную набухшим анионитом, медленно пропустить 10 мл 1М раствора NaOH. Промыть анионит дистиллированной водой до бесцветной окраски элюата по фенолфталеину. Контроль рН элюата проводить, нанося каплю элюата на предметное стекло и добавляя к ней каплю индикатора. 3. Слить слой воды над катионитом в Н+-форме и медленно пропустить через катионит 10 мл воды, в которой содержатся примеси соли (например, водный раствор суфьфата меди). Элюат (I) собрать в пробирку. 4. Слить слой воды над анионитом в ОН--форме и медленно пропустить элюат (I) через анионит. Элюат (II), выходящий из колонки с анионитом, собрать в чистую пробирку. 5. Проверить качество воды, подвергнутой деионизации. Для этого в порциях элюата (II) провести соответствующие качественные реакции на анион SО42-и катион Cu2+, присутствовавшие в загрязненной воде.
2. "Разделение ионов меди и железа методом круговой хроматографии на бумаге". I. Разделить смесь ионов Fe3+и Cu2+ хроматографией на бумаге. 1. Взять круг хроматографической бумаги диаметром 10 см с вырезанной к центру круга полоской шириной 2 см. Полоску бумаги отогнуть в вертикальное положение. 2. На место сгиба нанести каплю раствора, приготовленного из равных объемов 2% растворов сульфата меди и хлорида железа. 3. Бумагу подсушить и поместить между одинаковыми по диаметру чашками Петри таким образом, чтобы отогнутая полоска бумаги была погружена в растворитель (вода), налитый в чашку. 4. Проследить за движением растворителя по бумаге. Когда фронт растворителя приблизится к краям чашки Петри, процесс прекратить, хроматографическую бумагу просушить.
II. Проявить хроматограмму. 1. Обработать хроматограмму раствором K4[Fe(CN)6]. В зоне распределения ионов железа образуется голубой осадок берлинской лазури, в зоне распределения ионов меди - красновато-коричневый осадок железистосинеродистой меди.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Сформулировать принцип деионизации воды. 2. Назначение метода. 3. Явление, лежащее в основе метода.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 346; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.240.178 (0.195 с.) |

 - концентрация кислоты в растворе, взятом для приготовления буфера
- концентрация кислоты в растворе, взятом для приготовления буфера - концентрация соли в растворе, взятом для приготовления буфера.
- концентрация соли в растворе, взятом для приготовления буфера.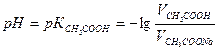 или
или