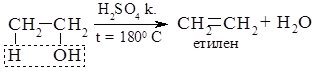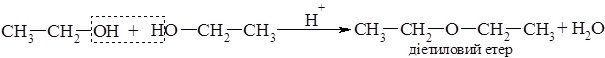Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Бензен як представник ароматичних вуглеводнів.
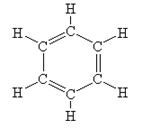
Будова молекули. Молекулярна формула бензену - С6Н6. Першим структурну формулу бензену запропонував у 1865 році німецький хімік А.Кекуле:
Через кілька років Кекуле висунув ідею, що подвійні зв’язки не закріплені в молекулі, а постійно переміщуються від одного атома Карбону до іншого:
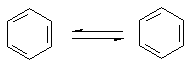
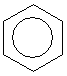
Проте і ця формула не повністю відповідає реальній структурі молекули бензену. в молекулі бензену немає простих і подвійних зв’язків. Електронна густина розподілена рівномірно, а тому всі зв’язки між атомами Карбону в молекулі бензену рівноцінні. Найточніше це відображає структурна формула у вигляді правильного шестикутника з колом усередині:
Фізичні властивості бензену: Рідина, безбарвна, має специфічний запах, t кипіння = 80°С, не розчиняється у воді, добре розчиняється у спиртах, ацетоні, етерах та інших органічних розчинниках. Також сам бензен є чудовим розчинником для багатьох речовин. Хімічні властивості бензену. 1) Повне окиснення (горіння). Бензен горить кіптявим полум’ям:
С6Н6 + 7,5 О2 → 6 СО2 + 3 Н2О
2 С6Н6 + 15 О2 → 12 СО2 + 6 Н2О
2) Реакції заміщення атомів Гідрогену в бензольному кільці на галоген (протікає легше, ніж в алканів):
C6H6 + Br2 → C6H5Br + HBr
3) Реакції приєднання (протікають значно важче, ніж заміщення). а) приєднання водню (гідрування):
C6H6 + 3 H2 → C6H12
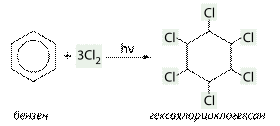
б) приєднання хлору (хлорування):
C6H6 + 3 Cl2 → C6H6Cl6
Застосування бензену: 1) Виробництво отрутохімікатів для захисту рослин; 2) Як розчинник; 3) Виробництво вибухових речовин; 4) Як добавка до моторного палива; 5) Органічний синтез, наприклад, одержання аніліну, фенолу, стирену й полістирену, лікарських препаратів.
Оксигеновмісні органічні сполуки.
Спирти.
Багато органічних сполук містять у своїх молекулах, крім атомів Карбону і Гідрогену, ще й атоми Оксигену. Такі сполуки називаються оксигеновмісними. Оксигеновмісні сполуки поділяються на класи – клас спиртів, клас карбонових кислот, клас естерів, клас жирів тощо.
Спирти – це органічні сполуки, які містять одну або більше гідроксильних груп, безпосередньо зв’язаних з насиченим атомом Карбону. Загальна формула спиртів R(OH)n, де R – вуглеводневий радикал.
За природою вуглеводневого радикалу спирти поділяють на насичені, ненасичені та ароматичні. За кількістю гдроксидних груп спирти поділяють на одноатомні та багатоатомні.
Загальна формула одноатомних насичених спиртів – CnH2n+1OН. Типовими представниками насичених одноатомних спиртів є метанол CH3OH і етанол C2H5OH. Оскільки до складу молекул наведених спиртів входить одна гідроксильна група OH, такі спирти належать до одноатомних. Гідроксильна група OH є функціональною групою, тобто такою, що зумовлює хімічні властивості спиртів. За систематичною номенклатурою, назву спирту утворюють від назви відповідного насиченого вуглеводню, додаючи до неї суфікс - ол. Гомологічний ряд та фізичні властивості спиртів.
Нижчі спирти – безбарвні рідини з характерним запахом; вищі спирти – тверді речовини. Спирти мають високі температури кипіння. Це обумовлено тим, що спирти, як і вода, є асоційованими рідинами. Їх молекули здатні утворювати міжмолекулярні водневі зв’язки, сполучаючись при цьому в довгі ланцюги – асоціати.
Перші члени гомологічного ряду спиртів змішуються з водою в усіх співвідношеннях, зі збільшенням числа атомів Карбону в молекулі розчинність у воді швидко зменшується, вищі спирти у воді не розчинні. Ізомерія спиртів. Для спиртів характерна структурна ізомерія. Ізомерія у ряду спиртів розпочинається з третього члена гомологічного ряду. Ці ізомери відрізняються положенням гідроксильної групи. Тому положення групи – ОН у назві спирту вказують окремою цифрою:
Окремі представники. Метиловий спирт (метанол, деревний спирт) СН3ОН – родоначальник гомологічного ряду спиртів. Безбарвна рідина, легко змішується з водою, спиртами, іншими органічними розчинниками. Одержують метанол із синтез-газу при нагріванні за наявності каталізатора:
СО2 + Н2 → СН3ОН + Н2О або з карбон (ІІ) оксиду та водню при нагріванні: СО + 2Н2 → СН3ОН До 1923 р. метанол одержували виключно сухою перегонкою деревини, тому його ще називають деревний спирт. Вперше метиловий спирт у чистому вигляді виділили Ж.Дюма та Е. Пеліго у 1834 р. і встановили його формулу (СН3ОН), а також сформували уявлення про спирти, як окремий клас органічних сполук. Вперше метанол синтезував П. Бертло у 1858 р.: CH3Cl + KOH → CH3OH + KCl хлорметан Метиловий спирт надзвичайно отруйний. Попадання в організм людини біля 30 г метанолу викликають смерть, а менші дози руйнують зоровий нерв і ведуть до втрати зору. Етиловий спирт (від гр. aether – повітря, етер, та hyle – дерево, речовина)(етанол, винний спирт) С2Н5ОН. Безбарвна легко рухлива рідина, з характерних запахом і пекучим смаком. Змішується у всіх співвідношеннях з водою, іншими спиртами. Входить до складу алкогольних напоїв. У невеликих кількостях викликає стан алкогольного сп’яніння, збільшення дози веде до наркотичного стану. У середні віки спирт вважали найкращими ліками і навіть називали “вода життя” (лат. aqua vitae). Інша назва етанолу – “вогняна вода” (лат. aqua ardens) вказувала на його властивості. Етиловий сприт широко застосовують як сировину в органічному синтезі, як розчинник, у фармації та медицині для виготовленні настоянок, екстрактів, як дезинфікуючий засіб. У промисловості етанол одержують бродінням вуглеводів рослинного походження та гідратацією етилену у присутності концентрованої H2SO4: C6H12O6
СН2=СН2 + Н2О Вперше цю реакцію здійснив французький хімік П. Бертло, який був не тільки чудовим хіміком, але й очолював Міністерство народної освіти та вишуканих мистецтв, а також був Міністром іноземних справ Французької республіки. Хімічні властивості спиртів 1) Повне окиснення (горіння). При горінні спиртів утворюється карбон (IV) оксид і вода: СН3ОН + 1,5О2 → СО2 + 2Н2О 2 СН3ОН + 3 О2 → 2 СО2 + 4 Н2О С2Н5ОН + 3О2 → 2СО2 + 3Н2О С3Н7ОН + 4,5О2 → 3СО2 + 4Н2О 2 С3Н7ОН + 9 О2 → 6СО2 + 8Н2О 2) Взаємодія з лужними металами. Спирти взаємодіють з лужними металлами, утворюючи алкоголяти: 2СН3СН2ОН + 2Na → 2СН3СН2ONa + Н2 натрій етилат
2 СН3ОН + 2 К → 2 СН3ОК + Н2 калій метилат 2 С3Н7ОН + 2 Li → 2 С3Н7ОLi + Н2 літій пропилат 3) Взаємодія з гідрогенгалогенами (HF, HCl, HBr, HI). При взаємодії спиртів з гідрогенгалогенами відбувається заміщення гідроксильної групи на атом галогену: СН3СН2ОН + HCl → СН3СН2Cl + Н2O хлоретан СН3ОН + НBr → СН3Br + Н2О бромметан 4) Дегідратація спиртів (відщеплення молекули води). а) внутрішньомолекулярна дегідратація спиртів відбувається за температури близько 1800 С у присутності концентрованих сульфатної або фосфатної кислот, алюміній оксиду. При цьому утворюються алкени.
б) міжмолекулярна дегідратація відбувається за температур нижче 180°С:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 338; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.205.5 (0.027 с.) |


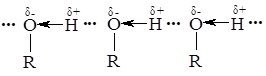
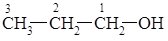 пропан-1-ол
пропан-1-ол
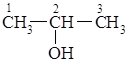 пропан-2-ол
пропан-2-ол
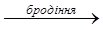 2СН3СН2OH + 2CO2
2СН3СН2OH + 2CO2 СН3СН2OH
СН3СН2OH