Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
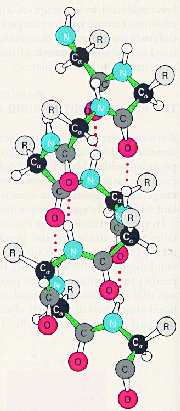
Термин конформация используют для описания пространственного расположения в органической молекулы замещающих групп, способных свободно изменять свое положение в пространстве без разрыва каких бы то ни было связей. Пептидная цепь обладает значительной гибкостью. В результате внутри цепочечных взаимодействий она приобретает определенную пространственную структуру (конформацию). В белках различают два уровня пространственной организации для одной полипептидной цепи: вторичную и третичную структуры белка. Для белков, содержащих несколько полипептидных цепей, возможно, рассматривают пространственную укладку этих цепей относительно друг друга - четвертичную структуру белка. Вторичная структура белков - это укладка белковой молекулы в пространстве без учета влияния боковых заместителей. Выделяют два типа вторичной структуры: a-спираль и b- структуру (складчатый слой). Остановимся более подробно на рассмотрении каждого типа вторичной структуры. a-Спираль представляет из себя правую спираль с одинаковым шагом, равным 3,6 аминокислотных остатков. a-Спираль стабилизируется внутримолекулярными водородными связями, возникающими между атомами водорода одной пептидной связи и атомами кислорода четвертой по счету пептидной связи.
Боковые заместители расположены перпендикулярно плоскости a-спирали.
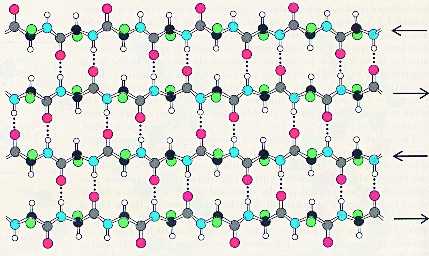
Т.о. свойства данного белка определяются свойствами боковых групп аминокислотных остатков: входящих в состав того или иного белка. Если боковые заместители гидрофобны, то и белок, имеющий структуру a-спираль гидрофобен. Примером такого белка является белок кератин, из которого состоят волосы. В результате получается, что a- спираль пронизана водородными связями и является очень устойчивой структурой. При образовании такой спирали работают две тенденции: ¨ молекула стремится к минимуму энергии, т.е. к образованию наибольшего числа водородных связей; ¨ из-за жесткости пептидной связи сблизиться в пространстве могут лишь первая и четвертая пептидные связи. В складчатом слое пептидные цепи располагаются параллельно друг другу, образуя фигуру, подобную листу, сложенному гармошкой. Пептидных цепей, взаимодействующих между собой водородными связями, может быть большое количество. Расположены цепи антипараллельно.
Чем больше пептидных цепей входит в состав складчатого слоя, тем прочнее молекула белка. Сравним свойства белковых материалов шерсти и шелка и объясним различие в свойствах этих материалов с точки зрения строения белков, из которых они состоят. Кератин - белок шерсти - имеет вторичную структуру a-спираль. Шерстяная нить не такая прочная, как шелковая, легко растягивается в мокром состоянии. Это свойство объясняется тем, что при приложении нагрузки водородные связи рвутся и спираль растягивается. Фиброин - белок шелка - имеет вторичную b-структуру. Шелковая нить не вытягивается и является очень прочной на разрыв. Это свойство объясняется тем, что в складчатом слое взаимодействуют между собой водородными связями много пептидных цепей, что делает эту структуру очень прочной. Аминокислоты различаются по способности участвовать в образовании a-спиралей и b-структур. Редко встречаются в a-спиралях глицин, аспаргин, тирозин. Пролин дестабилизирует a-спиральную структуру. Объясните, почему? В состав b-структур входит глицин, почти не встречаются пролин, глютаминовая кислота, аспаргин, гистидин, лизин, серин. В структуре одного белка могут находиться участки b-структур, a-спиралей и нерегулярные участки. На нерегулярных участках пептидная цепь может сравнительно легко изгибаться, менять конформацию, в то время, как спираль и складчатый слой представляют собой достаточно жесткие структуры. Содержание b-структур и a-спиралей в разных белках неодинаково. Третичная структура белков определяется взаимодействием боковых заместителей пептидной цепи. Для фибриллярных белков трудно выделить общие закономерности в образовании третичных структур. Что касается глобулярных белков, то такие закономерности существуют, и мы их рассмотрим. Третичная структура глобулярных белков образуется путем дополнительного складывания пептидной цепи, содержащей b-структуры, a-спирали и нерегулярные участки, так, что гидрофильные боковые группы аминокислотных остатков оказываются на поверхности глобулы, а гидрофобные боковые группы спрятаны вглубь глобулы, иногда образуют гидрофобный карман.
Силы, стабилизирующие третичную структуру белка. Электростатическое взаимодействие между разно заряженными группами, крайний случай - ионные взаимодействия. Водородные связи, возникающие между боковыми группами полипептидной цепи. Гидрофобные взаимодействия. Ковалентные взаимодействия (образование дисульфидной связи между двумя остатками цистеина с образованием цистина). Образование дисульфидных связей приводит к тому, что удаленные области полипептидной молекулы сближаются и фиксируются. Дисульфидные связи разрушаются под действием восстановителей. Это свойство используется для химической завивки волос, которые почти полностью представляют собой белок кератин, пронизанный дисульфидными связями. Характер пространственной укладки определяется аминокислотным составом и чередованием аминокислот в полипептидной цепи (первичной структурой). Следовательно, каждый белок имеет только одну пространственную структуру, соответствующую его первичной структуре. Небольшие изменения конформации белковых молекул происходят при взаимодействии с другими молекулами. Эти изменения порой играют огромную роль при функционировании белковых молекул. Так, при присоединении молекулы кислорода к гемоглобину несколько изменяется конформация белка, что приводит к эффекту кооперативного взаимодействия при присоединении остальных трех молекул кислорода. Такое изменение конформации в лежит в основе теории индуцирующего соответствия при объяснении групповой специфичности некоторых ферментов. Кроме ковалентной дисульфидной все остальные связи, стабилизирующие третичную структуру, являются по своей природе слабыми и легко разрушаются. При разрыве большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная уникальная для каждого белка конформация нарушается, при этом часто теряется биологическая активность белка. Такое изменение в пространственном строении называется денатурацией.
|
||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 556; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.174.168 (0.006 с.) |