
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метгемоглобин (methaemoglobin) ⇐ ПредыдущаяСтр 9 из 9
вещество, образующееся в случае, когда присутствующие в пигменте крови гемоглобине атомы железа окисляются с образованием окиси железа (для сравнения: оксигемоглобин). Метгемоглобин не может соединяться с молекулярным кислородом и, следовательно, не может переносить кислород в организме. Наличие метгемоглобина в крови (метгемоглобинемия (methaemoglobinaemia)) может быть связано с приемом кислородосодержащих лекарственных веществ или с каким-либо наследственным нарушением состава молекулы гемоглобина. Симптомами метгемоглобинемии являются повышенная утомляемость, головная боль, головокружение и цианоз. [ http://mirslovarei.com] Спектральные свойства оксигемоглобина (рис.1) характеризуются наличием двух полос поглощения в желто-зеленой части видимого спектра, одна из которых, лежащая ближе к красной области спектра, обозначается как В ближней инфракрасной области спектра оксигемоглобин имеет широкую малоинтенсивную полосу поглощения около 925 - 930 нм (рис.2). В ультрафиолетовой области наблюдаются две полосы поглощения. Вместо
Спектральные свойства метгемоглобина зависят от рН среды. При рН-7 метгемоглобин находится в кислой форме. Спектр поглощения характеризуется узкой полосой с максимумом при 500 нм, широкой - в области 630 нм и интенсивной полосой Соре в интервале 405-407 нм. В области 540-570 нм имеются два перегиба кривой поглощения. При рН 7.4 20% всего метгемоглобина составляет щелочной метгемоглобин. При увеличении рН спектр постепенно меняется: исчезает полоса с максимумом при 630 нм, заменяясь неотчетливым перегибом при 600 нм, в желто-зеленой области появляются две полосы поглощения с максимумами на 577 и 540 нм. Максимум полосы Соре смещается к 411 нм. Щелочные растворы метгемоглобина имеют максимумы при 417, 540 и 578 нм, положение которых незначительно отличается от оксигемоглобиновых, но их интенсивность значительно ниже. После рН 9.4 увеличение рН приводит к исчезновению полос с максимумами при 577 нм и 540 нм.
Рисунок1. Спектральная зависимость молярного коэффициента поглощения гемоглобина. Шкала линейная.: 1 – оксигенированная форма, 2 – деоксигенированная. Рисунок2. Спектральная зависимость молярного коэффициента поглощения гемоглобина. Шкала логарифмическая: 1 – оксигенированная форма, 2- деоксигенированная.
Важным для практики является свойство гемоглобина изменять свое сродство с кислородом в зависимости от температуры, рС02 и рН крови, а также от давности хранения консервированной крови (Laver, Sei-fen, 1964). Снижение температуры, рС02 и возрастание рН увеличивают химическое сродство гемоглобина с кислородом, что графически выражается в смещении кривой диссоциации оксигемоглобина влево (см. рис. 3). Сродство гемоглобина к кислороду повышается, то процесс идет в сторону образования оксигемоглобина и график диссоциации смещается влево. Это наблюдается при снижении напряжения углекислого газа при понижении температуры, при сдвиге рН в щелочную сторону.
При снижении сродства гемоглобина к кислороду процесс идет больше в сторону диссоциации оксигемоглобина, при этом график диссоциации смещается вправо. Это наблюдается при повышении парциального давления углекислого газа, при повышении температуры, при смещении рН в кислую сторону.
Каждый газ имеет свой коэффициент растворимости. При температуре тела растворимость СО2 в 25 раз больше, чем О2. Из-за хорошей растворимости углекислоты в крови и тканях СО2 переносится в 20 раз легче, чем О2. Стремление газа переходить из жидкости в газовую фазу называют напряжением газа. В обычных условиях в 100 мл крови находится в растворенном состоянии всего 0,3 мл О2 и 2,6 мл СО2. Такие величины не могут обеспечить запросы организма в О2. Газообмен кислорода между альвеолярным воздухом и кровью происходит благодаря наличию концентрационного градиента О2 между этими средами. Транспорт кислорода начинается в капиллярах легких, где основная масса поступающего в кровь О2 вступает в химическую связь с гемоглобином. Гемоглобин способен избирательно связывать О2 и образовывать оксигемоглобин (НрО2). Один грамм гемоглобина связывает 1,36 - 1,34 мл О2, а в 1 литре крови содержится 140-150 г гемоглобина. На 1 грамм гемоглобина приходится 1,39 мл кислорода. Следовательно, в каждом литре крови максимально возможное содержание кислорода в химически связанной форме составит 190 - 200 мл О2 или 19 об% - это кислородная емкость крови. Кровь человека содержит примерно 700 - 800 г гемоглобина и может связывать 1 л кислорода. В обычных УСЛОВИЯХ насыщение О2 составляет 95-97%. При дыхании чистым кислородом насыщение крови О2 достигает 100%, а при дыхании газовой смесью с низким содержанием кислорода процент насыщения падает. При 60-65% наступает потеря сознания. Зависимость связывания кислорода кровью от его парциального давления можно представить в виде графика, где по оси абсцисс откладывается р02 в крови, по ординате - насыщение гемоглобина кислородом.
Рис. 3. Кривые диссоциации оксигемоглобина цельной крови при различных рН крови [А] и при изменении температуры (5) Кривые 1-6 соответствуют 0°, 10°, 20°, 30°, 38° и 43°С (увеличить)
Этот график - кривая диссоциации оксигемоглобина, или сатурационная кривая, показывает, какая доля гемоглобина в данной крови связана с О2 при том или ином его парциальном давлении, а какая - диссоциирована, т.е. свободна от кислорода. Кривая диссоциации имеет S-образную форму. Плато кривой характерно для насыщенной О2 (сатурированной) артериальной крови, а крутая нисходящая часть кривой - венозной, или десатурированной, крови в тканях (рис. 1). Сродство кислорода к гемоглобину и способность отдавать О2 в тканях зависит от метаболических потребностей клеток организма и регулируется важнейшими факторами метаболизма тканей, вызывающими смещение кривой диссоциации. К этим факторам относятся: концентрация водородных ионов, температура, парциальное напряжение углекислоты и соединение, которое накапливается в эритроцитах - это 2,3-дифосфоглицератфосфат (ДФГ). Уменьшение рН крови вызывает сдвиг кривой диссоциации вправо, а увеличение рН крови - сдвиг кривой влево. Вследствие повышенного содержания СО2 в тканях рН также меньше, чем в плазме крови. Величина рН и содержание СО2 в тканях организма изменяют сродство гемоглобина к О2. Их влияние на кривую диссоциации оксигемоглобина называется эффектом Бора (Х. Бор, 1904). При повышении концентрации водородных ионов и парциального напряжения СО2 в среде сродство гемоглобина к кислороду снижается. Этот "эффект" имеет важное приспособительное значение: СО2 в тканях поступает в капилляры, поэтому кровь при том же рО2 способна освободить больше кислорода. Образующийся при расщеплении глюкозы метаболит 2,3-ДФГ также снижает сродство гемоглобина к кислороду.
На кривую диссоциации оксигемоглобина оказывает влияние также и температура. Рост температуры значительно увеличивает скорость распада оксигемоглобина и уменьшает сродство гемоглобина к О2. Увеличение температуры в работающих мышцах способствует освобождению О2. Связывание О2 гемоглобином снижает сродство его аминогрупп к СО2 (эффект Холдена). От парциального напряжения физически растворенного углекислого газа зависит процесс связывания СО2 кровью. Углекислота поступает в эритроцит, где имеется фермент карбоангидраза, который может в 10 000 раз увеличить скорость образования угольной кислоты. Пройдя через эритроцит, угольная кислота превращается в бикарбонат и переносится к легким. Различные яды, ограничивающие транспорт О2, такие как СО, нитриты, ферроцианиды и многие другие, практически не действуют на транспорт СО2 Блокаторы карбоангидразы также никогда полностью не нарушают образование молекулярного СО2. И наконец, ткани обладают большой буферной емкостью, но не защищены от дефицита О2. Выведение СО2 легкими может нарушиться при значительном уменьшении легочной вентиляции (гиповентиляции) в результате заболевания легких, дыхательных путей, интоксикации или нарушении регуляции дыхания. Задержка СО2 приводит к дыхательному ацидозу - уменьшению концентрации бикарбонатов, сдвигу рН крови в кислую сторону. Избыточное выведение СО2 при гипервентиляции во время интенсивной мышечной работы, при восхождении на большие высоты может вызвать дыхательный алкалоз, сдвиг рН крови в щелочную сторону. [http://www.medicinform.net/human/fisiology2_2.htm] Применение на практике Спектрометрический метод используют для обнаружения оксида углерода (II) в крови.
В крови лиц, отравленных оксидом углерода (II), не весь гемоглобин превращается в карбоксигемоглобин. Смерть наступает значительно раньше, чем достигается полное превращение оксигемоглобина в карбоксигемоглобин. Карбоксигемоглобин можно обнаружить в крови спектроскопом, который является прибором для визуального спектрального определения ряда веществ, в том числе и карбоксигемоглобина. При рассматривании крови спектроскопом наблюдаются линии и полосы, позволяющие сделать вывод о наличии или отсутствии карбоксигемоглобина. Подлежащую исследованию кровь разбавляют водой до тех пор, пока не будет получен раствор, имеющий светло-розовую окраску. При спектроскопическом исследовании этого раствора четко видны соответствующие спектральные полосы. Спектр оксигемоглобина крови OHb имеет две полосы поглощения между линиями Фраунгофера D и Ε при длинах волн 577—589 и 536—556 нм. Спектр карбоксигемоглобина COHb имеет две полосы поглощения при длинах волн 564—579 и 523— 536 нм. Смещается влево. После прибавления одного объема свежеприготовленного раствора сульфида аммония (NH 4) 2 S или других восстановителей (дитионит натрия Na 2 S 2 O 4 ·2H 2 O и др.) к четырем объемам водного раствора исследуемой крови оксигемоглобин (OHb) превращается в дезоксигемоглобин Hb, в спектре которого имеется одна широкая полоса поглощения при 543—596 нм. Карбоксигемоглобин не восстанавливается сульфидом аммония и другими восстановителями. Поэтому после прибавления восстановителей полосы поглощения карбоксигемоглобина не исчезают. Таким образом, после прибавления раствора сульфида аммония к крови, содержащей окси- и карбоксигемоглобин, сохраняются две полосы поглощения карбоксигемоглобина, но исчезают полосы поглощения оксигемоглобина, а вместо них появляется широкая полоса поглощения дезоксигемоглобина. По наличию соответствующих полос поглощения в спектре крови делают вывод об отравлении оксидом углерода (II). Спектральный метод оправдывает себя при исследовании крови, содержащей 10-30 % карбоксигемоглобина. Практическая часть Порядок выполнения работы
1. Приготовить раствор оксигемоглобина в концентрации 2. Снять спектр поглощения исследуемого образца. 3. Настроить термостат на необходимую температуру и поместить в него раствор гемоглобина (воспользоваться одним из способов ниже). 4. Снять спектр поглощения до и после нагрева. 5. Сделать вывод об оптических свойствах растворов гемоглобина, модифицированных воздействием различных температур. Варианты термостатирования: 1. раствор термостатировать при 35,45,55 градусах в течение 20 мин. 2. раствор термостатировать при 40 градусах в течение 10,15,30,45 мин. 3. раствор термостатировать при 50 градусах в течение 5,10,15,20 мин. Контрольные вопросы: 1. Как отличаются гемоглобин, оксигемоглобин и метгемоглобин в зеленой области спектра и полосе Соре? 2.Изобразите графики поглощения гемоглобина, оксигемоглобина и метгемоглобина.
3.От чего зависит сродство кислорода к гемоглобину и способность отдавать О2? 4.Как используют спектрометрический метод для обнаружения оксида углерода (II) в крови? 5.Как влияет рн среды на спектральные свойства метгемоглобина? 6.Как влияет парциальное давление и температура на кривую диссоциации оксигемоглобина?
|
|||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 808; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.31.209 (0.03 с.) |
 -полоса; другая, с более короткой длиной волны, более широкая и с менее резкими краями,- как полоса
-полоса; другая, с более короткой длиной волны, более широкая и с менее резкими краями,- как полоса 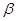 . В фиолетовой части спектра лежит весьма интенсивная полоса поглощения, обозначаемая как
. В фиолетовой части спектра лежит весьма интенсивная полоса поглощения, обозначаемая как 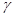 -полоса (или полоса Соре). Максимум
-полоса (или полоса Соре). Максимум  -полосы, обусловленной белковой частью молекулы гемоглобина, находится при 275 - 280 нм.
-полосы, обусловленной белковой частью молекулы гемоглобина, находится при 275 - 280 нм.

 Газы в крови находятся в двух состояниях: физически растворенном и химически связанном. Растворение происходит в соответствии с законом Генри, согласно которому количество газа, растворенного в жидкости, прямо пропорционально парциальному давлению этого газа над жидкостью. На каждую единицу парциального давления в 100 мл крови растворяется 0,003 мл О2 или 3 мл/л крови.
Газы в крови находятся в двух состояниях: физически растворенном и химически связанном. Растворение происходит в соответствии с законом Генри, согласно которому количество газа, растворенного в жидкости, прямо пропорционально парциальному давлению этого газа над жидкостью. На каждую единицу парциального давления в 100 мл крови растворяется 0,003 мл О2 или 3 мл/л крови.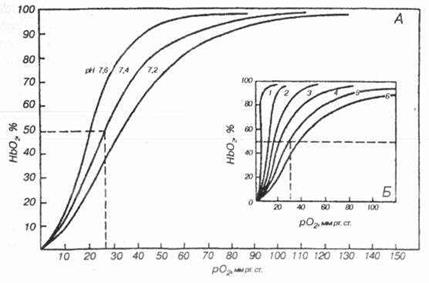
 моль/л.
моль/л.


