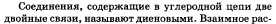Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Какой объем углекислого газа образуется при спиртовом брожении глюкозы массой 270г.Стр 1 из 4Следующая ⇒
Ответы по химии для 11 класса
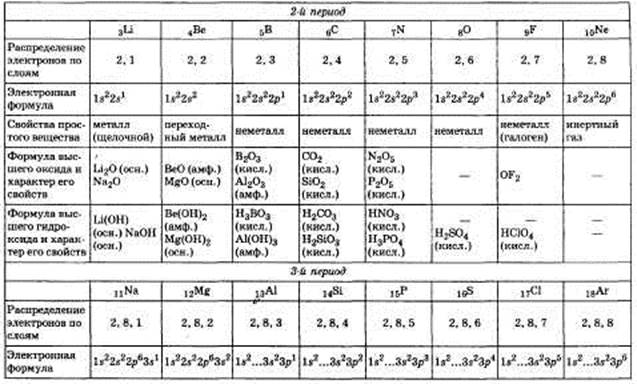
1. Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
2. Предельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применение метана. Экологическое значение алканов.
Общая формула CnH2n+2
3. Задача. Вычислить массу вещества, полеченного при пропускании 40г брома рез этилен.
Билет №2 1. Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы.
2. Непредельные углеводороды ряда этилена, общая формула и химическое строение. Свойства и применение этилена. Экологическое значение этилена.
Какой объем углекислого газа образуется при спиртовом брожении глюкозы массой 270г?
Билет №3 1. Виды химической связи: металлическая, ковалентная (полярная и неполярная).
2.Диеновые углеводороды, их химическое строение, свойства, получение и практическое значение.
Какова масса соли, образующейся при взаимодействии растворов, содержащих 14г гидроксида калия и азотной кислоты? Билет №4 Виды химической связи: ионная, координационная, водородная. Ионная связь образуется, когда "обмен "становится настолько неравными, что электрон отрывается от своего атома А и полностью переходит к атому B, в результате чего образуется пара ионов: А. + В . → А+:В- Водородные связи Водородсодержащие группы атомов (где атом водорода соединен с атомом фтора, кислорода или азота, реже: хлора, серы или других неметаллов) часто образуют устойчивую химическую связь с электроотрицательными атомами, входящими в состав другой или той же самой молекулы. Такой вид химической связи получил название водородной связи. Это частный случай Ван-дер-ваальсовых сил. Ковалентные связи H-O, H-F, H-N являются сильно полярными, за счет чего на атоме водорода скапливается избыточный положительный заряд, а на противоположных полюсах - избыточный отрицательный заряд. Между разноименно заряженными полюсами возникают силы электростатического притяжения - водородные связи. Водородный вид химической связи может быть как межмолекулярным, так и внутримолекулярным. Энергия водородной связи примерно в десять раз меньше энергии обычной ковалентной связи, но тем не менее водородные связи играют большую роль во многих физико-химических и биологических процессах. В частности, молекулы ДНК представляют собой двойные спирали, в которых две цепи нуклеотидов связаны между собой водородными связями.
Одним из признаков этого вида химической связи может служить расстояние между атомом водорода и другим атомом, ее образующим. Оно должно быть меньше, чем сумма радиусов этих атомов. Чаще встречаются несимметричные водородные связи, в которых расстояние Н... В больше, чем А-В. Однако в редких случаях (фтороводород, некоторые карбоновые кислоты) водородная связь является симметричной. Наиболее сильные водородные связи образуются с участием атомов фтора. В симметричном ионе [F-H-F]- энергия водородной связи равна 155 кДж/моль и сопоставима с энергией другого вида связи - ковалентной связью. Энергия водородная связи между молекулами воды уже заметно меньше (25 кДж/моль). Донорно-акцепторный механизм (иначе координационный механизм) — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора. Термины «донорно-акцепторная связь» или «координационная связь» некорректны, поскольку это не есть вид химической связи, а лишь теоретическая модель, описывающая особенность её образования. Свойства ковалентной химической связи, образованной по донорно-акцепторному механизму, ничем не отличаются от свойств связей, образованных по обменному механизму (например, связи N—H в ионе аммония NH4+ или связи O—H в ионе гидроксония Н3O+).
Образование аддукта аммиака итрифторида бора Донорами обычно выступают атомы азота, кислорода, фосфора, серы и др., имеющие неподелённые электронные пары на валентных орбиталях малого размера. Роль акцептора могут выполнять ионизированный атом водорода H+, некоторые p-металлы(напр., алюминий при образовании иона AlH4-) и, в особенности, d-элементы, имеющие незаполненные энергетические ячейки в валентном электронном слое.
Именно с позиций донорно-акцепторного механизма описывается образование локализованных ковалентных связей в молекулах и молекулярных ионах комплексных (координационных) соединений: связь формируется за счёт неподелённой пары электроновлиганда и свободной орбитали атома-комплексообразователя. Донорно-акцепторный механизм также описывает образование промежуточных продуктов (интермедиатов) реакции, например, комплексов с переносом заряда. Модель донорно-акцепторного механизма существует только в рамках представлений о валентности как о локализацииэлектронной плотности при образовании ковалентных связей (метод валентных схем). В рамках метода молекулярных орбиталей необходимости в подобных представлениях нет. 2. Алкины. Общая формула и химическое строение гомологов данного класса. Ацетилен — представитель углеводородов с тройной связью в молекуле. Свойства, получение и применение ацетилена.
Алкины – это углеводороды, в молекулах которых два атома углерода находятся в состоянии sp-гибридизации и связаны друг с другом тройной связью. Общая формула: CnH2n–2, где n > 2. Особенности алкинов: 1) длина связи в алкинах равна 0,120 нм; 2) каждый атом углерода в состоянии sp-гибридизации связан с двумя другими атомами; 3) может присоединять еще два атома. Существует два типа изомерии алкинов: 1) изомерия положения тройной связи; 2) изомерия цепи. Первые два члена гомологического ряда – этин и пропин – изомеров не имеют. Для бутинов возможен только один вид изомерии – изомерия положения тройной связи. Существует два типа номенклатуры: 1) международная номенклатура: этин; пропин; 2) рациональная номенклатура: ацетилен; метиацетилен. Физические свойства алкинов: 1) С2Н2…С4Н6 – газы; 2) С5Н8…С15Н28 – жидкости; 3) С16Н30… – твердые вещества; 4) плохо растворимы в воде. Химические свойства алкинов: обладают большой реакционной способностью, характеризуются реакцией присоединения, тройная связь содержит две π-связи. Реакции присоединения: 1) присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени – алканы.
2) присоединение галогенов (галогенирование). HC≡CH + HCl → CH2=CHCl → CH3-CHCl2; На I ступени образуются дигалогеналкены, на II – тетрагалогеналканы. Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается; 3) присоединение галогеноводородов (гидрогалогенирование). На I ступени образуются моногалогеналкены, на II – дигалогеналканы; 4) присоединение воды (гидратация). Ацетилен образует альдегид, его гомологи – кетоны (реакция М.Г. Кучерова):
Реакция окисления: 1) горение (полное окисление): 2С2Н2 + 5O2 → 4СO2 + 2Н2О; 2) неполное окисление (под действием окислителя типа КМnO4, К2Сr2О7). При действии сильных окислителей (КМnO4 в нейтральной среде, К2Сr2О7 в кислотной среде) алкины окисляются с разрывом молекулы по тройной связи (кроме ацетилена). Конечным продуктом реакции являются карбоновые кислоты: СН3-С≡С-СН3 + 3[О] + Н2О → 2СН3-СООН – этановая (уксусная) кислота. При неполном окислении ацетилена образуется двухосновная щавелевая кислота: СН≡Н + 4[О] → НООС-СООН.
Билет№5 Билет №6 1. Классификация химических реакций в органической химии.
2. Ароматические углеводороды. Бензол, структурная формула, свойства и получение. Применение бензола и его гомологов.
3.Провести реакцию, характеризующие свойства кислот на примере серной.
Билет №7 1. Реакции ионного обмена. Условия их необратимости.
2. Изомерия органических соединений и ее виды.
Билет №10 1. Неметаллы, их положение в периодической системе химических элементов Д. И. Менделеева, строение их атомов. Окислительно-восстановительные свойства неметаллов на примере элементов подгруппы кислорода.
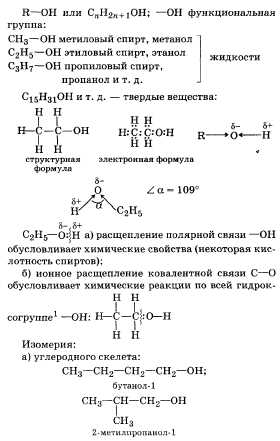
2. Предельные одноатомные спирты. Химическое строение гомологов данного класса. Свойства и применение этилового спирта. Экологическое и практическое значение. 3.Сколко грамм вещества содержится в 300г 5% раствора хлорида алюминия?
Билет №11 1. Аллотропия неорганических веществ на примере углерода и кислорода.
2. Фенол, его химическое строение, свойства, получение и применение.
3.Какова молекулярная формула углеводорода, содержащего 82,5% углерода и 17,5% водорода? Плотность по водороду паров этого вещества равна 29.
Билет №12
Степень окисления - это условный заряд атома в молекуле вычисленный согласно предположению, о том что молекула состоит только из ионов. Процесс отдачи электронов атомом, молекулой или ионом называется окислением: Э – nē → Э+n Э – восстановитель. Процесс присоединения электронов атомом, молекулой или ионом называется восстановлением: Э + nē → Э-n Э – окислитель. Атомы, ионы, молекулы, отдающие электроны – восстановители (сами окисляются). Атомы, ионы, молекулы, принимающие электроны – окислители (сами восстанавливаются). Окисление всегда сопряжено с восстановлением. Число электронов, участвующих в процессе окисления равно числу электронов, участвующих в процессе восстановления. ОКИСЛИТЕЛИ Атомы и молекулы элементов VI – VII групп (S, О2, Сl2) Ионы металлов в высоких степенях окисления (Fe3+, Cu2+) Ионы, молекулы, содержащие атомы металлов в высоких степенях окисления (KMn+7O4, K2Cr2+6O7) Ионы, молекулы, содержащие атомы неметаллов в высоких степенях окисления (HN+5O3, H2S+6O4, KCl+5O3) ВОССТАНОВИТЕЛИ Атомы всех металлов.
Отрицательно заряженные ионы неметаллов (S2-, Cl-, Br-) Ионы металлов в низких степенях окисления (Fe2+, Mn2+) Ионы и молекулы, содержащие атомы в промежуточных степенях окисления (S+4O32-) H2, CO 2. Альдегиды, их химическое строение гомологов и свойства. Получение, применение муравьиного и уксусного альдегидов.
Ответы по химии для 11 класса
1. Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
2. Предельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применение метана. Экологическое значение алканов.
Общая формула CnH2n+2
3. Задача. Вычислить массу вещества, полеченного при пропускании 40г брома рез этилен.
Билет №2 1. Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы.
2. Непредельные углеводороды ряда этилена, общая формула и химическое строение. Свойства и применение этилена. Экологическое значение этилена.
Какой объем углекислого газа образуется при спиртовом брожении глюкозы массой 270г?
Билет №3 1. Виды химической связи: металлическая, ковалентная (полярная и неполярная).
2.Диеновые углеводороды, их химическое строение, свойства, получение и практическое значение.
|
||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 756; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.233.41 (0.066 с.) |