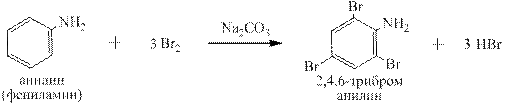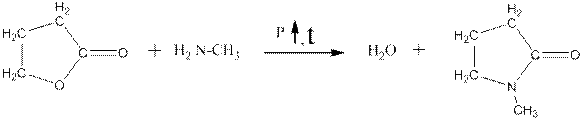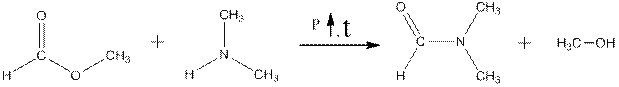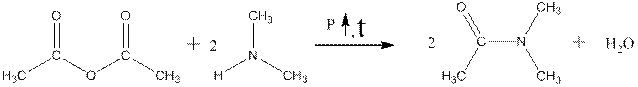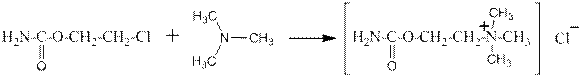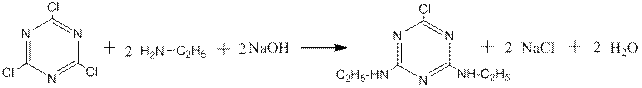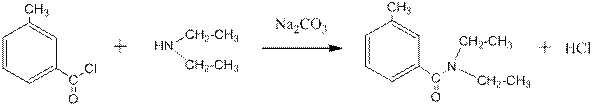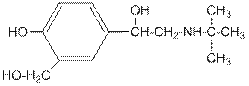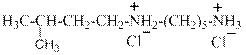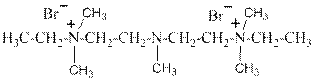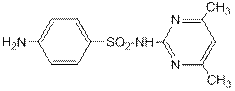Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физические свойства ароматических аминов. ⇐ ПредыдущаяСтр 2 из 2
Ароматические амины – бесцветные вещества, поглощающие свет в ближней УФ части спектра. Обычно в спектрах ароматических аминов наблюдается интенсивное поглощение в районе 250 – 290 нм и не интенсивное в области 340 – 350 нм Среди ароматических аминов нет газов. Все они при нормальных условиях и при комнатной температуре либо твёрдые вещества, либо высококипящие жидкости. Амины бензольного ряда чаще жидкие, а нафталинового ряда всегда - твёрдые. Представление об агрегатном состоянии ароматических аминов и их растворимости дают числовые значения и символы в приведённой ниже таблице.
Растворимость анилина в нефти является тестом на её качество. С нефтью, в которой много алканов и мало ароматических углеводородов, анилин не смешивается до температуры 70оС и выше. С нефтью, в которой много циклоалканов (нафтенов) анилин даёт гомогенный раствор уже при 40 – 50оС, а если в нефти много ароматических углеводородов, что делает её наиболее ценной, то анилин смешивается с ней уже при комнатной температуре.
Запах: запах у ароматических аминов специфический. Некоторые люди считают его дегтярным. Пахнут все производные анилина примерно одинаково, неприятно и спирают дыхание.
Химические свойства аминов.
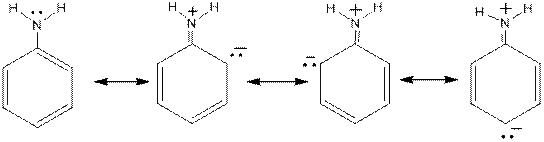
У любого амина на атоме азота есть неподеленная пара электронов. При попадании амина в воду протоны от воды могут по донорно-акцепторному механизму образовывать новую ковалентную полярную связь с атомом азота, давая при этом ион алкил- или ариламмония. Вода, потерявшая протон, превращается в гидроксид-ион. Среда становится щелочной. Таким образом амины являются основаниями. Сила этих оснований зависит от природы и количества радикалов, связанных с азотом. Алифатические радикалы, такие как метил, этил и т.п.,проявляя свои элекронодонорные свойства, увеличивают основность аминов. Ароматические радикалы за счёт делокализации пары электронов по бензольному кольцу, наоборот, очень сильно основность уменьшают. В рамках теории резонанса Лайнуса Полинга это выглядит следующим образом:
Как видно, неподелённая пара электронов присутствует на атоме азота только в одной из резонансных структур (мезомерных форм). В трёх других биполярных структурах на атоме азота, наоборот, находится «+» - заряд, который естественно препятствует протонированию. Это и является причиной резкого снижения основности. Наличие в о- и п- положениях отрицательных зарядов позволяет высказать предположение о лёгкости протекания именно в эти положения реакций электрофильного замещения, где атакующей частицей является катион (например,
Количественно сила оснований характеризуется величинами Кb или их отрицательными логарифмами рКb. Индекс «b» означает, что речь идёт о константе равновесия между основанием – base, которым является амин и его сопряжённой кислотой, то есть аммониевым ионом:
По определению такая обратимая реакция описывается аналитическим выражением:
Так как концентрация воды в разбавленных водных растворах величина практически постоянная и равна 55,5 моль / л, то её вносят в «новую» константу равновесия:
Домножив числитель и знаменатель правой части уравнения на [Н+] и учитывая, что [Н+] [ОН-] = Кw = 10-14 получим:
Логарифмируя это аналитическое выражение с использованием десятичных логарифмов,
придём к уравнению:
Меняя знаки на противоположные и вводя общепринятое обозначение: - lg = p, получим:
Так как логарифм единицы по любому основанию равен нулю, а 14 – рН = рОН, то очевидно, что рКb соответствует тому значению концентрации гидроксильных ионов, при котором половина катионов аммония перейдёт с отщеплением протона в свободный амин. Величина рКb для оснований имеет то же значение, что величина рКа для кислот. Ниже приведена таблица, данные которой показывают влияние природы радикалов и их количества на величины констант основности различных аминов.
Данные таблицы позволяют сделать следующие выводы: 1) Алифатические амины гораздо более сильные основания, чем ароматические (примерно в 100000 – 1000000 раз) 2) Гетероароматические амины по своей основности близки к ароматическим. 3) На основность ароматических аминов оказывают сильное влияние заместители, находящиеся в пара - положении к аминогруппе. Электронодонорные заместители увеличивают основность амина, а электроноакцепторные её резко понижают. Отношение основностей ароматических аминов, содержащих метильную и нитрогруппы в указанном положении примерно 10000: 1. 4) Вторичные алифатические амины немного основнее первичных, а третичные имеют основность на том же уровне. 5) Характер радикала у первичных аминов не оказывает существенного влияния на основность амина. 6) Насыщенные гетероциклические амины имеют основность на уровне вторичных алифатических аминов. 7) Жирноароматические амины имеют основность на уровне ароматических аминов. 8) Вторичные ароматические амины имеют основность примерно в 10000 раз меньшую, чем первичные. 9) Электроотрицательные атомы, связанные в молекуле с атомом азота аминогруппы, понижают её основность в 10 (азот) и 1000 раз (кислород). 10) Атом кислорода, отделенный от аминогруппы двумя метиленовыми группами понижает её основность уже только в 67 раз.
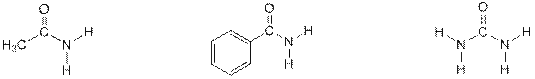
Следует отметить также, что основность амидов кислот за счёт электроноакцепторного влияния карбонильной группы очень низкая – ниже даже, чем у вторичных ароматических аминов: у ацетамида рКb = 13,52; у ацетанилида рКb = 13,60 и у мочевины рКb = 13,82
ацетамид ацетанилид мочевина
Как основания первичные, вторичные и третичные амины реагируют с кислотами:
пропиламин бромид пропиламмония
диметиламин сульфат диметиламмония
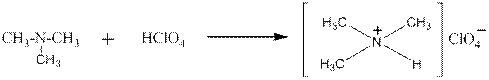
триметиламин перхлорат триметиламмония
С многоосновными кислотами могут образовываться не только средние, но и кислые соли:
диметиламин гидросульфат диметиламмония
метилизобутиламин дигидроортофосфат метилизобутиламмония
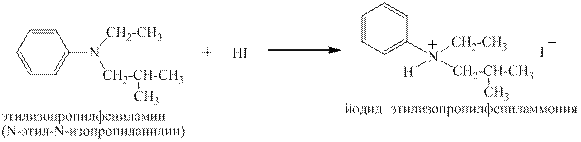
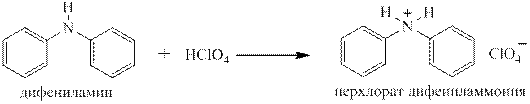
Первичные ароматические, а так же вторичные и третичные жирноароматические амины с разбавленными водными растворами сильных кислот тоже дают соли:
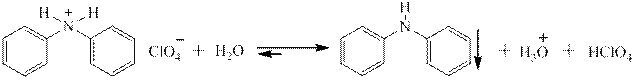
Вторичные ароматические амины так же способны образовывать соли под действием концентрированных сильных кислот, но при разбавлении водой эти соли гидролизуются, давая слабое основание, то есть исходный амин:
Третичные ароматические амины, как очень слабые основания, не дают солей ни с концентрированной соляной, ни с серной кислотами. Правда, трифениламин всё же даёт с хлорной кислотой перхлорат:
Взаимодействие аминов с нитритом натрия и соляной кислотой. Первичные алифатические амины реагируютв две стадии: на первой образуется крайне нестойкая в воде даже при охлаждении соль диазония, которая на второй стадии реагирует с водой с образованием спирта:
пропиламин хлорид пропилдиазония
пропанол-1 В реакции первичного амина с нитритом натрия и соляной кислотой происходит выделение газа (хорошо видны пузырьки) и рыбный запах амина изменяется на спиртовый – это качественная реакция на первичный алифатический амин. Если просуммировать две приведённые выше реакции, то получим:
Вторичные амины реагируют совершенно иначе: под действием нитрита натрия и соляной кислоты образуется N-нитрозамин - весьма стойкое даже при нагревании соединение:
метилэтиламин N-нитрозометилэтиамин
В реакции вторичного алифатического амина с нитритом натрия и соляной кислотой происходит образование желтого масла, плохо растворимого в воде и с крайне неприятным запахом – это качественная реакция на вторичный алифатический амин. Нитрозамины - канцерогены: вне зависимости от места и способа попадания в организм подопытного животного вызывают рак печени. Широко применяются в экспериментальной онкологии. Действуют резорптивно, то есть через кожу.
Третичные алифатические амины реагируют из смеси нитрита натрия и соляной кислоты только с кислотой:
Видимых эффектов в этой реакции нет. Запах ослабевает.
Первичные ароматические амины реагируют с нитритом натрия и соляной кислотой с образованием относительно стойкой при температурах от 0 до 5оС соли диазония. Эта реакция впервые опубликована в 1858 году в немецком химическом журнале Петером Гриссом и носит его имя:
В реакцию Грисса вступают многочисленные гомологи анилина, содержащие алкильные заместители в о-,м - и п -положении к аминогруппе:
Так же в неё вступают производные анилина, содержащие электроноацепторные, электронодонорные заместители и заместители особой группы, например:
С бромоводородной кислотой реакция проходит быстрее, но используется редко и только в лаборатории по причине дороговизны и дефицитности этой кислоты. На производстве соли диазония сразу же используют для проведения следующих стадий синтеза, но в лаборатории их часто выделяют по реакции обмена с насыщенным раствором тетрафторобората натрия:
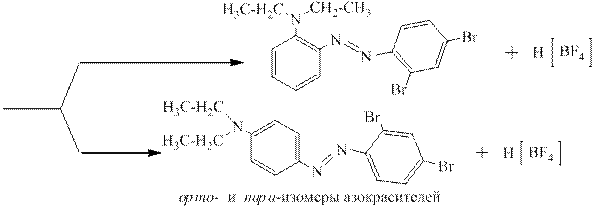
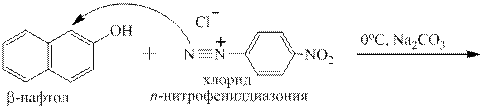
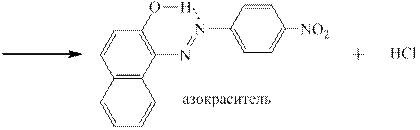
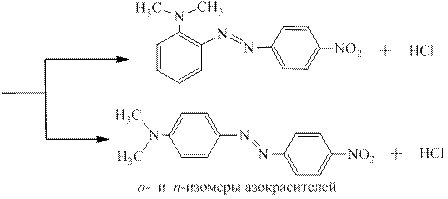
Соли диазония чаще всего используют для получения многочисленных азокрасителей по реакции азосочетания с фенолами (нафтолами) и ароматическими третичными аминами, например:
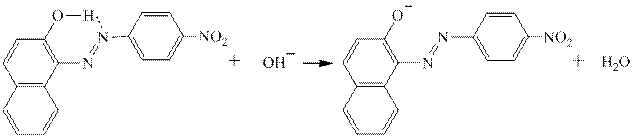
Получившийся азокраситель является рН-индикатором: в кислой среде за счёт образования водородной связи он имеет плоскую структуру, в которой электронодонорное влияние гидроксильной группы ослаблено – эта форма окрашена в жёлтый цвет. В щелочной от гидроксильной группы отрывается протон, возникает «фенолят-ион», являющийся сильнейшим ЭД-заместителем, и окраска меняется на красно-оранжевую:
Роль соды в ходе реакции азосочетания – связывание образующейся соляной (или другой сильной) кислоты в кислую соль – гидрокарбонат натрия:
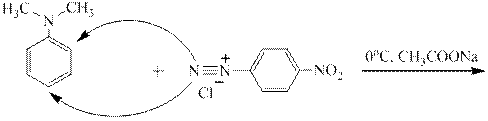
Смесь карбоната и гидрокарбоната натрия является буферным раствором, создающим слабо-щелочную среду. С третичными ароматическими аминами азосочетание должно проходить в слабо кислой среде, что обеспечивается добавкой солей, гидролизующихся по аниону, например, ацетата натрия. В сильно кислой среде амин даёт соль аммония, катион которой с катионом диазония естественно не реагирует.
Ацетат натрия мгновенно реагирует с образующейся соляной кислотой. В результате образуется буферный раствор, состоящий из слабой уксусной кислоты и избыточного ацетата натрия. Он обеспечивает слабокислую среду:
Вторичные ароматические амины реагируют с нитритом натрия и соляной кислотой с образованием N-нитрозаминов. Например, N-метиланилин даёт N-нитрозо-N-метиланилин – жёлтое масло с крайне неприятным запахом, отвердевающее при 13ОС:
Ароматические N-нитрозоамины как и алифатические – канцерогены. Так же вызывают рак печени, так же применяются в экспериментальной онкологии.
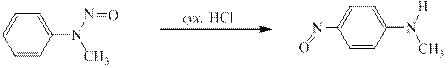
Ароматические N-нитрозоамины под действием сухих хлоро- или бромоводородов или под действием концентрированной серной кислоты претерпевают перегруппировку впервые опубликованную в 1886 году в немецком химическом журнале О.Фишером и Е.Хеппом. В указанных условиях нитрозогруппа селективно переносится в п -положение:
Полученный в результате перегруппировки 4-нитрозо-N-метиланилин обладает совершенно иными физическими свойствами и биологической активностью. Это зелёное твёрдое вещество с температурой плавления 113ОС. В растворах в органических растворителях флюоресцирует. Канцерогеном не является, правда, вызывает дерматиты. Третичные ароматические амины реагируют с нитритом натрия и соляной кислотой, давая С-нитрозосоединения. Нитрозогруппа селективно направляется в п -положение:
С-нитрозосоединения легко восстанавливаются водородом на никеле Ренея. При этом получаются несимметричные диалкилдиамины, например:
Соли алифатических и ароматических аминов могут быть легко переведены обратно в амины действием щелочей, например:
перхлорат пропиламмония пропиламин
гидросульфат метилпропиламмония метилпропиламин
Четвертичные аммониевые основания, наоборот, могут быть переведены в четвертичные аммониевые соли действием кислот:
Как видно это обычная реакция нейтрализации щёлочи кислотой – получаются соль и вода.
На стр.19 данного пособия было высказано предположение о лёгкости протекания в ароматических аминах реакций электрофильного замещения в орто - и пара -положения бензольного ядра. Действительно анилин легко бромируется сразу во все эти положения:
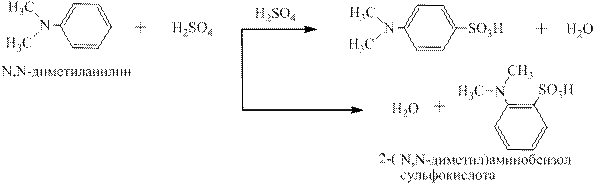
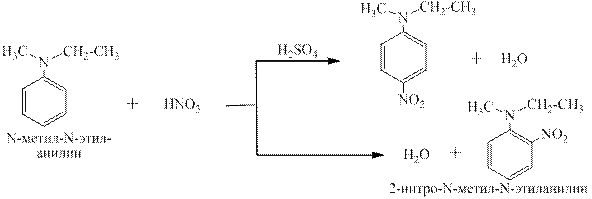
N,N-диалкиланилины сульфируются, нитруются, и диазотируются в орто - и пара -положения:
Ацетатом натрия сильная комплексная кислота переводится в слабую – уксусную:
Применение аминов Простейший первичный амин – метиламин применяется в синтезах инсектицидов, фунгицидов, ускорителей вулканизации, поверхностно-активных веществ (ПАВ), лекарственных средств, красителей, ракетных топлив, растворителей. Например, N-метил-2-пирролидон – популярный растворитель для лаков и некоторых красителей получают взаимодействием метиламина с γ-бутиролактоном (циклическим сложным эфиром 4-оксибутановой кислоты):
γ-бутиролатон N-метил-2-пирролидон
Простейший вторичный амин – диметиламин применяется в синтезах инсектицидов, гербицидов, ускорителей вулканизации, поверхностно-активных веществ (ПАВ), многих лекарственных средств, красителей и таких важных растворителей как диметилфориамид (ДМФА), диметилацетамид (ДМАА) и гексаметилфосфотриамид (ГМФТА) или гексаметапол. ДМФА в промышленности получают, например, путём взаимодействия диметиламина с метиловым эфиром муравьиной кислоты:
метилформиат диметиламин ДМФА метанол
ДМАА в промышленности получают путём взаимодействия диметиламина с уксусным ангидридом:
уксусный ангидрид ДМАА
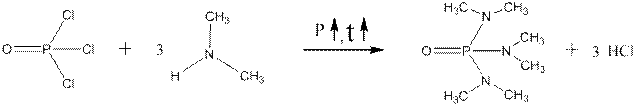
Промышленный синтез гексаметапола заключается во взаимодействии диметиламина с хлорокисью фосфора:
оксидтрихлорид фосфора ГМФТА
Простейший третичный амин – триметиламин применяется в синтезах четвертичных аммониевых оснований, флотоагентов, ретардантов, кормовых добавок. Например, последняя стадия синтеза карбахолина – лекарственного препарата, применяющегося при лечении глаукомы и послеоперационной атонии кишечника или мочевого пузыря, заключается во взаимодействии триметиламина с карбамоильным производным этиленхлоргидрина:
карбахолин
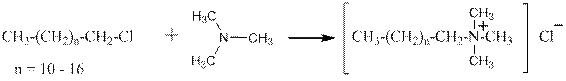
Катионные ПАВ получаются аналогично:
хлорид триметилалкиламмония
Этиламин применяется в производстве красителей, ПАВ, гербицидов. Например, симазин – гербицид для защиты от сорняков кукурузы и овощей получается взаимодействием этиламина с расчётным количеством хлорцианура в щелочной среде:
хлорцианур симазин
Диэтиламин применяется в производстве красителей, пестицидов, ускорителей вулканизации каучуков, ингибиторов коррозии, лекарственных препаратов, репеллентов. Например, широко известное средство от комаров – ДЭТА получают по реакции:
хлорангидрид м -толуиловой кислоты N,N-диэтил- м -толуамид
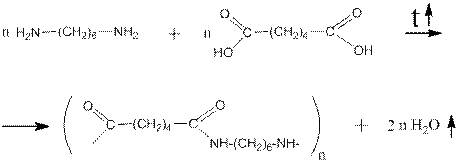
Изопропиламин, бутиламин, изобутиламин, втор -бутиамин и трет- бутиламины применяются в аналогичных производствах. 1,6-гександиамин широко применяетсядля синтеза нейлона путём реакции поликонденсации с 1,4-бутандикарбоновой (адипиновой) кислотой:
Среди лекарственных препаратов очень многие содержат аминогруппы различных видов. Так, например, из 1308 препаратов, приведённых в справочнике М.Д. Машковского, не менее 70 являются первичными аминами, не менее 52 вторичными и не менее 108 третичными. Кроме того среди лекарств имеется 41 четвертичная аммониевая соль и более 70 амидов карбоновых кислот, 26 амидов арилсульфокислот и 12 амидов производных ортофосфорной кислоты. Есть также циклические амиды – лактамы. Их 5 наименований. Производных природных аминокислот – 14 наименований. Ниже приведены примеры лекарственных препаратов, содержащих перечисленные функциональные группы:
Анестезин – этиловый эфир п -аминобензойной кислоты. Является первичным ароматическим амином и сложным эфиром одновременно.
Оказывает местноанестезирующее действие. Применяется для обезболивания раневых и язвенных поверхностей, при рвоте беременных, морской и воздушной болезнях.
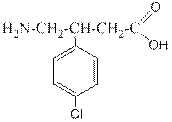
Баклофен – 4-амино-3-(п -хлор)фенилбутановая кислота. Является первичным алифатическим амином, сложным эфиром и галогенпроизводным бензольного ряда одновременно.
Уменьшает мышечное напряжение, оказывает анальгезирующее действие. Применяется при рассеянном склерозе.
Салбутамол – 2- трет -бутиламино-1-(4'-окси-3'-оксиметил)фенилэтанол. Является вторичным алифатическим амином, вторичным и первичным спиртами и фенолом одновременно.
Оказывает бронхорасширяющее действие и препятствует преждевременным схваткам у беременных женщин. Применяется при бронхиальной астме и в акушерской практике.
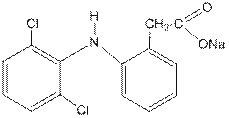
Ортофен – натровая соль 2-(2',6'-дихлор)фениламинофенилуксусной кислоты. Является вторичным ароматическим амином, солью карбоновой кислоты и галогенпроизводым бензольного ряда одновременно.
Оказывает противовоспалительное, анальгезирующее и жаропонижающее действие. Применяется при остром ревматизме, ревматоидном артрите, болезни Бехтерева, артрозах, спондилоартрозах.
Изоверин – дигидрохлорид N-изоамил-1,5-пентандиамина. Является диаммонийной солью первичного и вторичного аминов одновременно.
Понижает артериальное давление, повышает тонус и усиливает сокращения мускулатуры матки. Применяется в качестве родоускоряющего средства и для стимулирования сокращения матки в послеродовом периоде.
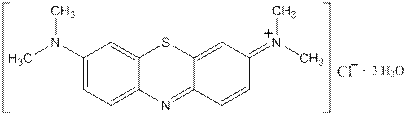
Метиленовый синий – хлорид N,N,N’,N’-тетраметилтионина. Является одновременно и третичным жирно-ароматическим амином и аммонийной солью такого же амина. Кроме того содержит гетероароматический цикл с «пиридиновым» атомом азота.
Применяют наружно в качестве антисептического средства при ожогах, пиодермии и фолликулитах. При циститах и уретритах промывают полости 0,02% раствором синего цвета.
Пентамин – дибромид 3-метил-1,5-бис-(N,N-диметил-N-этил)аммоний-3-азапентана. Является одновременно и третичным алифатическим амином и дважды четвертичной аммониевой солью таких же аминов.
Обладает ганглиоблокирующей активностью. Применяют при гипертонических кризах, спазмах периферических сосудов, спазмах кишечника и желчевыводящих путей, почечной колике, для купирования острых приступов бронхиальной астмы, при отёках лёгких и мозга.
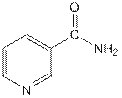
Никотинамид – амид 3-пиридинкарбоновой кислоты. Является амидом карбоновой кислоты и производным азотсодержащего гетероароматического цикла – пиридина.
Обладает противопеллагрическими свойствами, улучшает углеводный обмен, действует положительно при лёгких формах диабета, заболеваниях печени, сердца, при язвенной болезни желудка и двенадцатиперстной кишки. Применяют при гастритах с пониженной кислотностью, острых и хронических гепатитах, циррозах, при спазмах сосудов конечностей, почек и головного мозга.
Сульфадимезин – 2-(п- аминобензолсульфамидо)-4,6-диметилпиримидин. Представитель многочисленной группы сульфаниламидных препаратов. Является одновременно сульфаниламидом, первичным ароматическим амином и производным азотсодержащего гетероароматического цикла – пиримидина.
Как и все препараты этой группы сульфадимезин является активным противомикробным средством. Его применяют при пневмококковых, стрептококковых, менингококковых инфекциях, при сепсисе, гонорее, а также при инфекциях, вызванных кишечной палочкой и другими микробами.
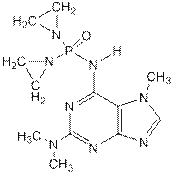
Фопурин – 6-диэтиленамидофосфамидо-2-диметиламино-7-метилпурин. Является одновременно трижды фосфамидом, третичным ароматическим амином и производным азотсодержащего гетероароматического бицикла – пурина .
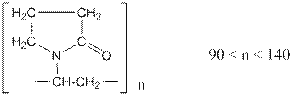
Гемодез – 6% водно-солевой раствор низкомолекулярного поливинилпирролидона. Элементарное звено полимера содержит лактамное кольцо.
Связывает токсины, циркулирующие в крови, и быстро выводит их через почечный барьер. Применяют при дизентерии, диспепсии, сальмонеллёзе, при ожоговой болезни в фазе интоксикации.
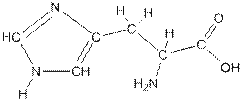
Гистидин – L-β-имидазолилаланин или L-α-амино-β-(4-имидазолил)пропионовая кислота. Является α-аминокислотой и производным азотсодержащего гетероароматического цикла – имидазола
. Гистидин – незаменимая аминокислота; содержится в разных органах, входит в состав карнозина – азотистого экстрактивного вещества мышц. В организме подвергается декарбоксилированию с образованием гистамина – одного из химических факторов (медиаторов), участвующих в регуляции жизненных функций.
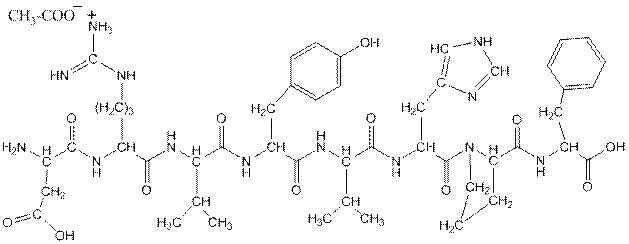
Ангиотензинамид – ацетат L-аспарагинил-L-аргинил-L-валил-L-тирозинил-L-валил- L - гистидинил – L – пролил - L- фенилаланина. Представляет собой уксуснокислую соль октапептида, состоящего из природных α-аминокислот.
При шоковых состояниях применяется для быстрого и сильного сужения сосудов внутренних органов, кожных покровов, почек. Ангиотензинамид обладает также способностью сокращать гладкую мускулатуру матки, кишечника, мочевого и желчного пузыря. Он стимулирует выделение адреналина из надпочечников и продукцию альдостерона.
Содержание
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 1561; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.94.251 (0.215 с.) |
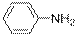
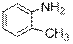
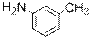

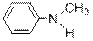
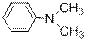
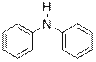
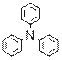
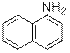
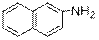
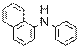
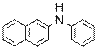
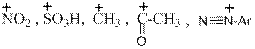 ) Ниже будут приведены примеры реакций этого типа с ароматическими аминами.
) Ниже будут приведены примеры реакций этого типа с ароматическими аминами.
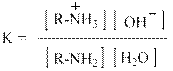
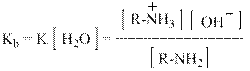
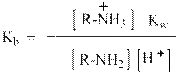
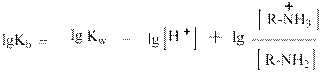
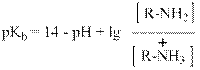
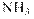
 10-5
10-5
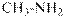
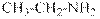
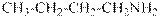
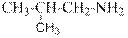
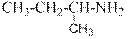
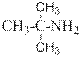
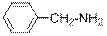
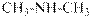
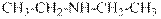
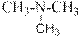
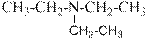
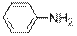


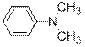
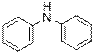
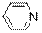
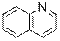
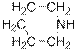
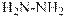
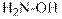
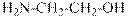





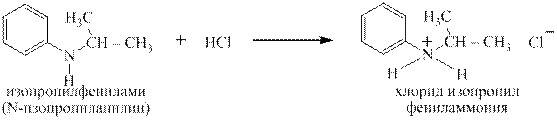
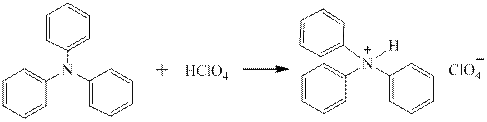
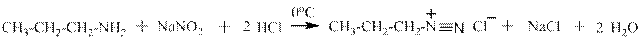
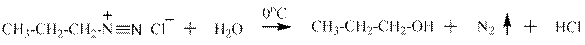
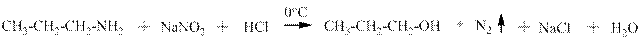
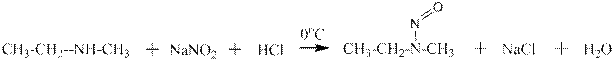
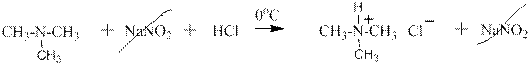
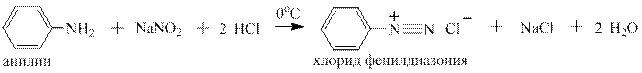
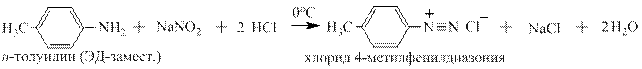
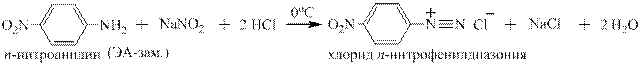
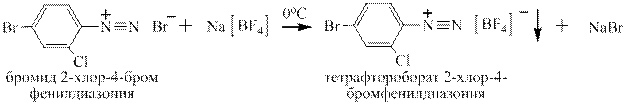


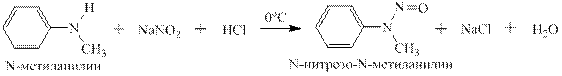
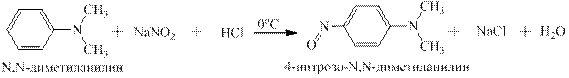
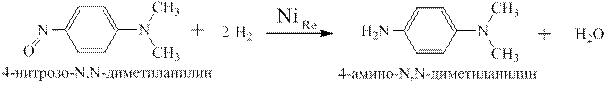
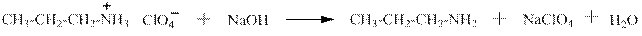
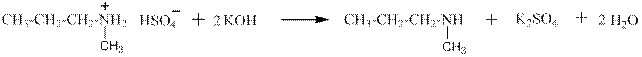
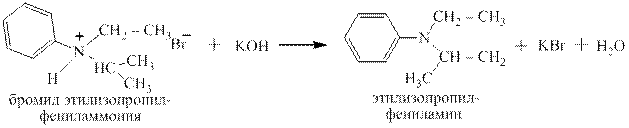
 гидроксид диметилэтилизопропиламмония хлорид диметилэтилизопропиламмония
гидроксид диметилэтилизопропиламмония хлорид диметилэтилизопропиламмония