
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Упражнение 4. Расчет термического коэффициента давления и объема ⇐ ПредыдущаяСтр 4 из 4
1. Рассчитайте теоретическое значение термического коэффициента объемного расширения по формуле (8). 2. Рассчитайте объем воздуха Vo, соответствующий температуре 0оС по формуле (26). 3. Рассчитайте термический коэффициент объемного расширения по формуле (29), используя рассчитанное значение tgb для графика зависимости V(Т). Сравните полученный результат с теоретическим значением. 4. По графику зависимости р(Т) экстраполяцией в область значений Т = 273 К найдите значение ро. 5. Рассчитайте термический коэффициент давления по формуле (33), используя рассчитанное значение tgj для графика зависимости р(Т). Сравните полученный результат с теоретическим значением. Приложение Уравнение, которое связывает макроскопические параметры состояния для идеального газа, называют уравнением Менделеева – Клапейрона. Оно имеет вид
Сжимаемость идеального газа. Изотермический коэффициент сжимаемости. Свойство газа, как и всякого другого тела, изменять давление при изменении объема называется сжимаемостью. Если изменение объема происходит так, что температура газа при этом не меняется, то сжимаемость характеризуется изотермическим коэффициентом сжимаемости c, который определяется как относительноеизменение объема, вызывающее изменение давления на единицу. Очевидно, что
где dV – изменение объема газа, вызывающее изменение давления на величину dp; V– первоначальный объем (относительным изменением какой-либо величины и называется отношение изменения этой величины к ее первоначальному значению). Индекс Ту производной показывает, что она берется при Т = const. Для идеального газа легко вычислить значение c. Продифференцировав уравнения состояния (1), и учтя, что
Подставив (3) в (2), получим, что для идеального газа
Знак минус в выражении (4) указывает на то, что увеличение объема приводит к уменьшениюдавления. Изотермический коэффициент сжимаемости идеального газа равен, таким образом, обратной величине его давления и измеряется в системе СИ в единицах м2/Н. С ростом давления величина c уменьшается, так как чем больше давление, тем меньше у газа возможностей для того, чтобы еще больше сжиматься. Изобарный коэффициент расширения. Изобарный коэффициент расширения a рможет быть представлен в виде, аналогичном коэффициенту сжимаемости:
Он представляет собой относительное изменение объема при изменении температуры на 1 К при изобарическом процессе. Продифференцировав (1) при условии, что р = const, m = const, получим
Подставив (6) в (5), получим
То есть коэффициент объемного расширения идеального газа при постоянном давлении равен обратной величине абсолютной температуры. При 0°С, например, он равен 1/273 К-1. Изохорный коэффициент давления Изохорный коэффициент давления aV определяют как
Он представляет собой относительное изменение давления при изменении температуры на 1 К при изохорическом процессе. Продифференцировав (1) при условии, что V = const, m = const, получим
Подставив (9) в (8), получим
Выражение (10) совпадает с полученным ранее выражением (7) для коэффициента объемного расширения идеального газа при постоянном давлении. То есть для идеального газа (и для всех разреженных газов) aр = aVи не зависят от рода газа. С точки зрения молекулярно-кинетической теории одинаковые значения термических коэффициентов для всех газов объясняются тем, что молекулы газа в среднем находятся на больших по сравнению с их размером расстояниях друг от друга. Особенности межмолекулярных сил для различных газов в этих условиях не сказываются. Список литературы 1. Матвеев А.Н. Молекулярная физика. – М. Высшая школа, 1981. 2. Кикоин А.К., Кикоин И.К. Молекулярная физика. – С.-Пб:Лань. 2008 – 484 с. 3. Иродов И.Е. Физика макросистем. – М.: Наука, 2004. 4. Гершензон Е.М., Малов Н.Н., Мансуров А.Н. Молекулярная физика. – М.: АСАDEMA, 2000. 5. Детлаф А.А., Яворский Б.М. Курс физики. – М.: Высшая школа, т. 2, 3. 1981. 6. Трофимова Т. И. Курс физики. – М.: Высшая школа, 1998. 7. Шебалин О.Б. Молекулярная физика. – М.: Высшая школа, 1978. 8. Физический энциклопедический словарь. – М.: Советская энциклопедия, 1983. Контрольные вопросы 1. Какой газ называется идеальным? 2. При каких условиях реальный газ можно считать идеальным? 3. Напишите уравнения состояния для идеального газа? 4. В чем заключается закон Бойля – Мариотта? 5. В чем заключается закон Гей-Люссака?
6. В чем заключается закон Шарля? 7. Каков физический смысл термического коэффициента давления? 8. Каков физический смысл термического коэффициента объемного расширения? 9. Выведите законы изопроцессов из уравнения состояния идеального газа. 10. Изобразите графики изопроцессов в координатах р(V), V(T), p(T). 11. Выведите формулы для расчета универсальной газовой постоянной, используемые в работе (25), (31), (35). 12. Выведите формулы (29), (33) для расчета термических коэффициентов, используемые в работе.
|
||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 565; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.121.160 (0.009 с.) |
 (1),
(1), (2)
(2) , получаем:
, получаем: (3)
(3) (4).
(4). (5).
(5). (6).
(6).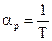 (7).
(7). (8).
(8). (9).
(9). (10).
(10).


