
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Объём паров после испарения жидкостиСтр 1 из 5Следующая ⇒
Содержание тяжелых углеводородов в газе. Объём паров после испарения жидкости
Принято считать, что в газе три тяжелые фракции: пропановая, бутановая и газовый бензин. Последний принимается состоящим по массе из 1/3 бутана и 2/3 пентана (плюс вышекипящие). Если дан массовый или молярный состав газа, то содержание тяжелых компонентов в г/м3 определяется по формуле Аi=10girсм= 10уiri, г/м3. (1.10) Здесь: g - содержание данного тяжелого углеводорода в газе, мас.%; rсм - средняя плотность 1.1. Основные параметры Газовые законы
· закон Авогадро - 1кмоль газа при нормальных условиях (р=760 мм рт. ст.; Т=00С) занимает объём 22.41м3; · закон Дальтона - аддитивности парциальных давлений pi р= å рi; (1.1) · закон Амаги - аддитивности парциальных объёмов vi v=å vi. (1.2) Определения: · аддитивным называется суммарное физическое свойство смеси, определяемое как сумма произведений молярных (объёмных) долевых концентраций компонентов в смеси на свойства этих компонентов; · парциальное давление компонента смеси pi - давление, которое он бы имел при удалении из объёма, занимаемого смесью, остальных компонент при неизменных величинах начального объёма и температуры; · парциальный объём компонента смеси vi- объём, который он бы имел при удалении из объёма, занимаемого смесью, остальных компонент при неизменных величинах начального давления и температуры.
Параметры газовых смесей
Плотность газа в нормальных условиях определяется по закону Авогадро r = М/22.41, кг/м3, (1.3) где М - молекулярная масса, М=G/m. Относительная плотность - плотность газа отнесённая к плотности воздуха rв при тех же значениях давления и температуры
При определении относительной плотности надо иметь в виду, что стандартными условиями в физике считаются 00С и 0,1013МПа, а коммерческие расчеты в газовой промышленности приводятся к условиям t=200С и p=0,1013МПа. Соответственно, плотность воздуха в первом случае rв0= 1,293кг/м3, а во втором - rв0= 1,205кг/м3. Плотность воздуха при требуемом давлении определяется по формуле rв = 1,1665р (1.4.1) Для сравнительной характеристики газа удобнее использовать относительную плотность при нормальных физических условиях D0=r0 / 1,293. (1.4.2) Состав природного газа характеризуется концентрациями (содержанием) компонент, которые подразделяются на:
· массовые gi=Gi /G; · молярные yi=mi /m; · объёмные xi=vi /v. Здесь: i - номер компоненты; G,m,v - масса, число молей и объём; величины без индексов относятся к смеси. При известных молекулярных массах компонент Мi и смеси М можно осуществить переход от объёмных концентраций к массовым и наоборот: gi=xi Mi /M. (1.5) При этом по закону Авогадро yi=xi. При известных концентрациях и параметрах компонент средние характеристики смеси определяются следующим образом: · давление р=pi /xi (1.6) · объём v=vi /xi (1.7) · молекулярная масса M= å (xi Мi)/100=100/ å (gi /Mi) (1.8) · плотность r =100/ å (gi / r i)=100M/ å (xi Mi)/ ri= å (xi r i) (1.9) В формулах (1.8, 1.9) концентрация дана в процентах.
природного газа, кг/м3; у - содержание данного тяжелого углеводорода в газе, мол.%; r - плотность данного тяжелого углеводорода, кг/м3. После определения содержания в газе отдельных компонентов пересчитывают содержание в нём n- бутана и газового бензина При этом считают, что в газовый бензин целиком переходит пентан плюс вышекипящие и часть нормального бутана, по величине равная половине содержания пентана плюс вышекипящие. Пропан бутановая фракция при повышенных давлениях находится в жидком состоянии и переходит в газообразное при понижении давления до атмосферного. Объём паров, получаемый после испарения жидкого углеводорода(при нормальных физических условиях р=0,1013МПа, Т=273 К), можно вычислить по формуле Vп=G / rп= 22,41 G / М, м3, (1.11) где М - молекулярная масса углеводорода, rп - плотность паров углеводорода при нормальных условиях; G - масса жидкого углеводорода, кг. Если имеется смесь жидких углеводородов, то объём паров подсчитывается по (1.11) с подстановкой средней молекулярной массы смеси испарившихся углеводородов.
Определение типа залежи По составу углеводородов
В зависимости от условия залегания и количественного соотношения нефти и газа залежи подразделяются на: а) газовые - нет тяжелых углеводородов (метан- 95-98%; относительная плотность D» 0.56; при понижении температуры выделения жидких углеводородов не происходит); б) газонефтяные - сухой газ + жидкий газ(пропан -бутановая смесь) + газовый бензин С5+ (метан = 35-40%, этан = 20%, жидкий газ = 26-30%, газовый бензин = 5%, не углеводороды = 8-13%, D» 1.1);
в) газоконденсатные - сухой газ + конденсат(бензиновая, керосиновая, лигроиновая и иногда масляная фракции) (метан =75-90%, этан = 5-9%, жидкий газ = 2-5%, газовый бензин = 2-6%, не углеводороды = 1-6%, D» 0.7-0.9). г) газогидратные - газ в твердом состоянии.
Метод Коротаева, Карпова
Метод Коротаева Ю.П. и Карповам А.К. - тип залежи определяется по соотношению в газе изобутана к нормальному бутану: а)газовые - i-С4Н10 / n-C4H10 =g>1; б)газоконденсатно-нефтяные, газонефтяные и попутный газ - g =0.5-0.8; в)газоконденсатные - g =0.9-1.1. Единицы измерения
Пример расчета
По данному массовому составу газа, величине пластового давления pпл определить: * -содержание в нем пропана, бутана и газового бензина; * - параметры смеси; * - критические и парциальные параметры; * -вид залежи.
Решение
1. Определяем среднюю молекулярную массу газа по (1.8)
2. Находим плотность газа при нормальных условиях по (1.3) rсм=32,15/22,41=1,43 кг/м3
3. Находим содержание тяжёлых углеводородов в газе по (1.10) в г/м3 * пропана..............................10 . 37,95.1,43=542,0; * i - бутана.............................10 . 3,25.1,43= 46,5; * n -бутана.............................10 . 12,05.1,43=172,0; * пентана и высших...............10 . 8,15.1,43=117,0; __________________________________________________________ Всего..............................................................877,5 г/м3
Т.о., газового бензина (пентан целиком) и n-бутана (по величине, равной половине пентана) в составе газа будет 117+117/2=175,5 г/м3;
* пропана.............................. 542,0 г/м3; * i - бутана............................. 46,5 г/м3; * n -бутана............................. 172-58,5=113,5 г/м3.
Всего тяжелых углеводородов 877,5 г/м3.
5. Находим относительную плотность газа по (1.4.2) D0=1,43/1,293=1,106.
6. Определяем объёмные концентрации yi компонент по (1.5), парциальные давления pi по(1.6):
7. Определим тип залежи: а) Имеем - D=1,106; метана-39,09%; жидкого газа (пропан-бутановая фракция) -»31%, газ. Бензина» 8%. Т.о. по разделу (3.1) месторождение можно считать газонефтяным. в) по Коратаеву - g=0,27. Газ можно отнести к газонефтяному.
8. Найдем объём паров после испарения 702 кг пропан -бутановой фракции, в которой содержится: пропана - 542 кг, бутана - 160кг.
Находим процентное содержание пропана и бутана в данной фракции:
пропан - g = 542.100 / 702=77,2%; бутан - g= 100-77,2= 22,8%.
Определим среднюю молекулярную массу смеси
Объём паров (11) Vп= 22,41.702 / 46,72=336,7 м3.
9. Найдём критические и приведенные параметры смеси:
Т.к. объёмное содержание высококипящих и неуглеводородных компонент больше 10%, то для расчета критических параметров используем зависимости (1.12.1) К= 128.46; К2= 16502,85; J=106,79; J2=11404,1041; ркр=1,45 МПа; Ткр=154,5 К. Рассчитаем критические параметры по (12): ркр=4,3 МПа; Ткр=266,5 К. Рассчитаем критические параметры по (14.1): ркр=4,44 МПа; Ткр=262,3 К.
1.8. Проверочные задания По данному составу газа, величине пластового давления pплопределить: * -содержание в нем пропана, бутана и газового бензина; * - параметры смеси; * - критические и парциальные параметры; * -вид залежи. Вязкость
Для расчета динамической вязкости природных газов m следует использовать соотношения Тодоса, которые в зависимости от величины приведённой плотности rпр=r/rкр имеют вид: а) rпр> 2
b) 0,3<rпр£ 2
c) rпр£ 0,3
где Коэффициент динамической вязкости m0 при атмосферном давлении в зависимости от температуры рассчитывается по зависимостям: а) при Тпр³ 1,5
при Тпр< 1,5
В формулах (2), (3): ркр - 0,1МПа, m - мкПа×с, Т - оК. Для расчета вязкости в зависимости от температуры при атмосферном давлении можно использовать и следующие зависимости:
или
где t- 0С, h-м Па .с. Погрешность расчетов по формулам (3.3), (3.3..1) при 12 £ Мсм£100 и 283 £ Т£477 К не превышает 5%. Порядок расчета m:
При содержании азота в при родном газе более 5% следует учитывать его влияние на вязкость газа по правилу аддитивности:
где уа - молярная доля азота в составе смеси; mа, mу - коэффициенты динамической вязкости азота и углеводородной части, соответственно. Коэффициент динамической вязкости углеводородного конденсата при различных давлениях и температурах приближенно можно рассчитать по эмпирической формуле Муталибова, Шубина и Абдурахманова:
при 0,1 £ р£50,0 МПа и 30 £ t£200 0C.
Теплоёмкость
При изобарическом процессе зависимость молярной теплоёмкости углеводородных компонентов природных газов при атмосферном давлении и различной температуре приближенно можно выразить следующим уравнением
где t - температура, 0С; Mi - молекулярная масса углеводорода, являющегося компонентом природного газа (от метана до гексана включительно). Погрешность в интервале температур от -40 до +1200С: для СН4 - С5Н12 – не более5%, для С6Н14-С7Н16 – не превышает 10%. При изобарическом процессе молярная теплоёмкость неуглеводородных компонентов природных газов (азота, углекислого газа, сероводорода) равна примерно половине теплоёмкости углеводорода с одинаковой молекулярной массой при одной и той же температуре, которая рассчитывается по уравнению (7). Теплоёмкость смесей рассчитывается по правилу аддитивности
где yi - молярная доля i-го компонента в смеси; Ср,i - молярная теплоёмкость i-го компонента. Молярная теплоёмкость природных газов зависит от давления и температуры
где DСр(р,t) - изотермическая поправка теплоёмкости на давление. Поправка находится из графика по приведённым значениям давления и температуры или аналитически из уравнения состояния, на пример, Пенга-Робинсона
Здесь:
Для приближенных расчетов при 0,02 £ рпр £ 4 и 1,3 £ Тпр £ 2,5 поправку DСр(р,t) можно рассчитать с погрешностью, не превышающей 10% по формуле
При изобарическом процессе молярную теплоёмкость природного газа можно рассчитать и по формуле, предложенной Гухманом и Нагаревой
Для расчета температуры и мощности в процессах адиабатного расширения и сжатия природных газов необходимо строго математически определить значения температурного КТ и объёмного КV коэффициентов адиабаты. Последнее возможно при определении частных производных коэффициента сверхсжимаемости соотношениями (1.30) и подстановкой их в зависимости:
Коэффициент адиабаты природного газа находится по формуле
или используя аппроксимацию вычитаемого в знаменателе
Если в расчетах необходимо иметь не молярную, а массовую теплоёмкость, то следует значение молярной теплоёмкости разделить на молекулярную массу газа Мi, т.е на массу киломоля i-го компонента, кг/моль.
Теплопроводность газов Теплопроводность - физическое свойство вещества, определяющее скорость переноса теплоты и выражаемое уравнением Фурье
где dQ/dt - перенос теплоты посредством проводимости, Дж/с; l - коэффициент теплопроводности вещества (теплопроводность) Вт/(м К); А - площадь, перпендикулярная направлению потока тепла, м2; х - расстояние, м; Т - температура, К. Теплопроводность природной газовой смеси можно определить по приведённой плотности rпр=r/rкр из зависимостей Стила -Тодоса и Тиракьяна. Зависимости Стила-Тодоса: а) rпр> 2
b) 0,5<rпр£ 2
c) rпр£ 0,5
где Коэффициент теплопроводности l0 при атмосферном давлении имеет следующую зависимость от температуры
где
При Тпр=0,8 - 8,0
Зависимость Тиракьяна
где n- число атомов углерода в молекулах; для смеси n=åxini.
Табл. 1 Физико-термодинамические свойства компонент природного газа
Табл. 2 Единицы измерения
Содержание тяжелых углеводородов в газе. Объём паров после испарения жидкости
Принято считать, что в газе три тяжелые фракции: пропановая, бутановая и газовый бензин. Последний принимается состоящим по массе из 1/3 бутана и 2/3 пентана (плюс вышекипящие). Если дан массовый или молярный состав газа, то содержание тяжелых компонентов в г/м3 определяется по формуле Аi=10girсм= 10уiri, г/м3. (1.10) Здесь: g - содержание данного тяжелого углеводорода в газе, мас.%; rсм - средняя плотность 1.1. Основные параметры Газовые законы
· закон Авогадро - 1кмоль газа при нормальных условиях (р=760 мм рт. ст.; Т=00С) занимает объём 22.41м3; · закон Дальтона - аддитивности парциальных давлений pi р= å рi; (1.1) · закон Амаги - аддитивности парциальных объёмов vi v=å vi. (1.2) Определения: · аддитивным называется суммарное физическое свойство смеси, определяемое как сумма произведений молярных (объёмных) долевых концентраций компонентов в смеси на свойства этих компонентов; · парциальное давление компонента смеси pi - давление, которое он бы имел при удалении из объёма, занимаемого смесью, остальных компонент при неизменных величинах начального объёма и температуры; · парциальный объём компонента смеси vi- объём, который он бы имел при удалении из объёма, занимаемого смесью, остальных компонент при неизменных величинах начального давления и температуры.
Параметры газовых смесей
Плотность газа в нормальных условиях определяется по закону Авогадро r = М/22.41, кг/м3, (1.3) где М - молекулярная масса, М=G/m. Относительная плотность - плотность газа отнесённая к плотности воздуха rв при тех же значениях давления и температуры
При определении относительной плотности надо иметь в виду, что стандартными условиями в физике считаются 00С и 0,1013МПа, а коммерческие расчеты в газовой промышленности приводятся к условиям t=200С и p=0,1013МПа. Соответственно, плотность воздуха в первом случае rв0= 1,293кг/м3, а во втором - rв0= 1,205кг/м3. Плотность воздуха при требуемом давлении определяется по формуле rв = 1,1665р (1.4.1) Для сравнительной характеристики газа удобнее использовать относительную плотность при нормальных физических условиях D0=r0 / 1,293. (1.4.2) Состав природного газа характеризуется концентрациями (содержанием) компонент, которые подразделяются на: · массовые gi=Gi /G; · молярные yi=mi /m; · объёмные xi=vi /v. Здесь: i - номер компоненты; G,m,v - масса, число молей и объём; величины без индексов относятся к смеси. При известных молекулярных массах компонент Мi и смеси М можно осуществить переход от объёмных концентраций к массовым и наоборот: gi=xi Mi /M. (1.5) При этом по закону Авогадро yi=xi. При известных концентрациях и параметрах компонент средние характеристики смеси определяются следующим образом: · давление р=pi /xi (1.6) · объём v=vi /xi (1.7) · молекулярная масса M= å (xi Мi)/100=100/ å (gi /Mi) (1.8) · плотность r =100/ å (gi / r i)=100M/ å (xi Mi)/ ri= å (xi r i) (1.9) В формулах (1.8, 1.9) концентрация дана в процентах.
природного газа, кг/м3; у - содержание данного тяжелого углеводорода в газе, мол.%; r - плотность данного тяжелого углеводорода, кг/м3. После определения содержания в газе отдельных компонентов пересчитывают содержание в нём n- бутана и газового бензина При этом считают, что в газовый бензин целиком переходит пентан плюс вышекипящие и часть нормального бутана, по величине равная половине содержания пентана плюс вышекипящие. Пропан бутановая фракция при повышенных давлениях находится в жидком состоянии и переходит в газообразное при понижении давления до атмосферного. Объём паров, получаемый после испарения жидкого углеводорода(при нормальных физических условиях р=0,1013МПа, Т=273 К), можно вычислить по формуле Vп=G / rп= 22,41 G / М, м3, (1.11) где М - молекулярная масса углеводорода, rп - плотность паров углеводорода при нормальных условиях; G - масса жидкого углеводорода, кг. Если имеется смесь жидких углеводородов, то объём паров подсчитывается по (1.11) с подстановкой средней молекулярной массы смеси испарившихся углеводородов.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 180; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.19.251 (0.163 с.) |
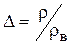 . (1.4)
. (1.4)



 (3.1)
(3.1)
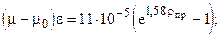
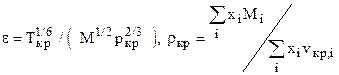 .
.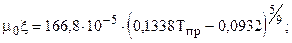 (3.2)
(3.2)
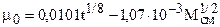 (3.3)
(3.3) , (3.3.1)
, (3.3.1)
 , (3.4)
, (3.4) , (3.5)
, (3.5) , (3.6)
, (3.6) , (3.7)
, (3.7)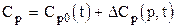 , (3.8)
, (3.8) (3.9)
(3.9) (3.10)
(3.10) [кДж/(кмоль К)]. (3.11)
[кДж/(кмоль К)]. (3.11) [кДж/(кмоль К)]. (3.12)
[кДж/(кмоль К)]. (3.12) , (3.13)
, (3.13)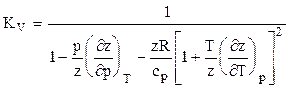 , (3.14)
, (3.14)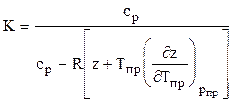 (3.15)
(3.15) (3.16)
(3.16) , (3.26)
, (3.26)
 (3.27)
(3.27)
 , l измеряется в 418.68 Вт/(м К).
, l измеряется в 418.68 Вт/(м К).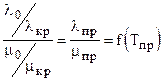 , (3.28)
, (3.28)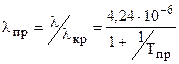 . (3.29)
. (3.29) (3.30)
(3.30)


