
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
TЕМA. Розчини. Розрахунки в титриметричному аналізі.
2. МЕТА. Закріпити знання про величини, що характеризують кількісний склад розчинів та знання теоретичних основ титриметричного аналізу. Студент повинен знати: - величини, що характеризують кількісний склад розчинів; - формули для визначення масової частки, молярної концентрації, молярної концентрації еквівалента; - формули для визначення кількості речовини, кількості речовини еквівалента, молярної маси еквівалента, фактора еквівалентності; - формули для проведення розрахунків у титриметричному аналізі; вміти: - розраховувати концентрацію розчинів; - розраховувати масу і кількість розчиненої речовини в розчині; - переводити одну форму вираження концентрації в іншу; - проводити розрахунки за формулами титриметричного аналізу. ОРІЄНТОВНА КАРТКА ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
ЗАДАЧІ ДЛЯ САМОСТІЙНОГО РОЗВ’ЯЗАННЯ Задача 1. Глутамінова кислота застосовується при лікуванні захворювань ЦНС у вигляді розчинів з масовою часткою 1% і густиною 1,12 г/см3. Розчинником є розчин з масовою часткою глюкози 25%. Розрахувати масу глутамінової кислоти, що необхідна для приготування 50 см3 розчину. РОЗВ’ЯЗАННЯ 1) Знаходимо масу розчину глутамінової кислоти: m(р-ну) = ρ ∙ V = 1,12 г/см3 ∙ 50 см3 = 56 г
2) Знаходимо масу глутамінової кислоти в цьому розчині:
Задача 2. При запаленнях шкіри і слизових оболонок використовують розчин ацетату алюмінію, який одержують розчиненням 8,7 г солі в 100 мл води. Визначити молярну концентрацію ацетату алюмінію у такому розчині, якщо густина розчину 1,05 г/см3. РОЗВ’ЯЗАННЯ 1) Розраховуємо кількість речовини ацетату алюмінію:
2) Визначаємо масу розчину, враховуючи, що ρ(Н2О) = 1 г/см3: m(розчину) = m(Аl(СНзСОО)з) + m(води) = 8,7 г + 100 г = 108,7 г 3) Знаходимо об’єм розчину:
4) Знаходимо молярну концентрацію солі:
Задача 3. При проведенні якісної проби Обермейєра в біохімічному аналізі застосовують реактив, який є розчином з масовою часткою хлориду заліза (ІІІ) 0,335% у концентрованій соляній кислоті. Густина такого розчину 1,2 г/см3. Визначити молярну концентрацію еквівалента хлориду заліза (ІІІ) у цьому розчині. РОЗВ’ЯЗАННЯ 1) Припустимо, що об’єм розчину дорівнює 1 л: V(розчину) = 1л = 1000см3 2) Визначаємо масу розчину такого об’єму: m(розчину) = V(poзчинy)∙ ρ = 1000 см3 · 1,2 г/см3 = 1200 г
3) Знаходимо масу хлориду заліза (ІІІ):
4) Знаходимо молярну масу еквівалента хлориду заліза (ІІІ):
5) Знаходимо кількість речовини еквівалента хлориду заліза (ІІІ) в 1 л розчину, тобто молярну концентрацію еквівалента:
Задача 4. 1,14 г реактивної щавелевої кислоти Н2С2О4 ∙ 2Н2О розчинили у воді і приготували 200 мл розчину. На титрування 25,00 мл такого розчину було витрачено 20,00 мл розчину з молярною концентрацією еквівалента NaОН 0,1 моль/л. Визначити масову частку чистої щавелевої кислоти у наважці. РОЗВ’ЯЗАННЯ 1) За основним рівнянням титрування знаходимо молярну концентрацію еквівалента щавелевої кислоти у розчині:
2) Знаходимо масу дигідрату щавелевої кислоти в одному літрі розчину;
М
щавелевої кислоти, моль/л;
3) Знаходимо мacy дигідрату щавелевої кислоти у 200 мл (0,2л)приготовленого розчину:
4) Знаходимо масову частку чистої щавелевої кислоти (дигідрату) у наважці:
ЛІТЕРАТУРА. 1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, 2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008. 3. Садовничая Л.Л., Хухрянский В.Г., Биофизическая химия. К: Вища школа, 1986. 4. Ленский А.С. Введение в бионеорганическую химию. М: Высшая школа, 1989. 5. Бабков А.В. и др. Практикум по общей химии с элементами количественного анализа. М: Высшая школа, 1978.
ТЕМА. Окисно-відновне титрування (оксидиметрія). Метод перманганатометрії. 2. ОБҐРУНТУВАННЯ ТЕМИ. Окисно-відновні реакції є одним з основних видів взаємодії в живому організмі. Реакції окиснення-відновлення лежать в основі ряду методів кількісного аналізу, які об’єднуються під загальною назвою оксидиметрії. Цими методами визначають вміст окисників і відновників у розчинах, біологічних рідинах, воді. Одним з методів оксидиметрії є перманганатометрія (робочий розчин - перманганат калію). Методом перманганатометрії можна визначати вміст сечової кислоти у сечі та крові, іонів кальцію, окислювального фермента каталази. Цей метод використовується у санітарно-гігієнічному аналізі при дослідженні питної води та стічних вод. Розчини перманганату калію застосовуються також як дезинфікуючі засоби, компоненти відбілюючих рецептур у стоматології.
3. МЕТА. Сформувати уявлення про можливості застосування окисно-відновних реакцій у кількісному аналізі та засвоїти принципи перманганатометричного титрування. Студент повинен знати: - основні положення теорії окисно-відновної взаємодії; - суть методів оксидиметрії, зокрема перманганатометрії; - особливості дії перманганату калію як окисника в різних середовищах; - особливості перебігу окисно-відновних реакцій в організмі; вміти: - складати рівняння окисно-відновних реакцій; - проводити перманганатометричне титрування; - виконувати розрахунки в перманганатометричному аналізі.
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 437; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.79.59 (0.01 с.) |







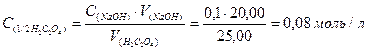

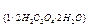
 -молярна маса еквівалента дигідрату щавелевої кислоти, г/моль;
-молярна маса еквівалента дигідрату щавелевої кислоти, г/моль;
 - молярна концентрація еквівалента дигідрату
- молярна концентрація еквівалента дигідрату





