
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбция и пов-тное натяжение. Связи адсорбции с параметрами системы. Изотерма адсорбции.
Адсорбция 1– самопроизвольное концентрирование газообразного или растворенного в-ва на поверхности раздела фаз. 2 – количественная характеристика (мера адсорбата) Адсорбент – конденсированная фаза, на пов-ти кот. происходит адсорбция; Адсорбат – в-во, кот. уже адсорбировало; Адсорбтив – адсорбирующееся в-во. Критерий наличия адсорбции – время жизни молекулы адсорбата на пов-ти адсорбента. Ур. Френкеля: τ=τ0 еQ/RT τ0 – время молекулярного колебания(~10-13c), Q- теплота адсорбции. 1.Силовое взаимодействие молекул, находящихся на пов-ти и внутри тела: Пов-тные мол-лы не испытывают существенного воздействия со стороны мол-л, нах. вне тела => притяжение со стороны соседних мол-л, распол. внутри тела, оказ. нескомпеснированным. => эффект силы, втяг. пов-тные мол-лы внутрь ж или тв. тела – пов. нат-е. [Н/м] 2. Пов. нат-е – термодинамическая хар-ка пов-ти раздела фаз, определяющаяся как работа обратимого изотермического образования единицы площади пов-ти раздела фаз => σ=W/s, где σ- коэф. пов-тного натяения, W-работа, затрачиваемая на образование (разрушение) пов-ти, s - площадь пов-ти раздела фаз. [Дж/м2] => пов-тное нат-я на границе ж-г часто представляют как работу, кот. необх. затратить, чтобы разорвать столбик ж-ти с поперечным сечением 0,5 единицы площади.(Образуются новых пов-ти, площадь кот. =1). Пов. нат. можно выр. как частную производную от любой термодинамической функции по площади межфазной границы при постоянных термодинамических параметрах, определяющих условия процесса. Для чистой ж-ти: σ=∆G/∆s – физический смысл пов. нат. – энергия образования единицы пов-ти тела, состоящего из чистого в-ва. Зависимость пов. нат. от конц-ции растворенного в-ва (график - в воде) При растворении в-во, обладающее меньшим пов-тным натяжением, чем р-ль, накапливается (адсорбируется) на пов-ти. Поэтому конц-ция растворенного в-ва в поверхностном слое оказывается выше, чем в объеме р-ра. => снижение свободной поверхностной энергии сис-мы => снижение пов. натяжения.
2- неадсорбирующееся в-во 3- поверхностно-активное в-во (коллоидный электролит) 4- полярное органическое соединение типа С2Н2ОН (Т=const)
При адсорбции свободная энергия сис-мы меняется за счет изменения пов-ти и кол-ва в-ва, адсорбированного на ней: dU(s)= TdS(s)+ σs+Σμini(s) (1) Полный дифференциал U(s): dU(s)= TdS(s)+ S(s)dT+ σds+ sdσ+ Σμidni(s) +Σni(s)dμi (2) (2)-(1): S(s)dT+ sdσ+ Σni(s)dμi =0 При Т=const: sdσ+ Σni(s)dμi =0 Принимая, что величина избытка данного компонента в пов-тностном совпадает с полным кол-вом этого компонента в пов-м слое (n/s=Г)=> и с величиной адсорбции: -dσ=ΣГidμi => Г=-dσ/dμ – фундаментальное ур. адсорбции Гиббса. Изотерма адсорбции:
Измеряемые параметры: c,σ при а=ус, где у- коэф-т активности, Межфазная граница, область применения: раствор-газ, раствор-твердое тело. Для разбавленных р-ров Г= - сdσ/RTdс.
Измеряемые параметры: c,σ, для воды σ0=0,0728 Дж*м-2 Межфазная граница, область применения: Р-р-газ, вода-жидкие углеводороды. Хорошо описывает адсорбцию ПАВ, учитывая, что а=АmaxRT. 15. Классификация свободнодисперсных систем по размерам частиц. Лиофильные и лиофобные золи. Приведите примеры типичных мицелл, поясните их состав, в чем они одинаковы, чем различаются.
Диспергирование и обратный процесс – агрегирование в-ва – в любой реальной сис-ме протек. непрерывно => оценивать точные размеры коллоидных и др. ч-ц дисперсной фазы не имеет смысла. Для этого сущ. ориентировочные размеры – зависимость удельной пов-ти от размера ч-ц. Коллоидные системы различают по характеру взаимодействия дисперсионной фазы с дисперсной средой. Если это взаимод. слабое, говорят о лиофобных золях. Лиофильные золи – интенсивное взаимод-е дисперсной фазы с дисперсионной средой. Соврем-я классификация обоснована П.А.Ребиндером с позиции термодинамики.
К лиофильным золям относят термодинамически устойчивые системы, которые образуются в результате самопроизвольного диспергирования. Гидрофильные золи образуются самопроизвольно при растворении в воде ВМС или полуколлоидов – органических в-в, мол-лы кот. состоят из 2х частей: гидрофобного углеводородного радикала (включает не более 18…20 углеродных атомов) и гидрофильной полярной группой (типа ОН-, -СООН). Важнейший критерий коллоидного состояния – наличие пов-ти у ч-ц дисперсной фазы. Состав и форма мицеллы определяется конц-цией мол-л полуколлоидов. Мицеллы м. б. сферические, плоские, цилиндрич-е и др. Для гидрофильных золей характерно интенсивное взаимод-е мол-л воды с полярными гидрофильными группами. Типичные примеры: р-ры природных и синтетических р-ров ВМС (молоко, пиво) - свободнодисперсные сис-мы, где вода- дисперсионная среда, а дисперсная фаза образована частицами различной степени дисперсности из орг. в-в. Гидрофобные золи. Их дисперсная фаза образована мицеллами из неорганических веществ, основа которых агрегат, плохо растворимая в дисперсионной среде (напр. в воде)кристаллическая или аморфная микрочастица. Если агрегат пол. в рез. хим. р-ции, то чаще всего потенциалопределяющим в-вом и стабилизатором б. один из ионов реагента, взятого в избытке. Наличие стабилизатора является обязательным условием существования лиофобного золя. Лиофобные дисперсные системы получают либо методом принудительного дробления (истирания), либо посредством химической или физической конденсации. Поэтому они не м.б. термодинамически устойчивыми. (Любая сис-ма б. находится в устойчивом равновесном сост-и лишь при min свободной энергии. Дисп. фаза лиофобных золей обладает высокой своб. пов-тной энергией => неуст.) AgNO3 + KJ = AgJ↓ + KNO3
Коллоидная частица заряжена -, KJ в избытке, стабилизатор – ионы J-
Составные части коллоидной мицеллы: агрегат (1) – мельчайший кристаллик, состоящий из некоторого кол-ва мол-л нерастворимого в дисперсионной среде в-ва; ядро – включает агрегат(1) и потенциалопределяющие ионы(2), входящие в адсорбционный слой (ионы стабилизатора); частица – включает ядро и противоионы (3) адсорбционного слоя; мицелла – включает частицу и противоионы (4) диффузного слоя. Правило Панета-Пескова-Фаянса: на пов-ти кристаллическго агрегата энергично адсорбируются из окружающего р-ра ионы, способные достраивать кристаллическую решетку или образовывать с противоположно заряженными ионами кристаллической пов-ти малорастворимые соединения, т.е. ионы одинаковые или изоморфные с ионами, находящимися на пов-ти кристалла.
|
||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 467; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.165.246 (0.008 с.) |
 1- поверхностно-неактивное в-во (часто неорганические электролиты)
1- поверхностно-неактивное в-во (часто неорганические электролиты) Ур-е Гиббса: Г= - аdσ/RTda;
Ур-е Гиббса: Г= - аdσ/RTda;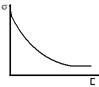 Ур-е Шишковского: σ=σ0 –аln(1+bc);
Ур-е Шишковского: σ=σ0 –аln(1+bc); Свободнодисперсные сис-мы характеризуются тем, что в них отдельные части дисперснойц фазы не связаны м/у собой и могут независимо перемещаться в дисперсионной среде под влиянием теплового движения и силы тяжести. Они обладают свойствами, характерными для любых ж-тей (вязкостью, текучестью). Примеры: лиозоли, разбавленные эмульсии и суспензии, аэрозоли. Среди пищ. продуктов – молоко, сметана, напитки.
Свободнодисперсные сис-мы характеризуются тем, что в них отдельные части дисперснойц фазы не связаны м/у собой и могут независимо перемещаться в дисперсионной среде под влиянием теплового движения и силы тяжести. Они обладают свойствами, характерными для любых ж-тей (вязкостью, текучестью). Примеры: лиозоли, разбавленные эмульсии и суспензии, аэрозоли. Среди пищ. продуктов – молоко, сметана, напитки. Коллоидная частица заряжена +, AgNO3 в избытке, стабилизатор – ионы Ме Ag+
Коллоидная частица заряжена +, AgNO3 в избытке, стабилизатор – ионы Ме Ag+



