1. Укажите название элемента, его обозначение. Определите порядковый номер элемента, номер периода, группу, подгруппу. Укажите физический смысл параметров системы – порядкового номера, номера периода, номера группы. Обоснуйте положение в подгруппе.
2. Укажите количество электронов, протонов и нейтронов в атоме элемента, заряд ядра, массовое число.
3. Составьте полную электронную формулу элемента, определите электронное семейство, отнесите простое вещество к классу металлов или неметаллов.
4. Изобразите графически электронную структуру элемента (или двух последних уровней).
5. Укажите число и тип валентных электронов.
6. Графически изобразите все возможные валентные состояния.
7. Перечислите все возможные валентности и степени окисления.
8. Напишите формулы оксидов и гидроксидов для всех валентных состояний. Укажите их химический характер (подтвердите ответ уравнениями соответствующих реакций).
9. Приведите формулу водородного соединения.
10. Назовите область применения данного элемента
Решение. В ПСЭ элементу с порядковым номером 21 соответствует скандий  .
.
1. Элемент находится в IV периоде. Номер периода означает число энергетических уровней в атоме этого элемента, у него их 4. Скандий расположен в 3-й группе – на внешнем уровне 3 электрона; в побочной подгруппе. Следовательно, его валентные электроны находятся на 4s- и 3d- подуровнях. Является d-элементом. Порядковый номер численно совпадает с зарядом ядра атома.
2. Заряд ядра атома скандия +21.
Число протонов и электронов - по 21.
Число нейтронов А-Z= 45-21=24.
Общий состав атома:  (
( ).
).
3. Полная электронная формула скандия:
 1s2 2s2 2p6 3s2 3p6 3d1 4s2 или в сокращенной форме: [Sc] 3d1 4s2
1s2 2s2 2p6 3s2 3p6 3d1 4s2 или в сокращенной форме: [Sc] 3d1 4s2
Электронное семейство: d-элемент, так как в стадии заполнения d-орбитали. Электронное строение атома заканчивается s- электронами, поэтому скандий проявляет металлические свойства; простое вещество – металл.
4. Электронно-графическая конфигурация  имеет вид:
имеет вид:

5. Он имеет в возбужденном состоянии три валентных электрона (два на 4s- и один на 3d- подуровне)
6. Возможные валентные состояния, обусловленные числом неспаренных электронов:
- в основном состоянии:
s p d
f
- в возбужденном состоянии:
s p d
f
спинвалентность равна 3 (один неспаренный d-электрон и два неспаренных s-электрона)
7. Возможные валентности в данном случае определяются числом неспаренных электронов: 1, 2, 3 (или I, II, III). Возможные степени окисления (отражают число смещенных электронов) +1, +2, +3. Наиболее характерные и устойчивая валентность III, степени окисления +3. Наличие лишь одного электрона в d- состоянии обуславливает малую устойчивость d1s2- конфигурации. Скандий и его аналоги, в отличие от других d-элементов проявляет постоянную степень окисления +3, это высшая степень окисления и соответствует номеру группы.
8. Формулы оксидов и их химический характер: форма высшего оксида – Sc2O3 (амфотерный).
Формулы гидроксидов: Sc(OH)3 – амфотерный.
Уравнения реакций, подтверждающих амфотерный характер оксидов и гидроксидов:
Sc(OH)3 +3 КОН = К3[Sc(OH)6] (гекса гидроксоскандиат калия )
2 Sc(OH)3 + 3 Н2SO4 = 6 Н2О + Sc2(SO4)3 (сульфат скандия)
9. Соединения с водородом не образует, так как находится в побочной подгруппе и является d-элементом.
10. Соединения скандия применяются в полупроводниковой технике.
Пример 6. У какого из двух элементов марганца или брома сильнее выражены металлические свойства?
Решение. Данные элементы находятся в четвертом периоде. Записываем их электронные формулы:
25 Mg 1s22s22p63s23p64s23d5
35 Br 1s22s22p63s23p64s23d104p5
Марганец – d-элемент, то есть элемент побочной подгруппы, а бром – р-элемент главной подгруппы этой же группы. На внешнем электронном уровне у атома марганца только два электрона, а у атома брома – семь. Радиус атома марганца меньше радиуса атома брома при одинаковом числе электронных оболочек.
Общей закономерностью для всех групп, содержащих р- и d-элементы является преобладание металлических свойств у d-элементов. Таким образом, у марганца металлические свойства выражены сильнее, чем у брома.
Пример 7. Какой из двух гидроксидов является более сильным основанием а) Sr(OH)2 или Ba(OH)2; б) Ca(OH)2 или Fe(OH)2 в) Sr(OH)2 или Cd(OH)2?
Решение. Чем больше заряд и чем меньше радиус иона, тем сильнее удерживает он другие ионы. В этом случае гидроксид будет более слабым, так как у него меньше способность к диссоциации.
а) Для ионов одинакового заряда со сходным электронным строением радиус, тем больше, чем больше электронных слоев содержит ион. Для элементов главных подгрупп (s- и р-) радиус у ионов увеличивается с увеличением порядкового номера элемента. Следовательно, Ba(OH)2 является болеесильным основанием, чем Sr(OH)2.
б) В пределах одного периода радиусы ионов уменьшаются при переходе от s- и р-элементов к d-элементам. При этом число электронных слоев не меняется, а заряд ядра увеличивается. Поэтому основание Ca(OH)2 более сильное, чем Fe(OH)2.
в) Если элементы находятся в одном периоде, в одной группе, но в разных подгруппах, то радиус атома элемента главной подгруппы больше радиуса атома элемента побочной подгруппы. Отсюда, основание Sr(OH)2 сильнее, чем Cd(OH)2.
Пример 8. Каким типом гибридизации АО азота описывается образование иона  и молекулы NH3? какова пространственная структура этих частиц?
и молекулы NH3? какова пространственная структура этих частиц?
Решение. Как в ионе аммония, так и в молекуле аммиака валентный электронный слой атома азота содержит четыре электронных пары. Поэтому в обоих случаях электронные облака атома азота будут максимально удалены друг от друга при sр3-гибритизации, когда их оси направлены к вершинам тетраэдра. При этом в ионе  все вершины тетраэдра заняты атомами водорода, так что этот ион имеет тетраэдрическую конфигурацию с атомом азота в центре тетраэдра.
все вершины тетраэдра заняты атомами водорода, так что этот ион имеет тетраэдрическую конфигурацию с атомом азота в центре тетраэдра.
При образовании молекулы аммиака атомы водорода занимают только три вершины тетраэдра, а к четвертой вершине направлено электронное облако неподеленной электронной пары атома азота. Образовавшаяся фигура при этом – тригональная пирамида с атомом азота в ее вершине и атомами водорода в вершинах основания.
Пример 9. Объясните с позиций метода МО возможность существования молекулярного иона 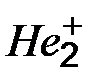 и невозможность существования молекулы Не2.
и невозможность существования молекулы Не2.
Решение. В молекулярном ионе 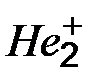 имеются три электрона. Энергетическая схема образования этого иона с учетом принципа Паули показана на рис.21.
имеются три электрона. Энергетическая схема образования этого иона с учетом принципа Паули показана на рис.21.
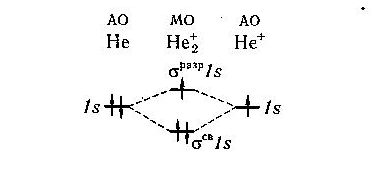
Рис. 21. Энергетическая схема образования иона 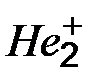 .
.
На связывающей орбитали размещены два электрона, а на разрыхляющей – один. Следовательно, кратность связи в этом ионе равна (2-1)/2 = 0,5, и он должен быть энергетически устойчивым.
Напротив, молекула Не2 должна быть энергетически неустойчивой, поскольку из четырех электронов, которые должны разместиться на МО, два займут связывающую МО, а два – разрыхляющую. Следовательно, образование молекулы Не2 не будет сопровождаться выделением энергии. Кратность связи в этом случае равна нулю – молекула не образуется.
Пример 10. Какая из молекул – В2 или С2 характеризуется более высокой энергией диссоциации на атомы? Сопоставьте магнитные свойства этих молекул.
Решение. Составим энергетические схемы образования данных молекул (рис. 22).

Рис. 22. Энергетическая схема образования молекул В2 и С2.
Как видно, в молекуле В2 разность между числом связывающих и числом разрыхляющих электронов равна двум, а в молекуле С2 – четырем; это отвечает кратности связи соответственно 1 и 2. Следовательно, молекула С2 . характеризующаяся более высокой кратностью связи между атомами, должна быть более прочной. Этот вывод соответствует экспериментально установленным значениям энергии диссоциации на атомы молекул В2 (276 кДж/моль) и С2 (605 кДж/моль).
В молекуле В2 два электрона расположены, согласно правилу Гунда, на двух πсв 2р-орбиталях. Наличие двух неспаренных электронов сообщает этой молекуле парамагнитные свойства. В молекуле С2 все электроны спарены, следовательно, эта молекула диамагнитна.
Пример 11. Как располагаются электроны по МО в молекуле CN и в молекулярном ионе CN -, образующемся по схеме: C- + N → CN -. В какой из этих частиц длина связи наименьшая?
Решение. Составив энергетические схемы образования рассматриваемых частиц (рис. 23), заключаем, что кратность связи в CN и CN- соответственно равна 2,5 и 3. Наименьшей длиной связи характеризуется ион CN -, в котором кратность связи между атомами наибольшая.

Рис. 23. Энергетические схемы
образования молекулы CN и молекулярного иона CN -.
Пример 12. Какой тип кристаллической решетки характерен для твердого простого вещества, образованного элементом с порядковым номером 22?
Решение. По ПСЭ Д.И. Менделеева определяем элемент с данным порядковым номером и составляем его электронную формулу.
Титан  1s22s22p63s23p64s23d2
1s22s22p63s23p64s23d2
Титан является d-элементом, на внешнем уровне содержит два электрона. Является типичным металлом. В кристалле титана между атомами, имеющими на внешнем валентном уровне два электрона, возникает металлическая связь. Энергия кристаллической решетки ниже энергии решетки ковалентных кристаллов, но значительно выше, чем у молекулярных кристаллов. Кристалл титана обладает высокой электро- и теплопроводностью, способен деформироваться без разрушения, обладает характерным металлическим блеском, имеет высокую механическую прочность и температуру плавления.
Пример 13. Чем отличается структура кристалла CaF2 от структуры кристаллов Са и F2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет, а их свойства?
Решение.  1s22s22p63s23p64s2 Са – типичный металл, s-элемент, имеет на внешнем энергетическом уровне два валентных электрона. Образует металлическую кристаллическую структуру с выраженным металлическим типом связи. Обладает металлическим блеском, электро- и теплопроводностью, пластичен.
1s22s22p63s23p64s2 Са – типичный металл, s-элемент, имеет на внешнем энергетическом уровне два валентных электрона. Образует металлическую кристаллическую структуру с выраженным металлическим типом связи. Обладает металлическим блеском, электро- и теплопроводностью, пластичен.
 1s22s22p5 F2 – типичный неметалл, р-элемент, на внешнем энергетическом уровне имеет только один неспаренный электрон, что недостаточно для образования прочных ковалентных кристаллов. Атомы фтора связаны ковалентной связью в двухатомные молекулы, которые образуют молекулярный кристалл за счет сил межмолекулярного взаимодействия. Он непрочен, легко возгоняется, обладает низкой температурой плавления, изолятор.
1s22s22p5 F2 – типичный неметалл, р-элемент, на внешнем энергетическом уровне имеет только один неспаренный электрон, что недостаточно для образования прочных ковалентных кристаллов. Атомы фтора связаны ковалентной связью в двухатомные молекулы, которые образуют молекулярный кристалл за счет сил межмолекулярного взаимодействия. Он непрочен, легко возгоняется, обладает низкой температурой плавления, изолятор.
При образовании кристалла CaF2 между атомами Са и F образуется ионная связь, поскольку разница в электроотрицательности между ними достаточно велика DЭО=4 (табл. 14). Это приводит к образованию ионного кристалла. Вещество растворимо в полярных растворителях. При обычных температурах является изолятором, при повышении температуры усиливаются точечные дефекты кристалла (за счет теплового движения ионы покидают узлы кристаллической решетки и переходят в междоузлия или на поверхность кристалла). Когда кристалл попадает в электрическое поле, наблюдается направленное перемещение ионов к вакансии, образованные ушедшим ионом. Тем самым обеспечивается ионная проводимость кристалла CaF2.
5.4. Индивидуальные задания
Задание 1. Решите задачи своего варианта (табл. 35).
Таблица 35
Варианты контрольного задания
| Вариант
| Условия
|
|
| 1.Сокращенная электронная формула элемента изображена в виде:…4s24p2. Какой это элемент? Напишите полную электронную формулу и набор квантовых чисел для “последнего” электрона на внешнем электронном уровне.
|
Продолжение табл. 35
|
| 2. В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7- и d12 – электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны.
3. У атомов, какого из элементов — хрома (Сг) или селена (Sе) в большей степени выражены металлические свойства? При взаимодействии атомов хрома и селена какой из них проявляет восстановительные свойства?
4. Объясните, у какого элемента – Cr или Se сильнее выражены металлические свойства.
5. Объясните, что определяет межъядерное расстояние. Почему при сближении атомов их ядра не сливаются?
6. Молекула СО2 имеет нулевое значение дипольного момента. Предложите структурно-графическую формулу углекислого газа. Чем объяснить, что у структуры СОCl2 величина дипольного момента отлична от нуля?
7. Чем характеризуется внутреннее строение кристаллов?
8. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 10, 37? Какие связи имеются в этих кристаллах, и какие свойства характерны для них?
|
|
| 1. Сокращенная электронная формула элемента изображена в виде:...3d8. Какой это элемент? Напишите полную электронную формулу и набор квантовых чисел для 8-го электрона на d-подуровне.
2. Квантовые числа для электронов внешнего энергетического уровня атомов некоторых элементов имеют следующие значения: n=4, l=0, ml=0, ms= ± ½. Напишите электронные формулы атомов этих элементов и определите, сколько свободных 3d-орбиталей содержит каждый из них.
3. Назовите элементы, отрицательные ионы которых имеют следующие электронные конфигурации: 1S22S22р6 (Э1-), 1S22S22p6 (Э2-); 1S22S22р63S23р6 (Э3-); [Аг] 3d104S24p6 (Э3-).?
4. Расположите оксиды в порядке возрастания их кислотных свойств: Mg O, Al2O3, N2O5, B2O3, CO2. Ответ поясните.
5. Почему использование гибридных орбиталей предпочтительнее, чем обычных (негибритизованных) при образовании химической связи?
6. Составьте энергетическую диаграмму молекулы HF. Почему возможно образование молекулярной орбитали за счет атомных орбиталей с разным значением главного квантового числа?
|
Продолжение табл. 35
|
| 7. В чем заключается явление анизотропии, характерное для кристаллов?
8. Чем отличается структура кристалла СН4 от структуры кристаллов Н2 и САЛМАЗ? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
|
|
| 1. Напишите полную электронную формулу элемента церия 58Ce.
2. Объясните исходя из электронного строения атомов, каков физический смысл номера периода и номера группы. Напишите электронные формулы атомов следующих элементов: а) калия, б) мышьяка, в) марганца. Какими химическими свойствами обладают данные атомы.
3. Почему кислород и сера, имея в наружном слое одинаковое число электронов, проявляют разную валентность?
4. У атомов элементов IВ -подгруппы (Си, Аg, Аu) наблюдается явление «провала» электрона. Запишите общую сокращенную электронную формулу атомов этих элементов без «провала» и с «провалом» электрона; чем обусловлен этот эффект?
5. Чем отличается ионная связь от ковалентной? Приведите примеры соединений с такими связями.
6. Нарисуйте энергетическую схему образования молекулы фтора по методу молекулярных орбиталей (ММО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле?
7. Какой тип кристаллической решетки имеет самое твердое природное вещество?
8. Чем отличается структура кристалла MgCl2 от структуры кристаллов Mg и Cl2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
|
|
| 1. Напишите полную электронную формулу и нарисуйте орбитальную диаграмму для элемента 19K. Запишите набор квантовых чисел для последнего (наиболее далекого от ядра) электрона этого элемента.
2. Дайте определение энергии ионизации атома. В каких единицах она измеряется? Как можно объяснить тот факт, что энергия ионизации у бериллия больше, чем у бора?
3. Может ли и почему азот быть окислителем по отношению к хлору?
4. Расположите элементы в порядке возрастания их неметаллических свойств: олово, кислород, сера, теллур, селен. Ответ поясните.
|
Продолжение табл. 35
|
| 5. Существует ли аналогия в строении молекул Н2О и H2S, PH3 и NH3, LiCl и HCl? Ответ обоснуйте.
6. Объясните донорно-акцепторный механизм ковалентной связи на примере образования иона фосфония [РН4]+.
7. Назовите типы кристаллических решеток. Чем характеризуется каждый тип?
8. Чем отличается структура кристалла CuJ2 от структуры кристаллов Cu и J2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
|
|
| 1. В каком элементе при его образовании из субатомных частиц последним свое место в электронной оболочке займет электрон с таким набором квантовых чисел: n = 3, l = 2, m = 1, s = 1/2? Напишите полную электронную формулу для этого элемента.
2. Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 18. Покажите распределение элементов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
3. Напишите электронные конфигурации ионов Ba2+ и Lа3+. Почему атомы элементов бария и лантана являются сильными восстановителями?
4. Объясните, у какого элемента – Ва или Са сильнее выражены металлические свойства.
5. Какие из двух элементов образуют соединения с преобладанием ионной или ковалентной связей: а) рубидий с фтором; б) водород с фтором; в) водород с углеродом?
6. Почему Н2О и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?
7. Какие физические свойства характерны для веществ с молекулярной кристаллической решеткой?
8. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 32, 36? Какие связи имеются в этих кристаллах, и какие свойства характерны для них?
|
|
| 1. Для какого элемента “последним” в электронной оболочке будет электрон с таким набором квантовых чисел: n=4, l=1, m=1, s=1/2? Напишите полную электронную формулу для этого элемента. Сколько у него неспаренных электронов?
2. Напишите электронные формулы атомов элементов с порядковым номером 14 и 40. Сколько свободных 3d-орбиталей у атомов последнего элемента?
|
Продолжение табл. 35
|
| 3. Напишите краткую электронную конфигурацию атомов кремния (Si) и свинца (Pb). Являются ли они аналогами электронной структуры и, какие свойства проявляют?
4. Почему в VII группе ПСЭ объединены атомы элементов неметаллов — галогенов (А-подгруппа) и атомы элементов с характерными металлическими свойствами (В-подгруппа)?
5. В молекулах СО, СО2, HBr, Br2 связь полярная или неполярная? Объясните.
6. Какая из частиц в ряду Ве+2 - Ве2 - Ве-2 наиболее устойчива? Каков порядок связи в этих частицах?
7.. Какие виды агрегатного состояния веществ существуют? Охарактеризуйте их свойства.
8. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 11, 33? Какие связи имеются в этих кристаллах, и какие свойства характерны для них?
|
|
| 1. Для какого элемента “последним” в электронной оболочке будет электрон с таким набором квантовых чисел: n = 2, l = 1, m = 0, s = 1/2? Напишите полную электронную формулу. Почему этот элемент не может быть благородным? Какой подуровень не заполнен по сравнению с ближайшим благородным элементом? Какой благородный элемент ближайший по электронному строению?
2. Какую информацию дает электронная формула элемента? Запишите электронную формулу и представьте графическую формулу валентных орбиталей атома азота. Определите основные химические свойства этого элемента.
3. Напишите электронные конфигурации ионов Se2- и Sе6+.. Почему для селена характерны как окислительные, так и восстановительные свойства?
4. Почему атомы типичных металлов (приведите примеры) обладают малыми значениями первой энергии ионизации?
5. Почему в галогенидах щелочных металлов формируется ионная связь?
6. Как МВС объясняет угловое строение молекулы H2S и линейное молекулы СО2?
7. Охарактеризуйте свойства газообразных веществ.
8. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 18, 30? Какие связи имеются в этих кристаллах, и какие свойства характерны для них?
|
Продолжение табл. 35
|
| 1. Объясните принципы и правила, определяющие последовательность заполнения атомных орбиталей электронами. Напишите электронную формулу элемента с порядковым номером 29.
2. Что характеризует относительная электроотрицательность элемента? Исходя из величин электроотрицательности, укажите, как в приведенном ряду F, Cl, Br, I изменяется способность атомов принимать электроны.
3. Какой из атомов — хлор или йод является окислителем при образовании молекулы IСl из атомов? У какого из этих атомов, сильнее выражена способность притягивать к себе электроны?
4. Атомы какого из элементов VIIА-подгруппы в большей степени проявляют восстановительные свойства по отношению к фтору?
5. Ковалентный или ионный тип связи характерен для следующих соединений: NaJ, SO2, KF, CO2?
6. Как МВС объясняет линейное строение молекулы BeCl2 и тетраэдрическое СН4?
7. Охарактеризуйте свойства твердого тела.
8. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 1, 3? Какие связи имеются в этих кристаллах, и какие свойства характерны для них?
|
|
| 1. Что характеризуют квантовые числа? Каково соотношение между ними? Комбинация, каких атомных орбиталей, и в каком количестве возможна для главного квантового числа равного 2?
2. Что понимают под возбужденным состоянием атома? Напишите электронные формулы атома фосфора, находящегося в нормальном и возбужденном состояниях. Представьте графические электронные формулы для этих двух состояний.
3. На основании электронного строения атома брома (Вг) определите число электронов, которые могут принимать участие в процессе окисления и восстановления этого атома. Приведите примеры атомов элементов VА - подгруппы окислителей и восстановителей по отношению к брому.
4. Магний или алюминий является более сильным восстановителем? Соответствует ли это большему значению первой энергии ионизации магния (7,6 Эв) по сравнению с алюминием (6,0 эВ).
5. Почему при растворении HCl в воде образуются ионы, хотя связь в молекуле не ионная?
6. Что такое электрический момент диполя? Какая из молекул HCl, HBr, HJ имеет наибольший момент диполя? Почему?
|
Продолжение табл. 35
|
| 7. Дайте характеристику аморфным и кристаллическим веществам. В чем их сходство и отличие?
8. Чем отличается структура кристалла NaCl от структуры кристаллов Na и Cl2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
|
|
| 1. Как зависит энергия электрона от орбитального квантового числа в многоэлектронном атоме при постоянном значении главного квантового числа? Какой из подуровней 3d или 4s будет заполняться электронами раньше?
2. Какие орбитали атома заполняются электронами раньше:4S или 3d? Почему?
3. Назовите элементы, положительные ионы которых имеют следующие электронные конфигурации: 1S0 (Э2+); 1S22S0 (Э2+), 1S22S02p0 (Э3+); 1S22S22p0 (Э2+); 1S22S22p6 (Э4+).
4. Запишите электронную конфигурацию двухзарядного положительного иона марганца (Мп2+) и четырехзарядного (Мп4+). Как соотносятся энергии ионизации у этих ионов и их ионные радиусы?
5. Почему в металлах химическая связь делокализована?
6. Какие типы гибритизации АО углерода соответствуют образованию молекул СН4, С2Н6, С 2Н4, С2Н2?
7. Чем объясняется различие в электропроводимости твердых тел?
8. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 7, 53? Какие связи имеются в этих кристаллах, и какие свойства характерны для них?
|
|
| 1. Определите последовательность заполнения электронных подуровней, если l+n=5. Что понимают под атомной орбиталью?
2. Написать электронные формулы элементов с порядковыми номерами: 42, 20. Указать валентные электроны.
3. Запишите электронную конфигурацию двухзарядного отрицательного иона селена (Se2-). Изменяется ли и как радиус отрицательного иона селена по сравнению с нейтральным атомом селена?
4. Что понимают под процессом ионизации данного атома? Затрачивается или поглощается энергия при образовании положительных ионов? Приведите примеры.
5. В молекулах SO2 и SO3 атом серы находится в состоянии sp2-гибритизации. Полярны ли эти молекулы? Какова их пространственная структура?
|
Продолжение табл. 35
|
| 6. Какая химическая связь называется ионной? Чем определяется величина положительной валентности элементов, участвующих в образовании ионной связи?
7. Укажите химические связи в каждом из следующих кристаллов: вода, хлорид кальция.
8. Чем отличается структура кристалла H2S от структуры кристаллов H2 и S? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
|
|
| 1. Напишите электронные формулы атомов элементов с зарядом ядра 10, 15, 35. Какой смысл вкладывают в понятие s-, p-, d- электронных облаков. Как изобразить их графически?
2. Как изменяется энергия ионизации в периоде и группе? Энергия ионизации Е(Cs) = 375, E(Au) = 888 кДж/моль; их атомы содержат по одному электрону на внешнем энергетическом уровне. Чем объясняется значительное различие в энергиях ионизации?
3. Увеличиваются или уменьшаются значения энергии сродства к электрону у атомов элементов VIIА - подгруппы от фтора к астату?
4. Запишите электронную конфигурацию атомов элементов № 24 и № 34. Почему они расположены в одном периоде (каком?) и одной группе (какой?)?
5. Перечислите основные положения ММО. Напишите электронную формулу молекулы азота и определите в ней порядок связи.
6. Как влияет водородная связь на температуру кипения и плавления?
7. Какие физические свойства характерны для веществ с атомной кристаллической решеткой?
8. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 40, 2? Какие связи имеются в этих кристаллах, и какие свойства характерны для них?
|
|
| 1. Приведите графическую электронную формулу атома железа. Как располагаются d-электроны в атоме железа? Объясните порядок заполнения d- орбиталей.
2. Какие элементы называются электронными аналогами? Перечислите электронные аналоги в шестой группе периодической системы элементов. Какой общей электронной формулой можно описать конфигурацию внешнего электронного слоя халькогенов?
|
Продолжение табл. 35
|
| 3. Укажите номер подгруппы атомов элементов, у которых электронная конфигурация внешнего уровня и незавершенного предвнешнего подуровня (n – 1)d10 nS2.
4. Каким элементом s, р, d или f является лантан (Lа)? Ответ объясните.
5. Молекула BF3 имеет плоскостную структуру, а NF3 - объемную (пирамидальную). В чем причина различия в строении молекул?
6. Приведите примеры образования ковалентной связи по донорно-акцепторному механизму.
7. Какие физические свойства характерны для веществ с металлической кристаллической решеткой?
8. Чем отличается структура кристалла SiF от структуры кристаллов Si и F2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
|
|
| 1. Какое максимальное число электронов могут занимать s-, p-, d-,f-орбитали данного энергетического уровня? Почему?
2. Что понимают под атомным радиусом? Как изменяются атомные радиусы элементов в периодах и группах? Можно ли определять атомные радиусы элементов в периодах и группах? Можно ли определять атомные радиусы хлора, азота, серы по межъядерным расстояниям в молекулах Cl2, HСl, N2, N2H4, S8?
3. Объясните, какая из двух электронных конфигураций атома бора (В): первая — 1S22S12р2или вторая — 1S22S12р2соответствует основному состоянию? Покажите графически распределение электронов по атомным орбиталям.
4. Назовите номер периода ПСЭ, в котором располагаются элементы с 4d-формирующими электронами. Каково общее число 4d-элементов?
5. Что называется диполем, дипольным моментом? Что характеризует величина дипольного момента?
6. Сравните способы образования ковалентных связей в молекуле NH3 и в ионе NH+4.
7. Укажите химические связи в каждом из следующих кристаллов: йод, графит, алюминий и серная кислота.
8. Чем отличается структура кристалла LiN3 от структуры кристаллов Li и N2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
|
|
| 1. Какие орбитали атома заполняются электронами раньше: 5S или 4р? Почему?
|
Окончание табл. 35
|
| 2. Назовите элементы и укажите число неспаренных электронов в атомах, имеющих следующие электронные конфигурации:
а) 1s2 2s2 2p6 3s2 3p2;
б) 1s2 2s2 2p6 3s2 3p4;
в) 1s2 2s2 2p6 3s2 3p6 4s2 3d6;
3. Перечислите элементы, атомы которых завершают формирование К- и L-оболочек. К какой подгруппе и почему относятся эти элементы?
4. Назовите элемент, атомы которого на энергетическом уровне с n=5 имеют девять электронов. Перечислите аналоги электронной структуры этого элемента.
5. Изобразите перекрывание электронных орбиталей у молекул F2, HF, H2S, PH3. Какую форму должна иметь молекула PH3?
6. Какую ковалентную связь называют d -, p -, s-связью? Как метод ВС объясняет строение молекулы азота?
7.. Укажите химические связи в каждом из следующих кристаллов: аргон, кремний.
8. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 6, 82? Какие связи имеются в этих кристаллах, и какие свойства характерны для них?
|
Задание 2. Охарактеризуйте свойства представленных элементов, исходя из положения в периодической системе по плану согласно своему варианту (табл. 36).
Таблица 36
Исходные данные
| Вариант
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Порядковый номер элемента
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5.5. Тестовые задания
1. Последовательность заселения электронных оболочек выражается правилом:
а) Паули
б) Гунда
в) Клечковского
г) принципом наименьшей энергии
2. В состав атомного ядра входят:
а) протоны и электроны
б) нейтроны и электроны
в) протоны и нейтроны
г) нейтроны и позитроны
3. Название элемента с электронной формулой атома [Ar]3d24s2:
а) селен
б) алюминий
в) цинк
г) титан
4. Общее число электронов в частицах Ве2+, Cl-:
а) 12
б) 18
в) 20
г) 28
5. Правильно составленная электронная формула хлора:
а) 1s22s23s22p63p5
б) 1s22s22p63s23p5
в) 1s22s22p63s23p2
г) 1s12s22p63s23p63d3
6. В периодах ПС с увеличением заряда ядра атома окислительные свойства элементов
а) усиливаются
б) ослабевают
в) остаются без изменений
г) сначала усиливаются, потом ослабевают
7. Наиболее ярко выраженные восстановительные свойства проявляет атом, строению внешнего электронного слоя которого соответствует формула:
а) … 3s1
б) … 4s1
в) … 4s2
г) … 5s1
8. В ряду оксидов SiO2, SO3, Cl2O7 кислотные свойства
а) усиливаются
б) ослабевают
в) остаются без изменений
г) сначала усиливаются, потом ослабевают
9. Элемент германий относится к семейству:
а) s-элементов
б) р-элементов
в) d-элементов
г) переходных металлов
10. Металлические свойства в ряду К → Са → Mg → Al слева направо
а) увеличиваются
б) уменьшаются
в) не меняются
г) зависят от размера (радиуса) элемента
11. Перекрывание облаков вдоль линии соединения атомов, называется:
а) π- связь
б) δ – связь
в) р – связь
г) sр- гибритизация
12. Ковалентная связь образуется электронами, спины которых:
а) одинаковы
б) противоположны
в) параллельны
г) равноценны
13. Полярность ковалентной связи между атомами тем выше, чем больше разница между атомами в величине __________.
14. Наиболее прочная и короткая связь в молекуле
а) Н2О
б) Н2S
в) НF
г) РН3
15. Химическая связь в соединении KClO3
а) неполярные ковалентные
б) полярные ковалентные
в) преимущественно ионные
г) ковалентные и ионные
16. Атомная кристаллическая решетка характерна для кристалла:
а) NiCl2(к)
б) H2O(к)
в) Si(к)
г) Na(к)


 .
. ).
).
 и молекулы NH3? какова пространственная структура этих частиц?
и молекулы NH3? какова пространственная структура этих частиц?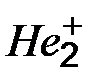 и невозможность существования молекулы Не2.
и невозможность существования молекулы Не2.


 1s22s22p63s23p64s23d2
1s22s22p63s23p64s23d2 1s22s22p63s23p64s2 Са – типичный металл, s-элемент, имеет на внешнем энергетическом уровне два валентных электрона. Образует металлическую кристаллическую структуру с выраженным металлическим типом связи. Обладает металлическим блеском, электро- и теплопроводностью, пластичен.
1s22s22p63s23p64s2 Са – типичный металл, s-элемент, имеет на внешнем энергетическом уровне два валентных электрона. Образует металлическую кристаллическую структуру с выраженным металлическим типом связи. Обладает металлическим блеском, электро- и теплопроводностью, пластичен. 1s22s22p5 F2 – типичный неметалл, р-элемент, на внешнем энергетическом уровне имеет только один неспаренный электрон, что недостаточно для образования прочных ковалентных кристаллов. Атомы фтора связаны ковалентной связью в двухатомные молекулы, которые образуют молекулярный кристалл за счет сил межмолекулярного взаимодействия. Он непрочен, легко возгоняется, обладает низкой температурой плавления, изолятор.
1s22s22p5 F2 – типичный неметалл, р-элемент, на внешнем энергетическом уровне имеет только один неспаренный электрон, что недостаточно для образования прочных ковалентных кристаллов. Атомы фтора связаны ковалентной связью в двухатомные молекулы, которые образуют молекулярный кристалл за счет сил межмолекулярного взаимодействия. Он непрочен, легко возгоняется, обладает низкой температурой плавления, изолятор.


