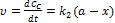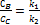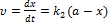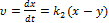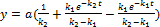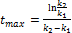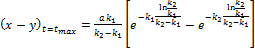Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Односторонні реакції 1 - порядку ⇐ ПредыдущаяСтр 4 из 4
Односторонні реакції 1 - порядку Це реакції виду: А → Продукти. Вираз для швидкості реакції має вигляд: W = K 1 C. Вона пов'язана зі швидкістю витрачання вихідної речовини А співвідношенням: де- стехіометричний коефіцієнт вихідної речовини А. Рівняння для константи швидкості реакції першого порядку прийме вигляд: Основним завданням хімічної кінетики є розрахунок швидкостей хімічних реакцій. Їх визначають з рівняння за відомою константі швидкості. До 1 знаходять експериментально. При цьому за експериментальними даними зміни концентрації вихідної речовини від часу будують графік в координатах 1пС - τ. У цій системі координат кінетичне рівняння реакції 1 го порядку представляє пряму лінію. Тангенс кута нахилу цієї лінії дорівнює Іноді для характеристики швидкості реакції користуються часом напівперетворення або напіврозпаду τ 1 / 2. τ 1 / 2 - це проміжок часу, протягом якого реагує З рівняння випливає, що τ 1 / 2 для реакції першого порядку не залежить від початкової концентрації вихідної речовини і визначається тільки константою швидкості. Рівняння кінетики реакції 1 ого порядку характеризують не тільки швидкості мономолекулярних реакцій, але застосовні і до складних реакцій. Багато складних реакції протікають як реакції першого порядку Односторонні реакції другого порядку. Реакція виду: Швидкість реакції: Кінетичне рівняння Час напівреакції Константа швидкості реакції Односторонні реакції третього порядку Реакція виду: Швидкість реакції:
Константа швидкості реакції
Методи визначення порядку реакції. а)Спосіб надлишкових концентрацій залежність швидкості від концентрації вихідних речовин записується рівнянням: де С 1 і С 2 - концентрації вихідних речовин А 1 і А 2; п 1 і п 2 - порядки реакції по речовин А 1 і А 2; К - константа швидкості реакції. Загальний порядок реакції дорівнює: п = п 1 + п 2 Якщо реакція елементарна і формально проста і підпорядковується кінетичному рівняння для елементарних реакцій, то порядок реакції по речовин А 1 і А 2 дорівнює їх стехіометричним коефіцієнтами в рівнянні реакції, тобто п 1 = v1 і п 2 = v2 тоді п = v1 + v2
в)Диференціальний метод (методВант-Гоффа) Здослідів, як правило, отримуютьзалежністьконцентраціїданого компонента від часу (кінетичнукриву) C i = f (τ i). У даномувипадкуможнавикористовувати так званий спосіблогарифмування г)Спосібпідстановки д)Графічнийспосіб
Оборотні реакції першого порядку. Реакція виду: Загальна швидкість реакції: Кінетичне рівняння Константа рівноваги
Паралельні реакції У випадку паралельних реакцій одні і тіж самі речовини реагують одночасно у декількох напрямках утворюючи різні продукти. Приклад: необоротна реакція першого порядку: Загальна швидкість реакції Для одержання окремих к1к2запишемо рівняння для швидкостей В і С
Відомо Тобто у будь-який момент реакції співвідношень будь-яких відношень реакцій є сталою величиною яка дорівнює відношенню констант швидкостей паралельних реакцій Послідовні реакції Більшість хімічних реакцій має складний механізм і вони перебігають через ряд послідовних стадій, а кінцеві продукти утворення з нестійких проміжних продуктів (молекул, атомів) у зв`язку з цим досліди цих послідовних реакцій –важлива задача хімічної кінетики. Найбільш простим прикладом для розгляду є випадок двох послідовних необоротних реакцій першого порядку
У початковий момент часу t=0 кінцева речовина. Речовина А=а, речовини В та С відсутні. Через деякий час t концентрація речовин становитимуть:
Швидкість перетворення речовини А в В Швидкість перетворення речовини Вв С Залежність концентрацій кінцевого продукту у вигляді Час досягнення максимуму Максимальна концентрація проміжного продукту
|
||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 275; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.184.214 (0.007 с.) |
 продукти
продукти



 продукти
продукти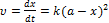 або
або