Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реинициация трансляции у эукариот
мРНК эукариот, как правило, моноцистронны, т.е. содержат только одну основную ОРС. Однако часто 5'UTR эукариотических мРНК содержат короткие ОРС. Например, у дрожжей известно несколько сотен видов таких мРНК, и они содержат от одной до шести коротких ОРС, часть из которых может перекрываться. То же самое характерно для мРНК животных. Несмотря на свои малые размеры, короткие ОРС способны обеспечивать инициацию, терминацию и реинициацию трансляции рибосомами эукариот. Короткие ОРС эукариот играют важную роль в регуляции экспрессии генов на уровне трансляции. По функциональному признаку короткие ОРС разделяются на две группы: в одних случаях регуляторные функции коротких ОРС не зависят от их кодирующего потенциала, тогда как другие ОРС реализуют свои регуляторные возможности через кодируемые ими пептиды. Если короткие ОРС следуют в мРНК друг за другом, рибосомы после завершения трансляции одной из них могут реинициировать синтез белка на следующем инициирующем кодоне. Как и в случае прокариотической трансляции, эффективность реинициации у эукариот в большой степени зависит от расстояния между терминирующим и инициирующим кодоном, а также от нуклеотидного контекста, в котором находится инициирующий кодон.
32. Трансляционная репрессия. Регуляция трансляции фаговой (MS2) РНК. (Сивкова) Гл. 15 Трансляционные репрессоры – специальные РНК-связывающие белки, обеспечивают возможность регуляции скоростей инициации в широком диапазоне в зависимости от внешних сигналов (эффекторов), а так же регуляции типа обратной связи (подавление новосинтезированным белком трансляции собственной РНК, ауторегуляция). Основной механизм трансляционной репрессии заключается в прямом связывании репрессорного белка с участком связывания с рибосомой (RBS) на мРНК. Этот белок конкурирует с рибосомами за взаимодействие с RBS. Если RBS располагается внутри нестабильного элемента вторичной структуры, репрессорный белок может стабилизировать эту структуру и, тем самым, препятствовать взаимодействию RBS с инициирующими рибосомами. Иногда репрессорный белок связывается с последовательностями, не входящими в состав RBS, и индуцирует перестройки вторичной или третичной структуры, в результате которых RBS становится закрытым и недоступным для инициирующих рибосом. Участок мРНК, с которым связывается репрессор, может быть назван трансляционным оператором.
A – белок А, С – белок оболочки, S – субъединица РНК-репликазы, L – белок лизиса. Три последовательно расположенных цистрона A, C и S содержат сильные RBS, и их трансляция инициируется свободными рибосомами, не зависимо от терминации на предыдущем цистроне. В отличие от них, цистрон L (у него сдвинута рамка считывания) транслируется только в результате малоэффективной ре-инициации после терминации трансляции на цистроне C и последующего «беспорядочного блуждания» нетранслирующей рибосомной частицы вдоль цепи РНК. РНК фага очень сильно структурирована, все инициаторные кодоны вовлечены в образование стабильных вторичных и третичных структур и не доступны для рибосом. Доступен только AUG кодон белка оболочки, с него трансляция и начинается. Рибосома бежит по РНК в сторону белка S, транслируя и попутно расплетая все шпильки. Участок инициации S открывается ещё до окончания синтеза всего белка оболочки. РНК-репликаза состоит из субъединиц R, S1, EF-Tu и EF-Ts (только S закодирована в фаге). Новосинтезированная S связывается с инициаторным участком белка оболочки и его репрессирует, что способствует разрешению конфликта между трансляцией и репликацией. Белок оболочки в свою очередь тоже не глупый и связывается с инициаторным участком белка S, репрессируя его. Цистрон А не может транслироваться до тех пор, пока не начнется репликация РНК фага MS2. Его участок инициации «спрятан» за счет вторичной и третичной структур интактной РНК. Белок A успевает протранслироваться в то время, когда начинается синтез молекул (+) РНК на (-) РНК (отсылка к вирусе, надеюсь, помните всё это), когда последовательность А белка уже появилась, но не успела собраться в компактную структуру. В ходе экспрессии РНК наблюдается трансляционная репрессия, трансляционное сопряжение через открывание RBS путем трансляции предыдущего цистрона, трансляционное сопряжение через ре-инициацию, а также сопряжение трансляции (цистрона А) с репликацией.
33. Регуляция синтеза рибосомных белков. (Бейлин) Модель координированной регуляции синтеза всех рибосомных белков. Модель основана на идее о конкуренции между рибосомной РНК и мРНК за связывание с «сердцевинными» рибосомными белками. Такие белки, как S4, S7, S8, LI, L4, а также белковый комплекс L10 • (L7/Ы2)4, имеют сильное сродство к специфическим местам прикрепления на рибосомных РНК, и поэтому по мере их синтеза они немедленно вовлекаются в процесс сборки рибосомных частиц, связываясь с 16S и 23S РНК соответственно. Собственное высокое сродство к рибосомной РНК и кооперативность сборки рибосомных частиц с участием других рибосомных белков приводят к уводу всех появляющихся свободных рибосомных белков в процессе сборки на рибосомные РНК. В этих условиях мРНК оказываются не конкурентоспособными, не связывают рибосомные белки и могут нормально транслироваться. Однако когда рибосомных белков становится больше, чем доступной рибосомной РНК, появляется их избыток в свободном состоянии. Это приводит к связыванию соответствующих ключевых белков со своими мРНК, давая в результате ингибирование инициации и репрессию трансляции. Строго последовательная трансляция полицистронных мРНК, кодирующих ряд рибосомных белков, делает возможным существование только одного репрессорного белка и одного места его действия на каждую мРНК для координированной репрессии трансляции всего ряда кодируемых белков. Этот простой механизм обеспечивает прямую регуляторную связь между сборкой рибосом и синтезом*рибосомных белков.
34. Регуляция трансляции аптамерными модулями мРНК («рибопереключения»). (Сивкова). Гл. 15 У прокариот существуют примитивные, реликтовые механизмы подавления или активации трансляции низкомолекулярными лигандами, без участия белков. Эти механизмы основаны на взаимодействии небелковых лигандов (метаболитов или кофакторов) со специфическими лиганд-узнающими структурами самой мРНК в районе RBS или рядом. Аптамеры - синтетические короткие РНК, специфически узнающие низкомолекулярные лиганды. Аптамерные операторы - природные лиганд-узнающие структуры в составе мРНК, ответственных за регуляцию трансляции этих мРНК. Так же их называют «рибопереключатели» (riboswitches). Суть в том, что метаболит или кофактор связывается со структурным доменом (аптамерным модулем) в 5-НТО мРНК, расположенной рядом с RBS или перекрывающейся с RBS, и его связывание индуцирует формирование или перестройку вторичной структуры, приводящей к недоступности RBS для инициирующих рибосом. Имеются и обратные примеры, когда в отсутствие метаболита инициация трансляции блокирована наличием шпильки, а связывание метаболита приводит к разрушению шпильки и освобождению RBS. Примеры: механизмы подавления инициации трансляции мРНК, кодирующих ферменты синтеза витаминных кофакторов - тиамина (В1), рибофлавина (В2), кобаламина (В12) – самими этими витаминами. Эффект активации трансляции при связывании аптамерного модуля с метаболитом можно наблюдать в случае трансляционной регуляции пуринового метаболизма. В отсутствии аденина как последовательность Шайна-Дальгарно, так и инициаторный кодон AUG находятся в составе длинной шпильки и закрыты от взаимодействия с рибосомной частицей. Связывание аденина с уридиловым остатком (U74) на стыке двух шпилек стабилизирует альтернативную структуру с замкнутым А-связывающим карманом, в результате чего участок цепи 75-83 оказывается спаренным с 5¢-концевым участком мРНК, а прежняя длинная шпилька дестабилизируется и исчезает, освобождая RBS для связывания с рибосомой.
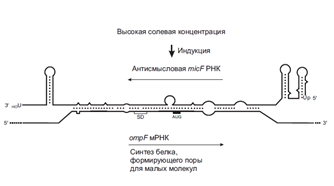
Важно сказать, что специфические последовательности в 5-НТО, которые формируют аптамерные модули, очень консервативны в эволюционном смысле. Примитивные способы «рибопереключений» могут быть основаны просто на физических свойствах РНК и происходить без участия лигандов. Например, термосенсорные модули в районах RBS мРНК, кодирующих факторы вирулентности некоторых патогенных бактерий. RBS этих мРНК «спрятаны» во вторичной структуре, плавящейся при 37°С. Соответственно, эти мРНК транслируются только при попадании бактерий в теплокровный организм. 35. Регуляция трансляции антисмысловыми и комплементарными РНК (Шевелева). Еще более примитивным и, по-видимому, тоже реликтовым механизмом регуляции трансляции, иногда (хотя и редко) наблюдаемым у прокариот, является прямое использование молекул РНК, комплементарных участкам мРНК. Действительно, участки связывания рибосом (RBS) на мРНК могут быть блокированы путем взаимодействия с комплементарными РНК, называемыми в этих случаях антисмысловыми РНК. У бактерий известно несколько случаев такого блокирования RBS природными антисмысловыми РНК. Интересно, что транскрипты дополнительных генетических элементов, таких как плазмиды, транспозоны, а также бактериофаги, контролируются антисмысловыми РНК чаще, чем геномные мРНК, что, возможно, связано с реликтовой природой такого способа регуляции. Наиболее известный пример антисмысловой РНК, контролирующей трансляцию геномной РНК у E. coli – это так называемая micF РНК. Существуют два подвида этой РНК, длиной 93 и 174 нуклеотида. РНК регулирует синтез OmpF, белка внешней бактериальной мембраны, формирующего диффузионные поры для небольших молекул. Антисмысловые РНК (оба подвида) транскрибируются со специального хромосомного участка, удаленного от гена ompF; их транскрипция индуцируется повышенным осмотическим давлением среды. Эта РНК частично комплементарна RBS ompF мРНК, включая последовательность Шайна-Дальгарно и инициаторный кодон (рис. ниже).
Таким образом, продукция micF РНК, индуцированная высоким осмотическим давлением, приводит к ее комплементарному взаимодействию с ompF мРНК в районе RBS, что блокирует инициацию трансляции ompF мРНК. В результате в данных условиях происходит ингибирование синтеза белка OmpF в бактериальных клетках.
Синтез транспозазы, закодированной в последовательности IS10 транспозона Tn10, контролируется антисмысловой РНК под названием OUT (длиной 70 нуклеотидов). Однако, в данном случае антисмысловая РНК транскрибируется с района RBS самого гена транспозазы, но в направлении, противоположном направлению транскрипции мРНК транспозазы (рис. 15.18, см. промоторы pIN и pOUT).
Следовательно, OUT мРНК полностью комплементарна участку мРНК транспозазы (IN РНК), содержащему RBS, и, таким образом, блокирует связывание рибосом и инициацию трансляции на этой мРНК. Для некоторых мРНК бактериофагов и плазмид были описаны похожие способы регуляции их трансляции с помощью антисмысловых РНК, транскрибируемых с регулируемых генов в противоположном направлении. Существуют также и редкие примеры активации трансляции с помощью комплементарной («антисмысловой») РНК. Так, у Escherichia coli в нормальных условиях трансляция мРНК, кодирующей белок холодового шока RpoS, ингибирована из-за вовлечения RBS этой мРНК в стабильную шпилечную структуру. При низких температурах в клетках индуцируется синтез малой РНК - так называемой DsrA sRNA - которая частично комплементарна 5`-проксимальной цепи шпильки; образование двуспирального дуплекса между ними освобождает RBS мРНК и, таким образом, разрешает инициацию ее трансляции.
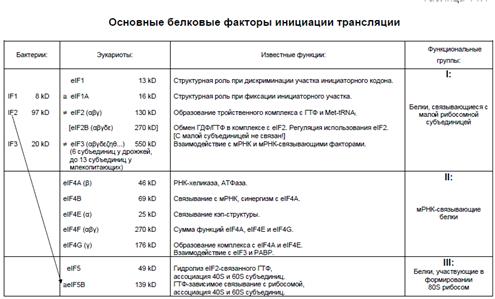
36. Особенности инициации трансляции у эукариот. Основные белковые факторы инициации трансляции (Шевелева). Существуют два основных способа инициации трансляции. Для первого способа необходим 5'-конец мРНК. Предполагается, что рибосома связывается с 5'-концом, а именно с кэпом, и затем начинает сканировать нуклеотидную последовательность в направлении к 3'-концу до тех пор, пока не дойдет до инициаторного кодона. Этот способ (так называемая 5’-терминальная инициация) используется преимущественно в клетках эукариот. Механизм включает в себя специальные белковые факторы для распознавания кэппированного 5'-конца, АТФ-зависимое расплетание спиралей мРНК в процессе сканирования 5'-нетранслируемой области, фиксацию рибосомы на инициаторном кодоне, и т.д.
Инициация начинается малой субъединицей рибосомы, которая связывается с участками связывания с рибосомой (RBS), способны избирательно привлекать малые рибосомные субъединицы для инициации трансляции. У эукариот это кэп-структура с прилегающей последовательностью. Преобладающий инициаторный кодон - AUG. Инициаторная аминоацил-тРНК – это всегда метионил-тРНК, которая не может участвовать в элонгации и не связывается с eEF1A. Наиболее важными свойствами инициаторной аминоацил-тРНК является то, что она не узнается фактором элонгации EF-Tu (или EF1A), а также то, что она имеет более сильное сродство к Р участку рибосомы, чем к А участку. Она формирует тройственный комплекс с фактором инициации 2 (eIF2) и ГТФ, а потом взаимодействует с рибосомой. Помимо eIF2, малая рибосомная субъединица взаимодействует с двумя другими факторами инициации: IF1 и IF3, или eIF1+ eIF1А и eIF3, у прокариот и эукариот, соответственно. еIF3 предотвращает ре-ассоциацию малой и большой субъединиц, поддерживая таким образом диссоциированное состояние, которое является компетентным к инициации.
У эукариот также существует группа мРНК-связывающих факторов инициации. Эта группа включает в себя белки eIF4A, eIF4B, eIF4E, eIF4F и eIF4G. Они не имеют аналогов в клетках прокариот и вовлечены в подготовку цитоплазматической мРНК (ее 5'-концевой некодирующей последовательности, 5'-НТО) к инициации. Также есть группа эукариотических факторов инициации eIF5, которые участвуют в финальном этапе инициации – ассоциации инициаторного комплекса 40S субъединицы с большой (60S) рибосомной субъединицей, приводящей к образованию транслируюшей 80S рибосомы.
Эукариотические факторы инициации могут быть условно разделены на три основные группы: (1) белковые факторы, связывающиеся и оперирующие с малыми рибосомными частицами (40S субъединицами) и обеспечивающие эффективное правильное связывание Met-тРНКi и мРНК, (2) белки, взаимодействующие в основном с мРНК и участвующие в подготовке ее 5-НТО к инициации, и белки, участвующие в ассоциации инициирующих рибосомных субъединиц и, таким образом, в формировании инициирующих 80S рибосом (таблица). Особняком стоит фактор инициации еIF2B, который не связывается ни с рибосомными частицами, ни с мРНК, но необходим для эффективного функционирования фактора еIF2 и регуляции его активности.
Особенности эукариотических мРНК, определяющие особенности инициации трансляции: моноцистронность, кэп на 5, нет последовательности Шайна-Дальгарно в мРНК, кэп и примыкающая к нему область - это RBS, формируют 43S инициаторный комплекс. Иногда вместо кэпа- 3¢-концевая шпилька гистоновой мРНК. На полирибосомах есть белок SLBP. Он действует подобно РАВР, формируя белковые мостики SLBP:eIF4G:eIF4Е и SLBP:eIF4G:eIF3 между 3¢-концом мРНК, с одной стороны, и ее кэппированным 5¢-концом и инициирующей 40S рибосомной субъединицей, с другой. 3*-НТО, поли(А)-хвост (усилитель трансляции, требует присутствия PABP), мРНК находится в комплексе с белками (мРНП), инициаторная тРНК не формилирована, как у прокариот (обладает рядом особенностей, позволяющих ей преимущественно взаимодействовать с Р участком на рибосоме, а не с А, например, усиленное взаимодействие между D и T петлями за счёт наличия там трёх А-остатков) Комплекс поли(А)-хвост:РАВР играет роль усилителя инициации, входя в прямой контакт с 5¢-концевым районом мРНК. Было показано, что именно сам белок - РАВР - взаимодействует с eIF4G-субъединицей в составе фактора инициации eIF4F. РАВР через взаимодействие с eIF4G обеспечивает механизм привлечения как мРНК-связывающих факторов инициации (eIF4F = eIF4G + еIF4A + eIF4Е), так и «нативных» 40S субъединиц к 5¢-концу мРНК.
37. АТФ-зависимое сканирование 5'-нетранслируемой области (5’-НТО). (Мартынова) Это направленное перемещение субъединиц 43S преинициаторного комплекса по 5’-НТО в направлении от 5’ кэп-структуры к 3‘-концу мРНК в поисках инициаторного кодона (трансляции) при участии факторов eIF4A, eIF4B, eIF4F. Одна из субъединиц eIF4F - eIF4A - АТФ-зависимая РНК-хеликаза, расплетает 5’-концевые элементы вторичной структуры мРНК (шпильки). Это классическая модель «бесфазного блуждания»: поиск инициаторного кодона рибосомной субчастицей происходит посредством АТФ-независимой одномерной диффузии по цепи мРНК. (Если принять, что действие АТФ-зависимых хеликаз является неспецифическим и ненаправленным). Другая модель: 5'→3' направленное движение инициирующего рибосомного комплекса вдоль 5'-НТО, для чего энергия требуется сама по себе, независимо от проблемы расплетания вторичной структуры (т.к. энергетически независимое движение нарушает второй закон ТД). Механизм такого движения быть реализован с помощью АТФ-зависимого устройства типа Броуновского храповика (энергетически зависимое ограничение обратных диффузионных движений, тогда как диффузия вперед разрешена). Схема процесса:
В отличие от прокариот, инициаторные кодоны эукариотических мРНК обычно расположены на некотором (иногда значительном) расстоянии от первичного участка связывания рибосомной частицы. В процессе движения 43S преинициаторный комплекс «сканирует» нуклеотидную последовательность до тех пор, пока не «найдет» триплет AUG - инициаторный кодон. Иногда первый триплет AUG не является инициаторным; тогда инициация происходит на втором или третьем (или следующем) AUG, не обязательно находящимся в одной рамке считывания с предыдущими. Предполагается, что когда инициирующая 40S частица сканирует матрицу, она преимущественно узнает последовательность PuNN AUG (Pu- пурин, N – любой нуклеотид) в качестве корректного участка инициации. Триплеты AUG с предшествующим триплетом PyNN являются «слабыми» инициаторными кодонами и могут быть пропущены 40S субъединицей без инициации. Функциональным инициаторным кодонам чаще всего сопутствует G с 3¢-конца и С-богатый пентануклеотид с 5'-конца (CCACCAUGG - «сильный» иниицаторный участок с триплетом AUG внутри). Феномен «двух точек инициации» (среди вирус-индуцированных мРНК): первый “слабый” инициатор - триплет AUG - распознается как инициаторный частью сканирующих рибосом, остальные рибосомы пропускают его без инициации и инициируют трансляцию на следующем, «сильном» AUG в другой рамке считывания. В этих случаях мРНК - функционально бицистронная: синтез двух различных полипептидов инициируется и происходит на перекрывающихся нуклеотидных последовательностях. Случаи альтернативной инициации: когда в одной рамке считывания синтезируются функционально идентичные (или близкие по функциям) изоформы одного и того же белка с несколько разной длиной цепи. Эукариотический механизм инициации более строг по отношению к структуре инициаторного триплета, чем у прокариот: AUG является практически единственным триплетом эукариотических мРНК, используемым как инициаторный кодон. Случаи старта с других триплетов, таких как GUG, UUG, CUG и ACG, чрезвычайно редки.
38. Особенности инициации трансляции вирусных РНК (IRESs, ITAFs, polyproteins) Шевелева. IRES (internal ribosome entry sites) = «внутренние участки посадки рибосом», отвечают за механизм внутренней инициации. IRES свойственны в основном вирусным РНК, особенно хорошо изучен механизм у пикорнавирусов. У клеточных мРНК структурных модулей, типичных для вирусных IRES-структур, пока не обнаружено. Примерами наиболее изученных клеточных мРНК с внутренней инициацией являются мРНК Antennapedia из Drosophila, определяющая важные моменты в процессе развития мухи, и так называемая BiP мРНК млекопитающих, кодирующая белок шаперонного типа, связывающийся с тяжелыми цепями иммуноглобулина (GRP 78). Структуры IRES у разных вирусных РНК разнообразны. Типичный пикорнавирусный IRES представляет собой последовательность длиной около 450 нуклеотидных остатков. Этот участок РНК формирует вторичную и компактную трехмерную структуру, имеющую сродство непосредственно к инициирующей 40S рибосомной частице. Схематическое представление вторичной структуры IRES двух пикорнавирусов – вируса полиомиэлита и вируса энцефаломиокардита – дано на рис. 14.10.
На своем 3-проксимальном участке IRES РНК пикорнавирусов несут консервативный олигопиримидиновый тракт (у некоторых из них здесь можно видеть последовательность UUUCC, комплементарную 3-концевой полипуриновой последовательности GGAAC 18S РНК 40S рибосомной субъединицы). Вслед за полипиримидиновым трактом идет также неструктурированный район – так называемое стартовое окно, в котором на фиксированном расстоянии 20-25 нуклеотидов от олигопиримидинового тракта расположен триплет AUG. Этот триплет и узнается инициирующей рибосомной частицей, связанной с IRES. Этот AUG не всегда выступает в роли инициаторного кодона, иногда рибосомные частицы начинают сканирование мРНК и трансляция инициируется на втором старт-кодоне. ITAFs. В ряде случаев для кэп-независимой инициации на внутренних участках посадки рибосом (IRES), в дополнение к набору обычных факторов инициации (eIF2, eIF3, eIF4F), необходимы специальные IRES-связывающие белки ITAFs (“IRES Trans-Acting Factors”). РТВ (Pyrimidine Tract-Binding protein, или р57) – это РНК-связывающий белок, имеющий специфическое сродство к IRES всех пикорнавирусных РНК. Этот белок является либо обязательным для инициации трансляции пикорнавирусных РНК, либо стимулирует ее. Скорее всего, белок связывается со структурированными участками пикорнавирусных IRES, тем самым стабилизируя специфическую активную конформацию IRES. РТВ оказался идентичен ядерному белку, который предпочтительно связывается с полипиримидиновыми трактами вблизи 3'-концов интронов пре-мРНК. Этот белок принадлежит к семейству РНК-связывающих белков с четырьмя РНК-связывающими доменами (RBD). Данных об участии РТВ во внутренней инициации клеточных мРНК на сегодняшний день не существует. «La антиген» (или р52) – это белок, способный специфически связываться с 3'-концевым доменом полиовирусного IRES и осуществляющий стимуляцию инициации трансляции полиовирусной РНК, а также увеличивающий точность выбора правильного инициирующего кодона на ней. Белок идентичен человеческому La антигену, выявленному ранее из клеток некоторых пациентов с аутоиммунными заболеваниями. Он содержит типичный РНК-узнающий мотив типа RNP-1. PCBP-2 (“Poly(rC) Binding Protein-2”). Как и РТВ, он также содержит несколько РНК-связывающих доменов и, по-видимому, стабилизирует активную структуру IRES благодаря многоточечным контактам с ним. eIF-независимые IRES. Наряду с IRES, для функционирования которых требуются клеточные белки – прежде всего, классические факторы инициации, а также в ряде случаев дополнительные факторы (ITAFs),- существует IRES, частично или полностью не зависимые от клеточных факторов инициации. Классический пример - IRES РНК вируса гепатита С (HCV). Длина участка полинуклеотидной цепи около 350 нуклеотидных остатков. Участок образует две длинные и несколько коротких шпилек, свернутых в третичную структуру. Эта структура способна специфически связываться с рибосомной 40S субъединицей. Инициаторный кодон, расположенный на 3-конце IRES, оказывается в непосредственной близости от Р участка малой субъединицы. Последующее взаимодействие с тройственным комплексом Met-tRNAi:eIF2:GTP приводит к посадке Met-тРНКi в Р участок, образованию там кодон-антикодоновой пары с инициаторным кодоном AUG и, таким образом, к формированию 48S инициаторного комплекса. Никакого участия АТФ и его гидролитического расщепления здесь не требуется. Естественно, что в условиях in vivo на инициирующей 40S субъединице всегда присутствует eIF3, но он не мешает образованию комплекса IRES:40S субъединица. Таким образом, в данном случае инициация не зависит от всех факторов группы eIF4.
39. Трансляционная репрессия эукариотических мРНК. (Рафаева) белок-репрессор должен связаться с оператором в 5’-HTO участке мРНК и стабилизировать его (обр-е шпильки), что может привести к репрессии за счёт следующих механизмов: 1) блок начального взаимодействия 40S субъединицы с последовательностью, примыкающей к кэпу на примере мРНК Fe3+ связывающего белка ферритина белок-репрессор 98 кДа, узнаёт участок в 28н. IRE (iron responsive element), расположенный рядом с кэпом. За счёт фланкирующих участков по бокам от IRE возможно обр-е шпильки. Регуляция трансляции зависит от присутствия/отсутствия ионов Fe.
Другой механизм: шпилька может быть и исходно. Таким образом область 5’-НТО может за счёт своей вторичной конформации ингибировать инициацию транскрипции. Репрессор, соединяясь с ней при посадке рядом, может стабилизировать это состояние, защищая от действия хеликаз (плавления) >> 43S суб не может сесть Этот механизм осуществляется у мРНК орнитиндекарбоксилазы: в клетках, где всегда высокий уровень синтеза этого фермента первого этапа синтеза полиаминов, нет белка-репрессора, в других есть 2) блок продвижения сканирующего рибосомного комплекса в направлении участка инициации 3) блок доступности инициаторного кодона для рибосомного инициаторного комплекса За счёт создания барьера: мРНК тимидилатсинтазы - кодон инициации спрятан в шпильке 5’-НТО (образована 30н на расстоянии 80 нуклеотидов от кэпа) по принципу обратной связи ингибируется продуктом трансляции *через воздействие на eIF4Е может осуществляться также и мРНК-специфическая регуляция инициации трансляции. Так, одним из наиболее распространенных способов специфического «выключения» определенных мРНК в цитоплазме в процессе эмбриогенеза является ингибирование их инициации трансляции через блокирование кэп-связывающего белка eIF4E при посредстве «маскирующего элемента» их 3’-НТО и связывающегося с ним первичного маскирующего белка. За этим следует, как правило, присоединение к этому комплексу еще одного белка, обозначаемого как Maskin в случае Xenopus или Cup в случае дрозофилы. Будучи привязанными к 3’-НТО мРНК, Maskin (или Cup) являются eIF4E-связывающими белками. Таким образом, Maskin (или Cup), локализованный на 3’-НТО мРНК, взаимодействует с кэп-связыванным eIF4E данной мРНК и препятствует сборке инициаторного комплекса на 5’-конце.
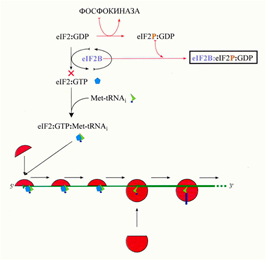
40. Тотальная негативная регуляция инициации трансляции эукариотических мРНК (eIF2-киназы, eIF4E-связывающий белок). (Рафаева) Влияет на общий уровень трансляции в клетке. В клетках животных и грибов основной способ - фосфорилирование eIF2-киназы, Met-тРНКi/ГТФ-связывающего фактора инициации. Оно происходит по серину в N-концевой части a-субъединицы eIF2 (Ser51). Одна из киназ носит название «гем-контролируемый репрессор» (HCR, Heme-Controlled Repressor), или «гем-регулируемый ингибитор» (HRI, Heme-Regulated Inhibitor): 90 кДа (625 аминокислотных остатков), представленный в растворимой (не связанной с рибосомами) димерной форме. Киназная активность индуцируется в ретикулоцитах и в цитоплазме ряда других клеток млекопитающих недостатком гема или железа, а также некоторыми другими воздействиями. Найдена также у других позвоночных животных и в грибах. Другая изученная киназа, под названием «ингибитор, активируемый двуцепочечной РНК» (DAI, Double-stranded RNA-Activated Inhibitor), или «рибосомная протеин-киназа» (PKR, Protein Kinase of Ribosomes), имеет в мономерной форме молекулярную массу 68 kDa (550 аминокислотных остатков) и ассоциирована с рибосомами. Синтез ее индуцируется в клетках млекопитающих интерфероном. Обнаруживается также в клетках других позвоночных. Третий тип был сначала открыт у дрожжей и обозначен по названию соответствующего дрожжевого гена - GCN2; затем оказалось, что она типична также для клеток млекопитающих и, возможно, даже для всех эукариот. Эта киназа – самая крупная из известных eIF2 киназ и представляет собой многодоменный белок с молекулярной массой мономерной полипептидной цепи около 180 kDa (около 1500 аминокислотных остатков); обнаруживается всегда в форме димера. Она активируется в ответ на голодание клетки, а более конкретно – на недостаток аминокислот. Также важную роль играет играет нерастворимая eIF2 киназа PERK (“ PKR-like ER Kinase ”), связанная с мембраной эндоплазматического ретикулума (ER) и активируемая при ряде стрессовых воздействий на клетку (ER stress). Это тоже крупный многодоменный белок; в мономер - около 140 kDa (1100 аминокислотных остатков). Киназные домены перечисленных eIF2 киназ обнаруживают значительную гомологию своих первичных и пространственных структур. В целом все четыре киназы представляют собой либо постоянные гомодимеры, либо они димеризуются при активации (хотя для киназы HCR были предложены модели ее активации как в форме димера, так и с сопутствующей диссоциацией на активные мономеры). Активация eIF2 киназ всегда сопровождается множественным фосфорилированием и автофосфорилированием самого фермента по сериновым и треониновым остаткам.
l eIF2 с фосфорилированной a-субъединицей способен формировать тройственный комплекс Met-тРНК: ГТФ:eIF2, который взаимодействует с рибосомными частицами, и в дальнейшем ходе инициации происходит нормальный гидролиз ГТФ с освобождением eIF2 и ГДФ l (eIF2aP:GDP) выходит из рибосомы и взаимодействует с eIF2B, формируется стабильный комплекс eIF2aP:eIF2B l eIF2B, присутствующий в клетке в ограниченных количествах, оказывается связанным в комплекс с белком eIF2aP >>> обмен ГТФ/ГДФ на eIF2 происходит медленно, и скорость инициации понижается, т.е. происходит негативная регуляция повторного использования eIF2
Для кэп-связывающих факторов, eIF4F и его субъединицы eIF4E, было показано, что их фосфорилирование или абсолютно необходимо для активности (фосфорилирование Ser53 в eIF4E), или оказывает сильный стимулирующий эффект (фосфорилирование субъединицы eIF4G в составе фактора eIF4F). Такое фосфорилирование, и в особенности фосфорилирование eIF4E по остатку Ser53, может регулировать общую скорость инициации эукариотической трансляции (т.к. eIF4E лимитирующий фактор инициации транскрипции). В то же время, основную роль в контроле уровня eIF4Е в клетке играет, по-видимому, не фосфорилирование самого фактора, а фосфорилирование специального eIF4Е-связывающего белка (4Е-ВР). Белок 4Е-ВР образует с eIF4Е неактивный комплекс, удаляя свободный активный фактор из среды.
Увеличение доступного количества лимитирующего фактора инициации (eIF4E и, следовательно, eIF4F) приводит не только к повышению общего уровня трансляции, но в этих условиях также начинают в значительной мере транслироваться «слабые» мРНК (к каковым относятся мРНК многих цитокинов и факторов роста), для трансляции которых ранее не хватало лимитирующих факторов инициации
41. Регуляция трансляции у эукариот: 3'-концевые инициаторы и усилители инициации. (Рафаева) Продукция белков в эукариотических клетках может регулироваться на нескольких уровнях, перечисленных ниже: 1) выдача закодированной в геноме информации в форме РНК, т. е. уровень транскрипции; 2) посттранскрипционная «перекройка» (процессинг) РНК и ее транспорт из ядра в цитоплазму; 3) считывание мРНК рибосомами, т.е. уровень трансляции; 4) деградация продукта трансляции; 5) деградация мРНК. 3'-концевые инициаторы и усилители инициации: 1. Поли-А-хвост 2. 3’-концевая шпилька гистоновой мРНК 3. Структурированные домены 3’-нетранслируемой области РНК растительных вирусов 4. Концевой тРНК-подобный домен РНК растительных вирусов
Известно несколько систем трансляционной регуляции у эукариот. Они могут быть подразделены на две группы: · системы тотальной регуляции общего уровня трансляции в клетке · системы специфического (избирательного по отношению к разным мРНК) контроля трансляции. Поли-А-хвост Наиболее изученным и универсальным 3'-концевым усилителем трансляции эукариотических мРНК является их поли(А)-«хвост». Усиливающий эффект поли(А)-«хвоста» состоит в том, что он прямо участвует в механизме инициации трансляции и увеличивает ее эффективность. Усиливающий эффект поли(А)-«хвоста» обязательно требует присутствия поли(А)-связывающего белка (РАВР) и его множественного (многокопийного) связывания с поли(А). Оказалось, что комплекс поли(А)-«хвоста» с РАВР играет роль усилителя инициации, входя в прямой контакт с 5'-концевым районом мРНК. Было показано, что именно сам белок — РАВР — взаимодействует с eIF4G-субъединицей в составе фактора инициации e1F4F. Так как усиливающий эффект поли(А)-«хвоста» в значительной мере зависит от присутствия кэп-структуры на 5'-кон-це, то считается, что молекулы РАВР, сидящие на «хвосте» и взаимодействующие с еIЕ4С-субъединицей фактора e1F4F, привлекают к себе кэпированный 5'-ко-нец мРНК путем его связывания с кэп-связывающей е1Е4Е-субъединиией фак-тора e1F4F, приводя к смыканию 5'-конца с поли(А)-«хвостом», т.е. к образованию так называемой «замкнутой петли» мРНК. С другой стороны, eIF4G имеет сродство к фактору eIF3 и может связываться с ним на инициирующей 40s рибосомной субъединице. Таким образом, РАВР через взаимодействие с eIF4G обеспечивает механизм привлечения как мРНК-связывающих факторов инициации (eIF4F =eIF4G + e1F4A + e1F4E), так и «нативных» 40s субъединиц к 5'-концу мРНК. Как результат роlу(А) • РАВР-стимулируемой инициации трансляции, в транс-лирующей полирибосоме начало и конец цепочки мРНК — ее 5'-нетранслируемая область с перманентно инициирующими 40s рибосомными субъединицами и поли(А)-«хвоста» — должны быть в постоянном динамическом взаимодействии друг с другом через образование белковых мостиков РАВР - eIF4G - eIFЗ - 40s, что приводит к «циркуляризации» полирибосом (рис. 14.16). Действительно, электронно-микроскопические наблюдения показывают, что сформированные эукариотические полирибосомы часто имеют кольцевую организацию. В случае крупных — «тяжелых» — полирибосом с плотно следующими друг за другом рибосомами иногда вместо колец (или наряду с ними) видны упорядоченные «двойные ряды» рибосомных частиц на мРНК, которые могут быть интерпретированы как спавшиеся (сложенные) кольца; возможно, такое складывание колец сопровождается также кратковременными (динамическими) взаимодействиями между рибосомными частицами антипараллельных рядов в определенной одно-типной ориентации. Следует отметить, что циркуляризация эукариотических полирибосом возможна и в случае мРНК без кэп-структуры и поли(А)-«хвоста». Не исключено, что циркуляризация может достигаться в результате складывания транслирующих полирибосом пополам и взаимодействия антипараллельных половинок друг с другом.
|
|||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1417; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.125.219 (0.076 с.) |