
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергией активации называют дополнительное количество кинетической энергии, необходимое молекулам вещества, чтобы они вступили в реакцию.
При достижении этого энергетического барьера в молекуле происходят изменения, вызывающие перераспределение химических связей и образование новых соединений. Говорят, что молекулы, обладающие Еа, находятся в переходном состоянии. Разницу энергий между исходным реагентом Н2СО3 и конечными соединениями Н2О и СО2 называют изменением свободной
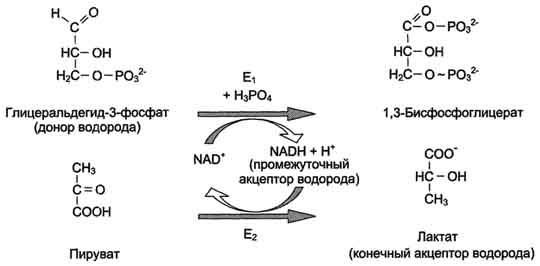
В механизме ферментативного катализа решающее значение имеет образование нестойких промежуточных соединений - фермент-субстратный комплекс ES, подвергающийся превращению в нестабильный переходный комплекс ЕР, который почти мгновенно распадается на свободный фермент и продукт реакции. Таким образом, биологические катализаторы (ферменты) не изменяют свободную энергию субстратов и продуктов и поэтому не меняют равновесие реакции (рис. 2-11). Фермент, выполняя функцию катализатора химической реакции, подчиняется общим законам катализа и обладает всеми свойствами, характерными для небиологических катализаторов, однако имеет и отличительные свойства, связанные с особенностями строения ферментов. Сходство ферментов с небиологическими катализаторами заключается в том, что: ферменты катализируют энергетически возможные реакции; энергия химической системы остаётся постоянной; в ходе катализа направление реакции не изменяется; Ферменты не расходуются в процессе реакции. Отличия ферментов от небиологических катализаторов заключаются в том, что: скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами; ферменты обладают высокой специфичностью; ферментативная реакция проходит в клетке, т.е. при температуре 37 °С, постоянном атмосферном давлении и физиологическом значении рН; Скорость ферментативной реакции может регулироваться. Молекулярные механизмы ферментативного катализа 1.стадия-образование ферментного комплекса E+S↔[ES] Стадия активации субстрата в ферм. – субстр. комлексе [ES] ↔ [ES]’ 3. стадия-образование ферментного комплекса [ES]’ ↔ [EP] Стадия-разложения ферм. Комплекса на ферм-е продукты [EP] ↔ E+P Продукты реакции образуются только при распаде фермент-субстратного комплекса. Необходимо отметить, что в образовании фермент-субстратного комплекса участвует несколько функциональных групп фермента, но только некоторые пары из них (субстрата и фермента) ответственны за ферментативный катализ, а другие группы служат для создания связи фермента с субстратом.
28.Уравнение скорости ферментативной реакции Михаэлиса и Ментен. Константа Михаэлиса (Км), определение, характеристика. Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативнойкинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
Где
Константа Михаэлиса, Км - кинетический параметр ферментативной реакции, численно равный
|
|||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 409; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.22.50 (0.005 с.) |
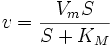 ,
, — максимальная скорость реакции, равная
— максимальная скорость реакции, равная  ;
; — константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной;
— константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной; — концентрация субстрата.
— концентрация субстрата.


