
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електрохімія. Поняття про електроди.
1. Електрохімія – розділ хімії, що вивчає процеси, які відбуваються на межі поділу двох фаз, наприклад метал-розчин, за участю заряджених частинок (іонів та електронів). В електрохімії електродом прийнято називати систему, що складається з речовини, яка проводить електричний струм, і розчину або розплаву електроліту, в який занурюється ця речовина. Найпростіший приклад електрода – метал, занурений у водний розчин солі цього металу, наприклад нікелева пластинка. занурена в розчин нікол (ІІ) хлориду. В електрохімії використовуються так звані стандартні електроди. Робота цих електродів відбувається за стандартних умов: температурі 298К, тиску 101 325 Па і концентрації йонів у розчині 1 моль/л. Якщо з усього ряду стандартних електродних потенціалів виділити тільки ті електродні процеси, які відповідають загальному рівнянню Mez+ + ze → Me То дістанемо ряд напруг металів. У цей ряд завжди ставлять крім металів також водень, що дає змогу бачити, які метали здатні витісняти водень з водних розчинів кислот. Положення того чи іншого металу в ряді напруг характеризує його здатність до окислювально-відновних взаємодій у водних розчинах за стандартних умов. Кожний електрод має певне значення електричного потенціалу. Абсолютне значення електричного потенціалу електрода визначити неможливо. Можливо лише порівняти потенціали різних електродів один за одним. 2. Для порівняння електричних потенціалів складають коло з двох електродів. один з яких – стандартний водневий. Для цього металічні частини сполучають провідником, а розчини електролітів, у які вони занурені, сполучають скляною трубкою, заповненою електролітом. Ця трубка з електролітом, що зветься сольовим містком, забезпечує йонну провідність між розчинами. Таким чином дістанемо замкнене електрохімічне коло або гальванічний елемент. Пристрої, які застосовують для безпосереднього перетворення енергії хімічної реакції в електричну енергію, називають гальванічними елементами (хімічними джерелами електричної енергії). Хімічні джерела електричної енергії, у яких відбуваються практично оборотні реакції, називають акумуляторами. Ми вже знаємо, що при будь-якій ОВР відбувається перехід електронів від відновника до окисника. Так, якщо цинкову пластинку опустити в розчин сульфата купруму, то відбудеться реакція:
Zn + Cu2+ → Cu + Zn2+ Тут відновник – цинк – віддає електрони. Ця напівреакція виражається рівнянням: Zn – 2e → Zn2+ Окисник – йон купруму – приймає електрони. Рівняння цієї напівреакції: Cu2+ +2e → Cu У цьому прикладі обидві напівреакції відбуваються у місці стикання цинку з розчином, так що електрони безпосередньо переходять від атомів цинку до йонів купруму. Проте цю реакцію можна здійснити так, щоб окислювальна і відновна напівреакції будуть просторово розділені, а електрони переходитимуть від відновника до окисника не безпосередньо, а по провіднику електричного струму – по зовнішньому колу. Цей напрямлений потік електронів і є електричний струм. При такому здійсненні ОВР її енергія перетвориться в електричну енергію, яку можна використати, вмикаючи у зовнішнє коло відповідні прилади. У найпростішому випадку гальванічний елемент складається з двох металевих електродів, занурених у розчин електроліту. Мідно-цинковий гальванічний елемент Цей елемент складається з мідної пластинки, зануреної в розчин сульфату купруму(мідний електрод), і цинкової пластинки, зануреної в розчин сульфату цинку (цинковий електрод). Обидва розчини стикаються один з одним, але щоб вони не змішувалися, їх розділили перегородкою, виготовленою з пористого матеріалу.
Напрям руху йонів у розчині зумовлений електрохімічними процесами, що відбуваються біля електродів. Створюється електричне поле, у якому катіони в розчині рухаються від цинкового електрода до мідного, а аніони – у зворотному напрямі. В результаті рідина біля обох електродів лишається електронейтральною. Електрод, на якому відбувається окиснення, називається анодом (цинковий), тобто з більш негативним потенціалом, а електрод, на якому відбувається відновлення, тобто з менш негативним потенціалом називається катодом (мідний). А: Zn – 2e → Zn2+ окиснення К: Cu2+ +2e → Cu відновлення Основною характеристикою гальванічного елемента є його ЕРС – різниця електродних потенціалів у початковий момент роботи елемента (від більш позитивного електродного потенціалу віднімають більш негативний)
Е = φк- φа Під час записування схем гальванічних елементів звичайно зліва записують електрод з більш негативним значенням потенціалу. а справа – з більш позитивний: Zn│ Zn2+││Cu2+│Сu 3. Внаслідок вивчення потенціалів різних електродних процесів установлено, що їхні величини залежать від таких трьох факторів: 1) природи речовин 2) співвідношення між концентраціями цих речовин 3) температури системи Рівняння Нернста:
φ0 – стандартний електродний потенціал певного процесу; R – газова стала; T – абсолютна температура; z – число електронів; F – число Фарадея; [Ox] і [Red] – добутки концентрацій речовин, що беруть участь у процесі в окисленій (Ox) і відновленій (Red) формах. Контрольні запитання:
Література:
Тема 4.2. Електроліз План Поняття про електроліз.
1. Електролізом називається сукупність процесів, що відбуваються при проходженні постійного електричного струму через електрохімічну систему, яка складається з двох електродів і розплаву або розчину електроліту. Біля катоду (негативно заряджений) відбувається відновлення, а біля аноду (позитивно заряджений) відбувається окиснення. 2. Електроліз розплавів солей: біля катоду відбувається відновлення металу, а біля аноду окиснення кислотних залишків. Пр.: електроліз розплаву MgCl2 K: Mg2+ + 2e → Mg A: 2Cl- - 2e → Cl2 3. Електроліз водних розчинів солей: На катоді: 1) відбувається процес відновлення металу, якщо метал в ЕХРН знаходиться після Н2 (потенціал> -0.41): 2) відбувається процес відновлення води, якщо метал в ЕХРН знаходиться до Al (потенціал<-0.41): 2H2O + 2e → H2 + 2OH- 3) одночасно відбувається відновлення води та металу, якщо метал в ЕХРН знаходиться від алюмінію до водню. На інертному аноді (матеріал якого не зазнає окиснення під час електролізу (графіт, вугілля, платина)): 1) під час електролізу водних розчинів лугів, оксигеновмісних кислот та їх солей відбувається окиснення води з виділенням кисню. 2H2O - 4e → O2 + 4H+ 2) під час електролізу водних розчинів безоксигеновмісних кислот і їх солей відбувається окиснення кислотного залишку (крім фторидів) На активному аноді може відбуватися один з трьох процесів – окиснення води з виділенням кисню, окиснення кислотного залишку, окиснення металу анода. Якщо метал анода розміщений в ряду стандартних потенціалів раніш від обох інших процесів, то спостерігатиметься анодне розчинення металу. Пр.: a) електроліз водного розчину К2SO4 K: 2H2O + 2e → H2 + 2OH- A: 2H2O - 4e → O2 + 4H+
б) електроліз водного розчину NiSO4 K: Ni2+ + 2e → Ni 2H2O + 2e → H2 + 2OH- A: 2H2O - 4e → O2 + 4H+ 4. Закони електролізу (закони Фарадея): 1)Маса речовин, що утворюється під час електролізу, пропорційна кількості електрики, яка пройшла крізь розчин.
де Q - кількість електрики; F - стала Фарадея; νекв - кількість еквівалентів речовини, що виділилася на електроді; I - сила струму; t - час електролізу 3) при проходженні однієї і тієї ж кількості електрики крізь розчини різних електролітів маси речовин, які виділяються на електродах, прямо пропорційні еквівалентним масам цих речовин.
5. Застосування електролізу: 1) в металургії електролізом розплавів і розчинів солей добувають метали, а також проводять електролітичне рафінування – очищення металів від шкідливих домішок і вилучення цінних компонентів. 2) у гальванотехніці: - гальваностегія – нанесення за допомогою електролізу на поверхні металевих виробів шарів інших металів для захисту від корозії, для декоративних цілей, а також для надання їхній поверхні твердості; - гальванопластика – процес виготовлення точних металічних копій з рельєфних предметів електроосадженням металу. 3) у хімічній промисловості за допомогою електролізу добувають фтор, хлор, їдкий натр, водень і кисень, пероксид гідрогену. Контрольні запитання:
Література:
Тема 4.3. Корозія металів План
|
|||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 408; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.1.136 (0.021 с.) |

 , де
, де або
або 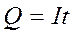 ,
,



