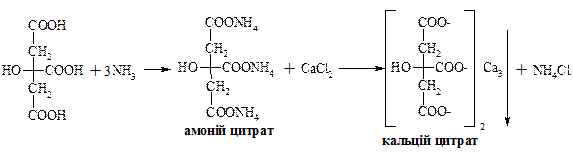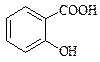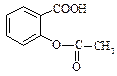Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Доброякісності. Добування йодоформу.Стр 1 из 6Следующая ⇒
О.М Семенюк
ЗМІСТ
1. ПРАКТИЧНЕ ЗАНЯТТЯ №1. Вивчення номенклатури, ізомерії та властивостей алканів. 2. ПРАКТИЧНЕ ЗАНЯТТЯ №2. Вивчення номенклатури, ізомерії та властивостей ненасичених вуглеводнів. 3. ПРАКТИЧНЕ ЗАНЯТТЯ №3. Галогеновуглеводні. Добування хлороформу та перевірка його доброякісності. Добування йодоформу. 4. ПРАКТИЧНЕ ЗАНЯТТЯ №4. Вивчення властивостей спиртів та фенолів. 5. ПРАКТИЧНЕ ЗАНЯТТЯ №5. Добування та вивчення властивостей альдегідів. 6. ПРАКТИЧНЕ ЗАНЯТТЯ №6. Карбонові кислоти. Вивчення властивостей оцтової, бензенової та щавлевої кислот. 7. ПРАКТИЧНЕ ЗАНЯТТЯ №7 Аміни. Азо- та діазосполуки. Азобарвники. Діазотування стрептоциду. Одержання азобарвника. 8. ПРАКТИЧНЕ ЗАНЯТТЯ №8. Гетерофункціональні кислоти. Вивчення властивостей винної, лимонної та саліцилової кислот. 9. ПРАКТИЧНЕ ЗАНЯТТЯ №9. Вивчення властивостей вуглеводів.
ПРАКТИЧНЕ ЗАНЯТТЯ №1 ТЕМА: Вивчення номенклатури, ізомерії та властивостей алканів. Теоретичні питання, які виносяться на практичне заняття 1. Які вуглеводні називають аліфатичними? Класифікація аліфатичних вуглеводнів. 2. Які вуглеводні відносять до групи алканів? 3. Дайте визначення гомологічного ряду. Наведіть приклади гомологів для алканів. 4. Що таке гомологічна різниця? Назвіть її для алканів. Загальна формула ряду алканів. 5. Структурна ізомерія. Наведіть приклади. 6. Які атоми карбону називають первинними, вторинними, третинними та четвертинними? 7. Тетраедрична структура атома карбону: sр3 -гібридизація, s-зв'язок. 8. Нормальний валентний кут. Молекулярна модель. 9. Поняття про конформації. Їх види. Конформери. Розрахунково-практичні завдання 1. Складіть формули ізомерних сполук та назвіть їх для складу С4Н8Сl2 2. Використовуючи правила систематичної номенклатури назвіть такі алкани:
3. За назвами напишіть структурні формули вуглеводнів: 2-метилгексан; 2,4-диметилгексан; З-етил-2,4-диметилпентан; 2-хлороктан. 4. Визначте молекулярну формулу алкану, масова частка Карбону в якому становить 83,4%. 5. Який об'єм газу (н.у.) виділиться при сплавлянні 30 г ацетату натрію та 15 г гідроксиду натрію? 6. Визначте невідомі речовини, вкажіть їх назви і складіть рівняння реакцій, за якими можна здійснити такі перетворення:
ПРАКТИЧНЕ ЗАНЯТТЯ №2 ТЕМА: Вивчення номенклатури, ізомерії та властивостей ненасичених вуглеводнів. Теоретичні питання, які виносяться на практичне заняття 1. Які вуглеводні називають ненасиченими? Класифікація ненасичених вуглеводнів. 2. Які вуглеводні відносять до групи алкенів? Загальна формула гомологічного ряду етиленових вуглеводнів. 3. Алкіни. Загальна формула гомологічного ряду ацетилену та його гомологів. 4. Стан гібридизації атомів Карбону та види зв’язків у молекулах ненасичених вуглеводнів. 5. Структурна та просторова ізомерія алкенів. Наведіть приклади. 6. Ізомерія алкінів. 7. Що таке елімінування? Запишіть загальну схему цього процесу. 8. Які ви знаєте види реакцій елімінування? Наведіть приклади. 9. Правило Зайцева та правило Марковнікрва. Сфери їх застосування. 10. Поняття про алкадієни. Розрахунково-практичні завдання 1. Назвіть за систематичною номенклатурою дані вуглеводні та визначте: a) вид гібридизації кожного атома карбону; b) кількість s- та p- зв’язків; c) первинний, вторинний, третинний та четвертинний атоми карбону; d) запишіть та назвіть просторові ізомери, якщо вони існують.
2. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення. Вкажіть умови їх протікання і назвіть вихідні речовини та кінцеві продукти. a) Кальцій карбід ® ацетилен ® етен ® етін → бензен b) Етан → етен ® етанол ® етен ® етиленгліколь c) Пропан → пропен ® пропанол-2 ® пропен ® поліпропілен 3. Використовуючи правила систематичної номенклатури назвіть такі вуглеводні:
4. За назвами напишіть структурні формули вуглеводнів: 3,4-диметилгексин-1; 2,5-диметилгептин-3; 3,3-диметилпентин-1 3-ізопропіл-4-метилгексин-1; 3-метилпентен-2; 2,3,4-триметилгексен-2 4,4-діетилгексен-1; 2,5-диметил-3-ізопропілгептен-2 5. Запишіть реакцію гідратації бутену-1. 6. Напишіть схему послідовного приєднання 2 моль хлороводню до пентину-1. Назвіть проміжний та кінцевий продукти. ПРАКТИЧНЕ ЗАНЯТТЯ №3 Галогеновуглеводні Трихлорметан (хлороформ) Трихлорметан (хлороформ) CHCl3 ¾ безбарвна важка речовина з солодкуватим запахом. Не горить. На світлі під дією світла повільно розкладається з утворенням хлороводню та високотоксичної речовини – ф о с г е н у, який далі може розкладатися до оксиду карбону (IV) та молекулярного хлору.
Тригалогензаміщені метану СНСl3 (хлороформ, йодоформ та бромоформ), які називають г а л о ф о р м и, отримують дією вільних галогенів на етанол в лужному середовищі.
В молекулах ацетальдегіду атоми гідрогену стають більш реакційноздатними, ніж в молекулі етанолу та легко заміщаються на хлор з утворенням трихлорацетальдегіду (хлоралю). Під дією лугу хлораль легко перетворюється на хлороформ та сіль мурашиної кислоти (форміат). Хлороформ можна визначити за характерним запахом.
Медичний хлороформ зберігають в невеликих склянках із темного скла (через дію світла) та щільно закритих (без доступу повітря). На наявність у хлороформі домішок фосгену може вказувати присутність хлороводню, який утворюється одночасно з фосгеном. Хлороводень можна виявити за допомогою розчину нітрату аргентуму (буде випадати білий осад хлориду аргентуму). А наявність вільного хлору, що утворюється по другій стадії розкладу хлороформу, можна перевірити за допомогою йодиду калію з наступним виявленням вільного йоду якісною реакцією з розчином крохмалю. Хлороформ досить активний наркотичний засіб. В Росії вперше був застосований для наркозу в 1848р. відомим хірургом М. І. Пироговим.
Трийодметан (йодоформ). Трийодметан (йодоформ)СНІ3 – тверда речовина жовтуватого кольору з різким запахом. Практично нерозчинний у воді, погано розчиняється в спирті, розчинний в ефірі та хлороформі. Застосовується як антисептичний засіб у вигляді мазей та присипок. Подібно до хлороформу, йодоформ отримують дією вільних галогенів (в даному випадку йоду) на етанол в лужному середовищі.
ТЕМА: Добування хлороформу та перевірка його I. Виконання дослідів II. Оформлення результатів Результати спостережень оформляють вкінці кожного досліду, відповідно до запитань. III. Висновок У висновку підбиваються підсумки роботи та узагальнюються результати досліджень.
Завдання для контролю кінцевого рівня знань
1-хлорпропану. Опишіть механізм та назвіть продукт реакції.
ПРАКТИЧНЕ ЗАНЯТТЯ №4 Спирти та феноли ЕТАНОЛ (етиловий спирт) C2H5OH ¾ безбарвна рідина зі слабким запахом, легкозаймиста. Змішується з водою у різних співвідношеннях. Вживання етанолу навіть в невеликих кількостях веде до зниження чутливості органів чуття, викликає сильне подразнення ЦНС. Широко використовується в промисловому органічному синтезі. У фармації застосовується для приготування настоянок та екстрактів; в медичній практиці ¾ як зовнішній антисептичний засіб для дезинфекції рук та хірургічних інструментів. Безводний (абсолютний) спирт кипить при 78,37 °С. Отриманий у промисловості спирт-ректифікат являє собою суміш 95,6 % етанолу та 4,4 % води, яка кипить при постійній температурі ¾ 78,15 °С (суміші певного складу, які киплять при постійній температурі, називають азеотропними сумішами). Основний промисловий спосіб добування етанолу ¾ гідратація етилену під тиском (за правилом Марковнікова).
Етанол належить до первинних спиртів і окислюється до оцтового альдегіду, який в свою чергу може окислитися до оцтової кислоти. Окиснення проводять сильними окисниками ¾ біхроматом або перманганатом калію в присутності сульфатної кислоти.
При взаємодії гідроксиду купруму (ІІ) з гліцерином та іншими багатоатомними спиртами утворюється комплексна сполука синього кольору (відбувається розчинення гідроксиду). Цією реакцією часто користуються для якісного виявлення багатоатомних спиртів.
ФЕНОЛ (гідроксибензен) C6H5OH
ГІДРОХІНОН (1,4-дигідроксибензен)
ПІРОКАТЕХІН (1,2-дигідроксибензен)
Пірокатехін використовують для добування адреналіну – гормону, що виробляється наднирниками. Адреналін є одним найважливіших регуляторів життєдіяльності організму. Це перший гормон, що вдалося виділити синтетично (1908р.). З хлоридом феруму (ІІІ) пірокатехін дає зелене забарвлення. РЕЗОPЦИН (1,3-дигідроксибензен)
ТЕМА: Вивчення властивостей спиртів та фенолів. Обладнання: пробірки хімічні, штативи для пробірок, спиртівки, фільтрувальний папір. Реактиви: етиловий спирт, натрій гідроксид (10%), сульфатна кислота (розв.), калій біхромат(5%), купрум (ІІ) сульфат (2%), ферум (ІІІ) хлорид, гліцерин, фенол (3% водний розчин), пірокатехін (1%), резоцин (1%), гідрохінон (1%).
Це неохідно знати та вміти
Хід роботи I. Виконання дослідів II. Оформлення результатів Результати спостережень оформляють вкінці кожного досліду, відповідно до запитань. III. Висновок У висновку підбиваються підсумки роботи та узагальнюються результати досліджень. Завдання для контролю кінцевого рівня знань 1. Напишіть структурні формули спиртів складу С5Н11ОН 2. Напишіть структурні формули таких спиртів: 2-Метилгексанол-2; 2,2-Диметилбутанол-1; 2-Метилбутандіол-1,2; 3,4-Диметилпентанол-2; 2-Фенілгександіол-1,2; Гідрохінон, Пірокатехін, Резорцин, Гліцерин. 3. Закінчіть запропоновані схеми хімічних реакцій: a) пропанол + бромистоводнева кислота → b) окиснення бутанолу-1 c) етанол →(Н2SO4 140°C) d) внутрішньомолекулярна дегідратація бутанолу-2 4. Напишіть рівняння хімічних реакцій, за допомогою яких можна здійснити такі перетворення:
б) метанол → → метилпропіловий етер → алюміній метанолят в) етен → етанол → етен → йодетан → бутен-1 → бутанол (напишіть структурну формулу і дайте назву одержаного бутанолу) г) пропан→ фенол → фенолят натрію → Х → 2,4,6-трибромфенол
5. Як добути пропанол-1 з: пропену; 1-хлорпропану. Напишіть рівняння реакцій. 6. Порівняйте властивості фенолу та етанолу. Відповідь підтвердіть за допомогою рівнянь хімічних реакцій. 7. Для нейтралізації суміші етилового спирту та фенолу витратили 65,31 мл розчину натрій гідроксиду з масовою часткою лугу 20% (густина становить 1,225 г\мл). При взаємодії такої самої кількості вихідної суміші з надлишком натрію виділилось 6,72 л газу (н. у.). розрахуйте масові частки компонентів у вихідній суміші (%). ПРАКТИЧНЕ ЗАНЯТТЯ №5 Альдегіди та кетони Метаналь (формальдегід, мурашиний альдегід) Н-СН=О − безбарвний газ з різким запахом, добре розчинний у воді. Водний 35-40 % розчин формальдегіду називають формаліном. В промисловості формальдегід добувають окисненням метанолу киснем повітря в присутності каталізаторів (срібло або мідь).
При взаємодії формальдегіду з аміаком утворюється гексаметилентетраамін (уротропін). Ця сполука була вперше синтезована та вивчена А. М. Бутлеровим. При нагріванні розчину уротропіну в присутності кислоти він повільно гідролізує з утворенням вихідних сполук – формальдегіду та аміаку.
Уротропін застосовують для лікування захворювань сечових шляхів. Терапевтичний ефект полягає у дезінфікуючій дії формальдегіду, який виділяється при кислотному гідролізі уротропіну. В лужному середовищі уротропін стійкий, тому при лужній реакції сечі хворого уротропін не здійснює лікувального ефекту. Формальдегід використовують в якості вихідної сировини для отримання пластмас (фенолформальдегідних смол), а також для приготування мертвих противірусних вакцин. При тривалому зберіганні формаліну відбувається полімеризація та утворений полімер, параформ, випадає у вигляді білого осаду. Реакція полімеризації формальдегіду була відкрита та досліджена А. М. Бутлеровим. При нагріванні параформу в присутності кислот знову утворюється формальдегід. Припускають, що процесу полімеризації піддається гідрат формальдегіду.
Етаналь (ацетальдегід, оцтовий альдегід) СН3СН=О – безбарвна рідина з характерним запахом. Його отримують найчастіше окисненням етанолу. Використовують для добування оцтової кислоти та в якості вихідної сировини для синтезу багатьох органічних сполук. Аналогічно формальдегіду здатний до полімеризації в присутності кислоти. При полімеризації трьох молекул ацетальдегіду утворюється паральдегід, що являє собою рідину. При нагріванні в присутності кислот він деполімеризується з утворенням вихідного ацетальдегіду.
Паральдегід застосовується в медичній практиці як снодійний та заспокійливий засіб. ТЕМА: Добування та вивчення властивостей альдегідів. Обладнання: пробірки хімічні, штативи для пробірок, спиртівки, чашки Петрі. Реактиви: етиловий спирт, натрій гідроксид (10%), сульфатна кислота (розв.), калій біхромат (5%), купрум(ІІ) сульфат (2%), резоцин (1%), формалін, нітрат аргентуму (5%), розчин аміаку (10%), фенолфталеїн, фуксин.
Це необхідно знати та вміти
Хід роботи I. Виконання дослідів II. Оформлення результатів Результати спостережень оформляють вкінці кожного досліду, відповідно до запитань. III. Висновок У висновку підбиваються підсумки роботи та узагальнюються результати досліджень. Завдання для контролю кінцевого рівня знань 1. Напишіть структурні формули всіх можливих ізомерів альдегідів і кетонів складу: С5Н10О. 2. Напишіть структурні формули для вказаних карбонільних сполук: 2,3-Диметилбутаналь; 3,4-диметил-3-хлорпентаналь; пентанон-2 3. Які сполуки утворяться при окисненні метанолу купрум (ІІ) оксидом? 4. Як з оцтового альдегіду добути бромметан? Напишіть відповідні рівняння реакцій. 5. Складіть рівняння рекції окиснення пропаналю аміачним розчином оксиду аргентуму (І). 6. Як добути пропанон з: а) відповідного спирту; б) алкіну; в) дигалогенпохідного? 7. Розшифруйте наведені схеми реакцій: а) А + Н2О → ацетальдегід б) А + Б → пентаналь + 2А в) бутаналь + А → масляна кислота + Сu2O + Н2О 8. Як здійснити перетворення? а) Вуглець → А → ацетилен → А → Б → етаналь б) бутан → бутен → А → бутин-1 → бутанон-2 9. Як розділити суміш органічних речовин, що містить оцтовий альдегід, оцтову кислоту та фенол? Напишіть рівняння реакцій, які потрібно провести. 10. При окисненні 53,56 г одноатомного насиченого спирту оксидом купруму (ІІ) утворилося 46,11 г альдегіду. Масова частка виходу альдегіду становила 90%. Встановіть формулу спирту. ПРАКТИЧНЕ ЗАНЯТТЯ №6 Карбонові кислоти Оцтова (етанова) кислота СН3СООН ¾ відома з глибокої давнини, її 3-9% розчин (столовий оцет) використовують як смакову приправу та консервант. Консервуюча дія оцтової кислоти пов’язана з тим, що кисле середовище, яке нею створюється, перешкоджає розвитку бактерій та грибків. Оцтова кислота “ замерзає ” при 16°С, її кристали за зовнішнім виглядом нагадують лід, тому 100% оцтову кислоту називають “льодяною”. Солі і ефіри оцтової кислоти називають ацетатами. В промисловості оцтову кислоту одержують при каталітичному окисленні бутану киснем Великі кількості оцтової кислоти одержують шляхом окислення ацетальдегіду, який, в свою чергу, одержують окисленням етилену киснем повітря на паладієвому каталізаторі. Харчову оцтову кислоту одержують при мікробіологічному окисленні етанолу (оцтовокисле бродіння). Основну частину оцтової кислоти використовують для виробництва штучних волокон на основі целюлози. Ефіри оцтової кислоти використовують в якості розчинників лаків та фарб. Більшість ефірів та аміди оцтової кислоти використовують в медицині в якості лікарських засобів. Бензойна (бензенова) кислота С6Н5СООН.
Широко поширена в природі, міститься рослинних смолах, в ягодах – чорниці, клюкви, журавлини. Солі та ефіри бензойної кислоти називають бензоатами. В промисловості бензойну кислоту отримують окисленням толуолу киснем повітря в присутності каталізаторів – солей кобальту або оксиду ванадію (V). Застосовують як напівпродукт для синтезу лікарських сполук, пахучих речовин та барвників, а також в якості консерванту для харчових продуктів. Бензоат натрію використовують в медицині як відхаркуючий засіб. Щавлева (етандіова) кислота НООС – СООН. Широко поширена в рослинному світі. У вигляді солей міститься в листі щавлю, кислиці, ревеню. Солі та ефіри щавлевої кислоти мають тривіальну назву оксалати. В промисловості щавлеву кислоту одержують із форміату натрію:
Щавлева кислота проявляє в і д н о в н і властивості: в кислому розчині окислюється перманганатом калію до оксиду карбону (IV) і води. Ця реакція використовується в аналітичній хімії для виявлення точної концентрації розчинів перманганату калію. На відновних властивостях щавлевої кислоти базується спосіб видалення бурих плям від перманганату.
5НООС – СООН + 2КMnO4 + 3H2SO4 ® 10CO2 + K2SO4 + 2MnSO4 + 8H2O
При нагріванні в присутності сульфатної кислоти спочатку відбувається декарбоксилювання щавлевої кислоти, а потім розклад утвореної мурашиної кислоти.
I. Виконання дослідів II. Оформлення результатів Результати спостережень оформляють вкінці кожного досліду, відповідно до запитань. III. Висновок У висновку підбиваються підсумки роботи та узагальнюються результати досліджень.
Завдання для контролю кінцевого рівня знань 1. Напишіть структурні формули бромоцтової, дибромоцтової та трибромоцтової кислот. Яка з них насильніша і чому? 2. Напишітьть рівняння електролітичної дисоціації пропіонової кислоти. 3. Напишіть рівняння реакцій взаємодії таких речовин: a. пропіонова кислота + бром b. ацтат барію + сульфат натрію c. 2-метилпентанова кислота + метанол 4. Напишіть структурні формули таких кислот: 2-метилбутанова; 2-фенілгексанова; 2-етилгептандіова; бензенова. 5. У чотирьох пробірках містяться такі речовини: мурашина кислота, метанол, пропіонова кислота та оцтовий альдегід. За допомогою яких хімічних реакцій можна розпізнати ці речовини? На ведіть рівняння реакцій. 6. Напишіть рівняння хімічних реакцій, за допомогою яких можна здійснити такі перетворення:
б) етен→ацетилен →етаналь →Х→етилацетат в) бензойний альдегід → бензиловий спирт → бензойна кислота → етилбензоат 7. Яку карбонову кислоту можна добути з 1,1,1-трихлорбутану? Як це здійснити? Відповідь підтвердіть за допомогою рівняння хімічної реакції. ПРАКТИЧНЕ ЗАНЯТТЯ №7 Діазотування стрептоциду:
Реакція азосполучення:
ТЕМА: Діазотування стрептоциду. Одержання азобарвника.
Обладнанн: пробірки хімічні, штативи для пробірок, спиртівки, мікролопатки, пробіркотримачі. Реактиви: лід, дистильована вода, натрій гідроксид (10%), калій гідроксид, хлоридна кислота, стрептоцид, розчин крохмалю, фенол, нітрит натрію, універсальний індикаторний папір. Це необхідно знати та вміти
Хід роботи I. Виконання дослідів II. Оформлення результатів Результати спостережень оформляють вкінці кожного досліду, відповідно до запитань. III. Висновок У висновку підбиваються підсумки роботи та узагальнюються результати досліджень.
Завдання для контролю кінцевого рівня знань
3-бромбензендіазонійхлориду? Напишіть схему реакйії.
ПРАКТИЧНЕ ЗАНЯТТЯ №8 Гетерофункціональні кислоти Гідроксикислоти. Винна кислота (2,3-дигідроксибутандіова)
Змішаний калієво-натрієвий тартрат – сегнетова сіль – при взаємодії з купрум(ІІ) гідроксидом в лужному середовищі дає комплексну сполуку яскраво-синього кольору.
Винна кислота проявляє властивості, характерні для карбонових кислот, так і для спиртів. Лимонна кислота (2-гідроксипропан-1,2,3-трикарбонова кислота)
Цитрат натрію використовують для консервування донорської крові. Протизгортальна дія базується на тому, що цитрат натрію зв’язує йони кальцію, які приймають участь у процесі згортання, у нерозчинний цитрат кальцію.
Фенолокислоти Саліцилова кислота (2-гідроксибензенова кислота)
Саліцилова кислота має два центри кислотності – карбоксильну групу та фенольну групу. Вона володіє сильними кислотними властивостями. Ацетилсаліцилова кислота (аспірин) – одержують ацилюванням саліцилової кислоти оцтовим ангідридом, це складний ефір саліцилової кислоти.
При взаємодії саліцилової кислоти з хлоридом феруму (ІІІ) утворюється фіолетове забарвлення, тоді як ацетилсаліцилова кислота, в якій відсутня вільна фенольна гідроксильна група, таку реакцію не дає. Ця реакція використовується при виявленні доброякісності ацетилсаліцилової кислоти. Ацетилсаліцилова кислота як складний ефір здатна гідролізувати в кислому та лужному середовищах. Це слід враховувати при виборі умов зберігання ацетилсаліцилової кислоти: заборонений контакт з вологою. При гідролізі утворюються саліцилова та оцтова кислоти. Добувають аспірин взаємодією саліцилової кислоти з оцтовим ангідридом. ТЕМА: Вивчення властивостей винної, лимонної та саліцилової кислот. Обладнання: пробірки хімічні, штативи для пробірок, спиртівки, мікролопатки, пробіркотримачі. Реактиви: лід, дистильована вода, натрій гідроксид (10%), калій гідроксид, хлоридна кислота, анілін, винна кислота, лимонна кислота, саліцилова кислота, ацетилсаліцилова кислота, розчин глюкози, етанол, купрум(ІІ) сульфат (2%), розчин аміаку, феруму(ІІІ)хлорид, кальцій хлорид, 0,5 % розчин глюкози, фенілсаліцилат, універсальний індикаторний папір.
Це необхідно знати та вміти
Хід роботи I. Виконання дослідів II. Оформлення результатів Результати спостережень оформляють вкінці кожного досліду, відповідно до запитань. III. Висновок У висновку підбиваються підсумки роботи та узагальнюються результати досліджень. Завдання для контролю кінцевого рівня знань
|
|||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1121; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.107.96 (0.216 с.) |



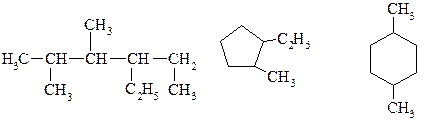













 ¾ безбарвна кристалічна речовина з різким запахом, набуває рожевого забарвлення при тривалому стоянні на повітрі. Вперше був виділений із кам’яного дьогтю обробкою останнього лугом. Враховуючи кислотні властивості та спосіб виділення, фенол отримав назву карболової кислоти. Фенол та його похідні мають здатність вбивати мікроби, тому їх використовують як дезинфікуючі засоби.
¾ безбарвна кристалічна речовина з різким запахом, набуває рожевого забарвлення при тривалому стоянні на повітрі. Вперше був виділений із кам’яного дьогтю обробкою останнього лугом. Враховуючи кислотні властивості та спосіб виділення, фенол отримав назву карболової кислоти. Фенол та його похідні мають здатність вбивати мікроби, тому їх використовують як дезинфікуючі засоби. ¾ кристалічна речовина, в природі зустрічається у зв’язаному вигляді у рослинах, наприклад в листі толокнянки. Він легко окислюється, тому використовується у фотографії для проявлення плівок. З хлоридом феруму (ІІІ) гідрохінон дає синє забарвлення, яке при надлишку реактиву швидко перетворюється на жовте.
¾ кристалічна речовина, в природі зустрічається у зв’язаному вигляді у рослинах, наприклад в листі толокнянки. Він легко окислюється, тому використовується у фотографії для проявлення плівок. З хлоридом феруму (ІІІ) гідрохінон дає синє забарвлення, яке при надлишку реактиву швидко перетворюється на жовте. ¾ кристалічна речовина, яка темніє при тривалому зберіганні. Зустрічається в багатьох рослинах, багато його у кінській сечі. Використовується як проявник у фотографії. При дії на пірокатехін диметилсульфатом (CH3)2 SO4 – утворюється монометиловий ефір (Гваякол) і диметиловий ефір (Вератрол). Гваякол виділяють з букового дьогтю. Він має антисептичну дію.
¾ кристалічна речовина, яка темніє при тривалому зберіганні. Зустрічається в багатьох рослинах, багато його у кінській сечі. Використовується як проявник у фотографії. При дії на пірокатехін диметилсульфатом (CH3)2 SO4 – утворюється монометиловий ефір (Гваякол) і диметиловий ефір (Вератрол). Гваякол виділяють з букового дьогтю. Він має антисептичну дію.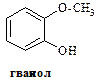

 ¾ безбарвна кристалічна речовина, що поступово буріє при стоянні на повітрі. Резорцин дає з хлоридом феруму (ІІІ) фіолетове забарвлення. Використовується як антисептик при шкірних захворюваннях як зовнішнє у вигляді водних та спиртових розчинів.
¾ безбарвна кристалічна речовина, що поступово буріє при стоянні на повітрі. Резорцин дає з хлоридом феруму (ІІІ) фіолетове забарвлення. Використовується як антисептик при шкірних захворюваннях як зовнішнє у вигляді водних та спиртових розчинів.
 → метилсульфатна кислота
→ метилсульфатна кислота


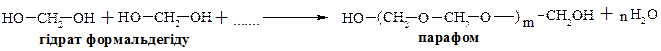


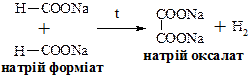

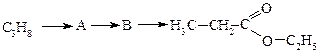
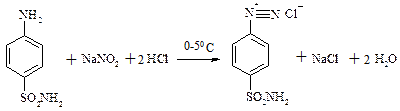
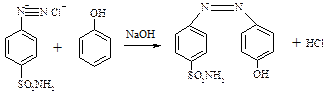
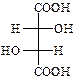 В природі зустрічається D-(+)-винна кислота (один із стереоізомерів), що міститься в багатьох рослинах, особливо у винограді, який є сировиною для її одержання. Виділяється у вигляді кислої калієвої солі („винний камінь”) в процесі винного бродіння виноградного соку. Солі та складні ефіри винної кислоти називають тартратами.
В природі зустрічається D-(+)-винна кислота (один із стереоізомерів), що міститься в багатьох рослинах, особливо у винограді, який є сировиною для її одержання. Виділяється у вигляді кислої калієвої солі („винний камінь”) в процесі винного бродіння виноградного соку. Солі та складні ефіри винної кислоти називають тартратами.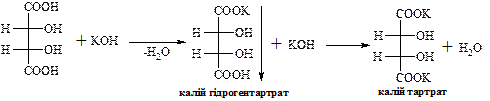
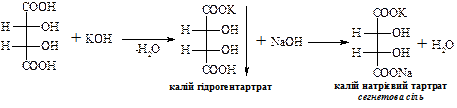
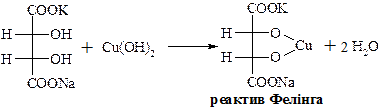
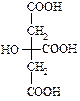 – безбарвна кристалічна речовина, добре розчинна у воді. Вперше була виділена К. В. Шеєллє з лимонного соку, де її вміст сягає 10 %. Під дією сульфатної кислоти лимонна кислота як α-гідроксикислота розкладається з утворенням ацетондикарбонової та мурашиної кислот. Солі лимонної кислоти називають цитратами.
– безбарвна кристалічна речовина, добре розчинна у воді. Вперше була виділена К. В. Шеєллє з лимонного соку, де її вміст сягає 10 %. Під дією сульфатної кислоти лимонна кислота як α-гідроксикислота розкладається з утворенням ацетондикарбонової та мурашиної кислот. Солі лимонної кислоти називають цитратами.