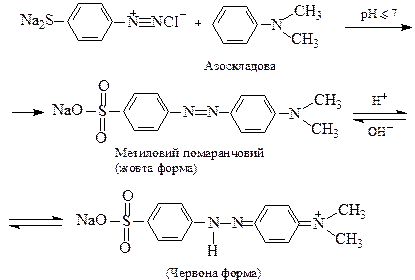Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ароматичні діазо- та азосполуки, азобарвники ⇐ ПредыдущаяСтр 5 из 5
Ароматичні азосполуки - це речовини загальної формули Ar—N=N—Ar у молекулах яких азогрупа —N=N— зв'язана з двома арильними залишками. В ароматичних діазосполуках (Ar—N=N—X) азогрупа, зв'язана одночасно з арильним залишком і неорганічним фрагментом (Х). Аліфатичні азо- і, особливо, діазосполуки ― нестабільні і розкладаються в момент утворення. Найстабільнішими ароматичними діазосполуками є солі діазонію ([ArN≡N]+X─), де (Х=Hal, SO3H, CN), але й вони доволі нестабільні речовини, які вибухають при нагріванні. На відміну від них ароматичні азосполуки ― стабільні і широко застосовуються як азобарвники.
Це може бути зображено резонансними структурами, у яких позитивний заряд повністю локалізований на одному з атомів азоту.
Угруповання C─N≡N є лінійним і зв'язок N≡N за довжиною відповідає потрійному.
Діазогрупа належить до найсильніших електроноакцепторних угрупувань (сильніша від групи NO2). Назви солей діазонію складаються з назви ароматичного радикала 1, до якого додається закінчення "діазоній"- (2) із зазначенням назви аніону – (3).
Фенілдіазонійхлорид п -Толілдіазонійбромід
Способи оДЕРЖання (реакції діазотування)
Солі діазонію утворюються при дії HNO2 на первинні ариламіни (П.Гріс-1858).
Оскільки нітритна кислота не стійка, її одержують безпосередньо у процесі діазотування за реакцією:
Механізм реакції діазотування складний. Припускають, що у водних розчинах спочатку протікають реакції утворення електрофільних діазотуючих агентів:
Протонована нітритна кислота (іон нітрозацидію)
Оксид азоту(ІІІ)
Йон нітрозонію
Нітрозилхлорид
Вказані діазотуючі агенти далі реагують з ариламіном з утворенням нітрозоамінів. Причому, внесок кожного типу діазотуючих агентів залежить від концентрації кислоти і основності аміну.
N-Нітрозоанілін Йон гідроксонію
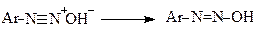
Нітрозоаміни далі перетворюються у свою таутомерну форму - діазогідрат, який у кислому середовищі утворює солі діазонію
(діазогідроксид)
При підлужуванні розчинів солей діазонію знову утворюються діазогідрати, які при надлишку лугу утворюють діазотати
Діазогідрат Натрій діазотат
Утворення діазотату з солей діазонію пояснюється тим, що при взаємодії діазокатіону з ОН─ зв'язок між азотом та киснем стає ковалентним
Діазогідрати нестійкі сполуки і у вільному стані не виділені. У водних розчинах вони виявляють амфотерні властивості: при дії кислот утворюють солі діазонію, а при дії лугів утворюють діазотати
Таким чином, діазосполуки залежно від рН існують у вигляді діазокатіону [ArN2]+ або діазотатаніону [Ar-N2O]─. Останній може знаходитись у син - або анти -формах. Син -форма діазотату, яка утворюється у перший момент при дії лугу на сіль діазонію, повільно ізомеризується в анти -форму. Ізомеризація прискорюється нагріванням. Загальна схема взаємних перетворень діазосполук:
ХІМІЧНІ ВЛАСТИВОСТІ Діазоарени характеризуються реакціями двох типів: 1 - реакції заміщення діазонієвої групи та виділенням азоту; 2 - реакції збереження атомів азоту без виділення N2. Всі ці реакції відбуваються при взаємодії з нуклеофільними реагентами. Реакції з виділенням азоту 1.1. Реакція Л.Гаттермана-Т.Зандмейєра (заміна діазогрупи на CI, CN, NO2, SН)
Вказані реакції каталізуються солями міді (І). Каталітична дія солей міді заключається в переносі іоном Сu (І) електрона за схемою:
Розкладання солей діазонію при нагріванні
Реакція відновлення (заміщення діазогрупи на водень)
гіпофосфітна гіпофосфатна кислота кислота
За допомогою даної реакції можна вилучити NH2-групу з ароматичного кільця, наприклад, з 2,4-дихлораніліну і одержати м -дихлоробензен, який іншим способом синтезувати доволі важко.
1.4. Реакція О.М.Несмєянова (див.стор.).
Реакції без виділення азоту До реакцій, що протікають без виділення азоту, відносяться, в першу чергу, реакції відновлення та азосполучення. Реакції відновлення
Фенілгідразонійхлорид
2.2. Реакції азосполучення (отримання азосполук) Солі діазонію легко вступають у реакції з фенолами в слаболужному розчині і з ариламінами у слабокислому розчині
Вказані реакції відбуваються за механізмом SЕ, де електрофільним реагентом виступає діазокатіон
п -Диметиламіноазобензен
Діазокатіон заміщує атом водню тільки у тому ароматичному ядрі, де є сильні активуючі групи (-NR2, -OH, -OR). Азосполучення не відбувається у сильнокислому розчині, - тому що аміногрупа при цьому перетворюється в амонійну – N+R2H, яка дезактивує бензенове ядро (замісник ІІ-го роду). Феноли в кислому середовищі також протонуються, а протонована гідроксигрупа дезактивує бензенове ядро.
Реакція азосполучення відбувається у п -положенні, а якщо воно зайняте, то в о -положенні, до NН або НОгрупи. Переважна більшість ароматичних азосполук забарвлена. Багато з них використовуються як органічні барвники. Чому саме азосполуки забарвлені і як з цим пов’язана будова органічної сполуки? Відповіді на ці питання дає “теорія колірності органічних сполук”. В першу чергу усвідомлюємо, що забарвлення нерозривно зв’язане зі світлом. Нема світла – нема забарвлення. Коли ми говоримо, що трава зелена, то маємо на увазі, що вона зелена в білому світлі. Наприклад, в червоному світлі вона чорна, а в жовтому – безбарвна. Отже надалі, коли йтиметься про забарвлення, будемо мати на увазі, що воно розглядається при освітлені білим, або денним світлом. Що таке світло? Світло- це потік фотонів або квантів, тобто електромагнітних хвиль певної довжини і енергії. Весь електромагнітний спектр дуже широкий і охоплює діапазон хвиль від 10-14м (у космічних променів) до 10-6м (у змінних струмів). Наше око сприймає тільки вузьку смужку з цього спектра, з довжиною хвиль (λ) від 400 до 760 нм (4 10-7–7,6 10-7 м). Біле світло складається з суміші всіх спектральних кольорів (червоного, помаранчевого, жовтого, зеленого, блакитного, синього, фіолетового).
Якщо на поверхню тіла падає потік білого світла, то можна спостерігати такі явища: 1. Світло проходить крізь тіло. Таке тіло буде прозорим для білого світла. 2. Світло поглинається тілом. Тіло буде чорним. 3. Світло відбивається від поверхні тіла або розсіюється нею. Таке тіло буде дзеркальним або білим. 4. Тіло вибірково поглинає деякі промені з видимої частини спектра, а решта променів проходить крізь нього, або відбивається його поверхнею. Таке тіло буде забарвленим. Наприклад, якщо тіло поглинає промені з довжиною хвиль від 500 до 550 нм., що відповідають зеленому кольору, то дія на людське око інших променів з довжинами хвиль від 400 до 500 і від 550 до 760 нм буде викликати відчуття червоно-фіолетового (пурпурного) кольору. Отже, причиною забарвлення є вибіркове поглинання тілом частини світлових променів із загального потоку у видимій частині електромагнітного спектра. Як же пов’язана довжина світлової хвилі, що поглинається речовиною з її хімічною будовою? Більшість органічних речовин поглинає кванти, що відповідають ультрафіолетовій частині спектра. При цьому енергія поглинутого кванта витрачається на збудження електронів молекули. Суть збудження полягає у переході електронів з ВЗМО на НВМО (див.стор.). Чим менша різниця енергії між НВМО та ВЗМО, тим менша енергія, а значить більша довжина хвилі кванта світла, необхідного для здійснення цього переходу.
Так, метан характеризується найбільш інтенсивним поглинанням квантів з довжиною хвилі 120 нм. У молекулах зі спряженими подвійними зв’язками π-електрони утворюють єдину електричну хмару, внаслідок чого рухливість π-електронів зростає і знижується енергія збудження молекули. Так, λmах для 1,3-бутадієну дорівнює 217 нм. При достатньому подовженні спряженої системи енергія її збудження знижується до величини, що відповідає енергії фотонів у видимій частині спектру і речовина набуває забарвлення. Це спостерігається, наприклад, у каротину моркви (речовини, що надає моркві характерного кольору). Наявність в його структурі ланцюга з 11 спряжених подвійних зв’язків зумовлює червоний колір з характерним фіолетовим відтінком.
(λmах.= 420-485 нм).
Система спряжених зв’язків, яка, в основному, зумовлює появу забарвлення, називається хромоформною системою, а полярні групи по її кінцях, що підсилюють здатність поглинати світло і сприяють зв’язуванню барвника з поверхнею, на яку його нанесли – називаються ауксохромами. Отже барвник має в складі молекули хромофорну систему і принаймні дві ауксохроми. Найбільш поширений клас синтетичних барвників – азобарвники. Їх синтез складається з двох стадій: 1) діазотування і 2) азосполучення. Наведемо як приклад схему синтезу азобарвника метилового помаранчевого, який до того ж є одним з найпоширеніших кислотно-основних індикаторів. 1. Діазотування ― одержання т.з. діазоскладової. В даному випадку діазотують сульфанілову кислоту:
2. Азосполучення діазоскладової з ароматичним третинним аміном (азоскладовою):
У кислому середовищі барвник знаходиться, переважно, у червоній формі, що утворюється внаслідок приєднання протона до жовтої. При додаванні лугу відбувається відщеплення протона і знову утворюється жовта форма. Відомі азобарвники, що містять у молекулі 2,3 і більше азогруп.
|
|||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1038; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.216.229 (0.033 с.) |
 Діазокатіон (іон арендіазонію) [Ar—N≡N]+ є спряженим йоном, у якому існує сильна взаємодія між π-електронами ядра та потрійним зв'язком. Позитивний заряд розподілений на обох атомах азоту, але атом, найближчий до бензенового ядра, має більший заряд δ′>> δ″.
Діазокатіон (іон арендіазонію) [Ar—N≡N]+ є спряженим йоном, у якому існує сильна взаємодія між π-електронами ядра та потрійним зв'язком. Позитивний заряд розподілений на обох атомах азоту, але атом, найближчий до бензенового ядра, має більший заряд δ′>> δ″.

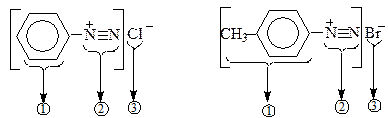
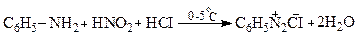








 Діазогідрат Сіль діазонію
Діазогідрат Сіль діазонію
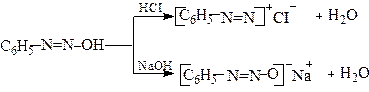





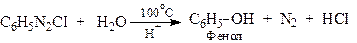




 п -Гідроксиазобензен
п -Гідроксиазобензен


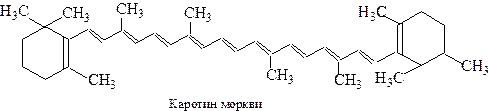
 Максимум поглинання зсувається у довгохвильову область і тоді, коли в спряжену систему входять гетероатоми. Так λmах азобензену дорівнює 440 нм. А якщо спряжена система має полярні замісники, то λmах, як правило, знаходиться у видимій частині спектра, тобто такі сполуки будуть забарвленими і можуть виконувати роль барвників.
Максимум поглинання зсувається у довгохвильову область і тоді, коли в спряжену систему входять гетероатоми. Так λmах азобензену дорівнює 440 нм. А якщо спряжена система має полярні замісники, то λmах, як правило, знаходиться у видимій частині спектра, тобто такі сполуки будуть забарвленими і можуть виконувати роль барвників.