Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні класи неорганічних сполукСтр 1 из 5Следующая ⇒
Основні класи неорганічних сполук
Неорганічні сполуки за кислотно-основною класифікацією поділяють на чотири основні класи:
Ступінь окиснення елементів Ступінь окиснення – фундаментальне поняття неорганічної хімії. Ступінь окиснення – умовний заряд атома у хімічних сполуках. При утворенні хімічних зв’язків спільні електронні пари зміщуються до того з атомів, який має більше значення електронегативності χ. Атом при цьому набуває негативного заряду, а той атом, від якого відтягнута електронна пара – позитивного. Наприклад:
Умовність ступеня окиснення полягає в тому, що ми повністю переводимо електрони від одного атома до іншого, тобто
Знак ступеня окиснення визначають таким чином: елементу, що має більше значення χ, приписують негативний ступінь окиснення, другий елемент у цій сполуці матиме позитивний ступінь окиснення. Наприклад, у сполуці СО2ступінь окиснення Карбону +4, а Оксигену –2 (беручи до уваги, що Оксиген більш активний неметал, ніж Карбон, тобто, атоми Оксигену енергійніше притягують електрони). Для обчислення ступеня окиснення елементів у сполуках слід пам’ятати, що ступінь окиснення Оксигену в більшості сполук (за винятком сполуки з флуором як більш активним неметалом, та в так званих пероксосполуках) рівний –2, а ступінь окиснення Гідрогену у більшості сполук рівний +1 (за винятком гідридів – сполук Гідрогену з активними металами). Для визначення ступеней окиснення елементів у складних сполуках необхідно пам’ятати, що, в більшості випадків, один атом має негативний ступінь окиснення, інші – позитивні. Наприклад, для визначення ступеня окиснення Сульфуру в H2SO4необхідно додати ступені окиснення Гідрогену та Оксигену з врахуванням числа їх атомів 2·(+ 1) – 4·(–2) = –6 та одержане число взяти з оберненим знаком, виходячи з того, що всі хімічні сполуки електронейтральні. Тоді ступінь окиснення Сульфуру в H2SO4дорівнює +6. Можна це саме записати ще так: ступінь окиснення Сульфуру позначаємо через х та складаємо рівняння х + 2·(+ 1) – 4·(–2) = 0; х = +6 Оксиди Оксиди – бінарні сполуки, які складаються з двох елементів, один з яких обов’язково є Оксиген зі ступенем окиснення –2 (О–2), причому ні атоми Оксигену, ні (в переважній більшості випадків) атоми елемента, який утворює оксид, безпосередньо між собою не зв’язані.
Враховуючи, що ступені окиснення хімічних елементів в оксидах можуть змінюватись в межах від +1 до +8, загальні формули оксидів можна записати так (Е – елемент): E2O, ЕО, E2O3, ЕО2, Е2О5, EO3, E2O7, EО4. Структурні формули оксидів Для кращого розуміння будови та властивостей хімічних сполук важливо вміти писати їх структурні формули, тобто формули будови, які показують порядок сполучення атомів у молекулах. У структурних формулах кожна риска вказує на валентний зв’язок між атомами (дві риски – подвійний зв’язок, три риски – потрійний). Для написання структурної формули оксиду необхідно спочатку визначити ступінь окиснення елемента в оксиді. Після цього, якщо ступінь окиснення елемента парний (+2, +4, +6 або +8), записують символ елемента і сполучають його з відповідною кількістю символів атомів Оксигену подвійними зв’язками. Наприклад, в SO2ступінь окиснення Сульфуру дорівнює +4; =S=;O=S=O Якщо ступінь окиснення елемента в оксиді непарний (+1, +3, +5 або +7), то записаний двічі символ елемента сполучають одинарними зв’язками з одним атомом Оксигену, а решта атомів Оксигену (при ступенях окиснення +3, +5 та +7) дописують через подвійні зв’язки. Наприклад: Al2O3, ступінь окиснення алюмінію дорівнює + 3:
При написанні структурних формул оксидів слід пам’ятати, що в молекулі оксиду атоми Оксигену між собою безпосередньо не зв’язані, і атоми елемента, який утворює оксид, в більшості випадків також між собою безпосередньо не зв’язані. Приклади структурних формул оксидів: а) оксиди елементів з парним ступенем окиснення:
б) оксиди елементів э непарним ступенем окиснення:
Класифікація оксидів
Несолеутворюючі оксиди – такі, які не здатні сполучатись з іншими оксидами, кислотами або основами з утворенням солей. Несолеутворюючі оксиди називають індиферентними, що в перекладі з латинської мови означає байдужі. Солеутворюючі оксиди – здатні при взаємодії з деякими іншими оксидами, кислотами або основами утворювати солі. Таких оксидів переважна більшість.
Основні оксиди
Основні оксиди можна визначити як оксиди, не здатні взаємодіяти між собою та з основами і можуть реагувати з речовинами кислотного характеру (кислотними оксидами та кислотами) та амфотерного характеру (останні поводять себе в даному випадку як кислотні) з утворенням солей. Таке визначення є найбільш загальним. До основних оксидів відносять: 1. Оксиди елементів головних підгруп першої та другої груп за винятком ВеO, Tl2O3.
2. Переважна більшість оксидів елементів побічних підгруп, в яких елементи проявляють нижчі ступені окиснення (більшість елементів побічних підгруп здатна проявляти різні ступені окиснення). Наприклад: ТіО, МnО, Мn2О3, FeO, СоО, Сu2О, Ag2О, CdO, Hg2O, HgO.
3. Більшість оксидів лантаноїдів загальної формули Е2О3 (для церію СеО2) і більшість oксидів актиноїдів.
Зі сказаного можна зробити висновок, що всі без винятку основні оксиди – оксиди металів (тобто неметали не утворюють основних оксидів), але не всі оксиди металів –основні; серед них є також амфотерні і кислотні. В основних оксидах метали проявляють звичайно ступінь окиснення +1, +2 або +3, рідше +4 (ТhО2). Всі основні оксиди за звичайних умов – тверді речовини. З водою добре взаємодіють оксиди лужних металів та лужноземельних металів (лужноземельними називають метали Ca, Sr, Baта Ra) з утворенням розчинних основ – лугів:
Na2O + H2O = 2NaOH CaO + H2O = Ca(OH)2
Не всі оксиди сполучаються з водою, є чимало оксидів, гідрати яких одержують посереднім шляхом, наприклад, взаємодією їх водорозчинних солей з лугами. Кислотні оксиди
Кислотні оксиди можна визначити як оксиди, не здатні реагувати між собою та з кислотами, можуть взаємодіяти з речовинами основної природи (основними оксидами та основами) та амфотерної природи (останні поводять себе в даному випадку як основні) з утворенням солей. Таке визначення більш загальне. До кислотних оксидів належать: 1. Переважна більшість оксидів неметалів (за винятком несолеутворюючих). Наприклад: В2O3, СО2, SiO2, N2O5, P2О3, P2О5, As2O5, SО2, SО3, SeO2, SeO3, TeО2, TeO3, Cl2О, Cl2О7.
2. Оксиди металів побічних підгруп, в яких метали проявляють вищі ступені окиснення (+5, +6, або +7). Наприклад: V2O5, СrО3, Mn2O7.
Більшість кислотних оксидів за звичайних умов – тверді речовини: В2O3, SiO2, N2O5, P2О5, P2O3, SeO2, TeO2, CrO3, V2O5, деякі – рідини: N2O3, SO3, С2О7, Mn2O7, деякі – гази: CO2, SO2, Cl2O. Більшість кислотних оксидів добре розчиняється у воді з утворенням відповідних оксигеновмісних кислот.
SO2 + H2O = H2SO3 N2O5 + H2O = 2HNO3
Деякі кислотні оксиди у воді нерозчинні: SiO2, V2O5 і відповідні кислоти можна одержати непрямим шляхом, наприклад, взаємодія їх водорозчинних солей з кислотами. Амфотерні оксиди
Саме амфотерні оксиди, залежно від того, з якими речовинами вони взаємодіють, також здатні проявляти властивості як основних, так і кислотних оксидів. До амфотерних оксидів відносять: 1. Оксиди деяких елементів головних підгруп: BeO, Al2O3, Ga2O3, In2O3, GeO, GeO2, SnO, SnO2, PbO, PbO2, As2O3, Sb2O3та деякі інші.
2. Оксиди металів побічних підгруп, частіше такі, в яких метали проявляють проміжні ступені окиснення, наприклад: Cr2O3, MnO2, Fe2O3, CuO, ZnO.
У переважній більшості амфотерних оксидів елементи проявляють ступені окиснення +2, +3, рідше вищий. Номенклатура оксидів
Назви оксидів елементів утворюються переважно таким чином:
Наприклад: Sb2O3– стибій(III)оксид, чи стибій(+3) оксид, N2O5 – нітроген(V)оксид, чи нітроген(+5) оксид. Кислотні оксиди називають ще ангідридами відповідних кислот. Наприклад: CO2 – карбонатний ангідрид, SO3 – сульфатний ангідрид. Як синоніми для деяких оксидів ще зберігаються давно поширені назви: CO2 – вуглекислий газ, SO2 – сірчистий газ. Хімічні властивості оксидів Оксиди здатні взаємодіяти як між собою, так і з основами, амфотерними гідроксидами та кислотами за такими загальними правилами. Позначимо: Основний оксид, основа – [о], Кислотний оксид, кислота – [к], Амфотерний оксид, амфотерний гідрат оксиду – [а], несолетвірний оксид – [нсо]. За кислотно-основною взаємодією реакція відбувається з утворенням солі та води (вода утворюється при використанні основи чи кислоти): [о] + [к] → сіль + (Н2О) [о] + [а] → сіль + (Н2О) [а] + [к] → сіль + (Н2О) [а] + [а] → сіль + (Н2О) Реакція не відбувається, якщо: [к, о, а] + [нсо] ≠ [к] + [к] ≠ [о] + [о] ≠
Наприклад:
СаО + SO2 = CaSO3 [о] [к] MgO + 2HCl = MgCl2 + H2O [о] [к] K2O + ZnO = K2ZnO2 [о] [а] Na2O + Be(OH)2 = Na2BeO2 + H2O [о] [а] СО2 + K2O = К2СO3 [к] [о] SO3 + 2NaOH = Na2SO4 + H2O [к] [о] P2O5 + Al2O3 = 2AlPO4 [к] [а]
SiO2 + Zn(OH)2 = ZnSiO3 + H2O [к] [а] Амфотерні оксиди взаємодіють як з речовинами основного характeру (основними оксидами, основами), проявляючи при цьому властивості кислотних оксидів, так і з речовинами кислотного характеру (кислотними оксидами, кислотами), проявляючи при цьому властивості основних оксидів. В результаті таких реакцій також утворюються солі. Амфотерні оксиди здатні взаємодіяти також між собою та з амфотерними гідроксидами, при цьому одна з речовин проявляє основні (нижчий ступінь окиснення), а друга – кислотні властивості. Наприклад:
BeO + CaO = CaBeO2 [а] [о]
ZnO + 2NaOH = Na2ZnO2 + H2O [а] [о]
Al2O3 + 3SO3 = Al2(SO4)3 [к] [а]
Cr2O3 + 6HNO3 = 2Cr(NO3)3 + 3H2O [а] [к]
ZnO + As2O3 = Zn(AsO2)2 [а] [а]
CuO + 2Al(OH)3 = Cu(AlO2)2 + 3H2O [а] [а] Одержання оксидів Найпоширенішими методами одержання оксидів є: Окиснення складних речовин
4NH3 +5O2 = 4NO + 6H2O 2ZnS + 3O2 = 2ZnО + 2SO2
Часто таким чином одержуюсь оксиди з вищим ступенем окиснення елемента з оксидів з нижчим ступенем окиснення:
2NO + O2 = 2NO2 2SO2 + O2 = 2SO3 Основи
Згідно з теорією електролітичної дисоціації основи – це електроліти, здатні дисоціювати на позитивно заряджені йони металу (або деякі складні катіони) та негативно заряджені йони ОН– (і жодні інші аніони).
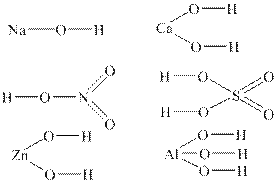
У загальному вигляді формулу основ можна записати так: Меn+(OН)n, де Меn+ – катіон металу зі ступенем окиснення +n. Число n може приймати значення 1, 2, 3, рідше 4. Число гідроксид-йонів ОН– визначає кислотність основи. За кислотністю основи поділяються на: · однокислотні (наприклад, КОН, TlОН); · двокислотні (наприклад, Мg(ОН)2, Ca(ОH)2, Fe(OH)2); · трикислотні (наприклад, Al(ОН)3, Со(ОН)3); · чотирикислотні (наприклад, Th(OH)4). Структурні формули основ Для написання структурної формули основи необхідно до символу атому металу приписати через риски таке число груп –OН, яке дорівнює ступеню окиснення металу. Наприклад:
Номенклатура основ
Назви основ утворюються наступним чином:
NaOH – натрій гідроксид Са(OH)2 – кальцій гідроксид Mn(ОН)2 – манган (II) гідроксид Mn(ОН)3 – манган (III) гідроксид
Як виняток, розчин аміаку в воді не є гідроксидом, так як він практично не дисоціює за схемою: NH3·H2O = NH4+ + OH– Тому в цьому випадку більш доцільно давати назву сполуці NH3·H2O –аміак гідрат. Властивості основ Основи за звичайних умов – тверді речовини (за винятком амоній гідроксиду, який існує тільки у водному розчині). У воді добре розчинні основи лужних металів (Rb, Cs, Fr), лужноземельних металів (Са, Sr, Ba, Ra) а також талій (І) гідроксид TlОН. Розчини цих основ у воді (а інколи самі основи) називають лугами. Розчинні у воді основи практично повністю дисоціюють на йони, тобто є сильними електролітами. Надлишок гідроксид-йонів ОН–, який утворюється при розчиненні у воді основ, зумовлює лужне середовище і викликає зміну забарвлення деяких речовин – індикаторів. Так, наприклад, лакмус у лужному середовищі забарвлюється в синій колір, фенолфталеїн – малиновий. Для деяких основних оксидів відповідні основи не існують. Так, наприклад, невідомі: AgOH, AuOH, HgOH, Hg(OH)2. Основна загальна хімічна особливість усіх основ поляє в їх здатності реагувати з речовинами кислотної природи (кислотними оксидами, кислотами) та з речовинами амфотерної природи (останні поводять себе в даному випадку як кислотні) з утворенням солей. Наприклад:
2LiOH + SO2 = Li2SO3 + H2О Ca(OH)2 + 2HNO3 = Ca(NO3)2+ 2H2О 2NaOH + ZnO = Na2ZnO2+ H2О Cd(OH)2 + Be(OH)2 = CdBeO2+ 2H2О
Основи не здатні вступати в реакції солеутворення з речовинами основного характеру (основами та основними оксидами). Одержання основ 1 Деякі основи можна одержати при взаємодії основних оксидів з водою. Наприклад:
Cs2O + H2O = 2CsOH BaO + H2O = Ba(OH)2 Eu2O3 + 3H2O = 2Eu(OH)3
Так можна одержати луги та нерозчинні у воді гідроксиди лантану та лантаноїдів.
2 Найбільш загальний метод одержання нерозчинних у воді основ полягає у взаємодії розчинної солі металу, основу якого необхідно одержати, з розчином лугу. Наприклад:
NiSO4 + 2NaOH = Ni(OH)2↓+ Na2SO4 BiCl3 + 3KOH = Bi(OH)3↓+ 3KCl Th(NO3)4 + 4KOH = Th(OH)4↓ + 4KNO3
3 Основи утворюються при взаємодії деяких металів з водою.
2Na + 2H2O = 2NaOH + H2
При кімнатній температурі з водою взаємодіють тільки найбільш активні метали (лужні та лужноземельні), при температурі кипіння води взаємодіють магній, лантан та лантаноїди. Деякі менш активні метали здатні взаємодіяти при високих температурах з водяною парою.
4 Серед інших методів одержання основ слід назвати електроліз водних розчинів деяких солей. Кислоти Кислотами називаються гідрати кислотних оксидів. Деякі кислоти можна одержати при безпосередній взаємодії відповідного оксиду з водою. Наприклад:
SO2 + H2O = H2SO3 CrO3 + H2O = H2CrO4
Але не всі кислотні оксиди взаємодіють з водою (наприклад, нерозчинний і не взаємодіє з водою SiO2), а також не всяку кислоту можна розглядати як гідрат кислотного оксиду (наприклад, не є гідратами кислотних оксидів хлоридна HСl та сульфідна H2S кислоти).
Згідно з теорією електролітичної дисоціації кислоти – це електроліти, здатні при дисоціації давати позитивно заряджені йони одного різновиду – гідроген-йони. Усі кислоти поділяються на два типи: безкисневі та кисневмісні. Безкисневі кислоти Безкисневі кислоти утворюються при взаємодії гідридних сполук неметалів з водою. Гідридні сполуки неметалів за звичайних умов є газами. Їх водні розчини проявляють кислотні властивості. Назви складаються з назви аніону з додавонням суфікса –ідн, –идн та слова кислота:Н2Se – селенідна кислота, H2S – сульфідна кислота, H2F2 – флуоридна кислота. До безкисневих кислот належать також ціанідна HСN, роданідна HNCSта деякі інші.
Кисневмісні кислоти Як уже відмічалось, кисневмісні кислоти можна розглядати як продукт взаємодії кислотного оксиду з водою. При цьому слід пам’ятати, що деякі кислотні оксиди нерозчинні у воді, а для деяких кислот відповідного оксиду не одержано (див. табл. 3.1). Таблиця 3.1 – Кисневмісні кислоти
Загальна формула кисневмісних кислот: m ExOy∙nH2O де ExOy – кислотний оксид. Для більшості кислот т = 1і п = 1, рідше 2 або 3. При цьому, якщо кислотоутворюючий елемент має парний ступінь окиснення, в результаті реакції оксиду з водою утворюється одна молекула кислоти, а якщо непарний – дві. Наприклад:
CO2 + H2O = H2CO3 SO3 + H2O = H2SO4 B2O3 + H2O = 2HBO2 N2O5 + H2O = 2HNO3 Cl2O7 + H2O = 2HClO4
Одному і тому ж кислотному оксидові часто відповідає не одна, а більше кислот. Наприклад:
P2O5 + H2O = 2HPO3 P2O5 + 2H2O = H4P2O7 P2O5 + 3H2O = 2H3PO4
Структурні формули кислот Для написання структурних формул більшості безкисневих кислот потрібно сполучити рисками відповідну кількість символів атому Гідрогену з символом атому кислоутворюючого елемента. Наприклад: HCl Н–Cl H2Se H–Se–H У кисневмісних кислотах Гідроген-катіони, здатні заміщуватись на катіони металу, зв’язані з кислотоутворюючим елементом не безпосередньо, а через атоми Оксигену. Це необхідно враховувати при написанні їх структурних формул. Для написання структурної формули кисневмісної кислоти необхідно визначити ступінь окиснення кислотоутворюючого елемента, приєднати до нього всі атоми Гідрогену через атоми Оксигену, а решта атомів Оксигену приписати через подвійні зв’язки. Наприклад: H2S+6O4 H3P+5O4
Якщо до складу кислоти входить два атома кислотоутворюючого елемента (а в деяких кислотах і більша їх кількість), то їх необхідно сполучити через атом Оксигену, далі до кожного з них приєднати атоми Гідрогену через атоми Оксигену і приписати решта атомів Оксигену через подвійні зв’язки. Наприклад: H4P+52O7
Основність кислот За кількістю атомів Гідрогену, що здатні заміщуватись на катіони металу, кислоти (як кисневмісні, так і безкисневі) поділяються на: · одноосновні (наприклад, HNО3, НСl), · двоосновні (наприклад, H2SO4, H2S), · триосновні (наприклад, H3PO4), та в рідкісних випадках більш багатоосновні. У деяких кислотах не всі атоми Гідрогену здатні заміщуватись на катіони металу. Це стосується всіх органічних кислот. Наприклад, оцтова кислота СН3СООН є одноосновною:
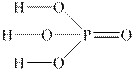
В органічних кислотах основність визначається не загальною кількістю атомів Гідрогену (в оцтовій кислоті їх чотири), а числом кислотних функціональних груп – карбоксильних груп У переважній більшості неорганічних кислот усі катіони Гідрогену здатні замішуватись на катіони металу. Як приклад неорганічної кислоти, для якої основність не збігається з загальним числом атомів Гідрогену в молекулі, можна привести одноосновну гіпофосфітну кислоту H3PO2:
Лише атом Гідрогену, зв’язаний з атомом Оксигену, здатний замішуватися на катіон металу.
Назви кисневмісних кислот 1 Якщо кислотоутворюючий елемент проявляє в кислотах тільки один ступінь окиснення, то у назвах кисневмісних кислот до кореня латинської назви відповідного елемента додають суфікс „ат“. Наприклад: C+4, H2СO3 – карбонатна кислота.
2 Якщо елемент здатний прявляти два ступені окиснення, то у вищому ступені окиснення в назві кислоти застосовується суфікс „ат“, а у нижчому – „ит“ або „іт“. Наприклад: N+3, HNO2 – нітритна кислота, N+5, HNO3 – нітратна кислота, S+4, H2SO3 – сульфітна кислота, S+6, H2SO4 – сульфатна кислота;
3 Якщо елемент здатний проявляти більшу кількість ступенів окиснення, то до кореня латинської назви елемента додають: · при найнижчому ступені окиснення – префікс „гіпо“ та суфікс „ит“ або „іт“, · при дещо вищому ступені окиснення – суфікс „ит“ або „іт“, · при ще вищому ступені окиснення – суфікс „ат“, · при найвищому ступені окиснення – префікс „пер“ та суфікс „ат“. Наприклад: Cl+1, HClO – гіпохлоритна кислота, Cl+3, HClO2 – хлоритна кислота, Cl+5, HClO3 – хлоратна кислота, Cl+7, HClO4 – перхлоратна кислота.
4 Якщо до складу кислоти входять два або більше атомів кислотоутворюючого елемента, то для позначення їх кількості в назві кислоти застосовують префікс – відповідний грецький числівник. Наприклад: H2Cr2O7 – дихроматна кислота, H4P2O7 – дифосфатна кислота, H2B4O7 – тетраборатна кислота.
Загальна назва таких кислот – ізополікислоти (від грецьких слів „ізос“ – однаковий та „полі“ – багато, тобто в кислоті є багато атомів кислотоутворюючого елемента). Для H2SO4, HNO3, НСl та деяких інших кислот поширені також давні назви – сірчана, азотна, соляна кислоти. Назви кислотних оксидів часто утворюють від назв відповідних кислот і складають із двох слів: перше слово – назва аніону кислоти з суфіксом „н“, друге слово – ангідрид. Наприклад: SO3 – сульфатний ангідрид, P2O5 – фосфатний ангідрид, Cl2O – гіпохлоритний ангідрид.
Слово „ангідрид“ походить від грецького „ангідріс“, що означає безводний: утворення кислотного оксиду можна уявити як процес відбирання води від відповідної кислоти. Наприклад: SO3 = H2SO4 – H2O P2O5 = 2H3PO4 – 3H2O Cl2O = 2HClO – H2O
Мета- та ортокислоти Для двох кислот того жангідриду, які відрізняються вмістом води, назви утворюють так: до назви аніону кислоти з меншим вмістом води додається префікс „мета“, з більшим вмістом води – префікс „орто“. Наприклад: HPO3 – метафосфатна кислота, H3PO4 – ортофосфатна кислота, HBO2 – метаборатна кислота, H3BO3 – ортоборатна кислота.
Cтупінь окиснення кислотоутворюючого елемента в мета- та ортокислотах однаковий (вони походять від одного ангідриду). Для того, щоб вивести формулу метакислоти з формули ортокслоти в більшості випадків потрібно від останньої відняти молекулу води
H3PO4 – H2O = HPO3
І, навпаки, щоб вивести формулу ортокиcлоти з формули метакислоти до останньої необхідно додати молекулу води
HBO2 + H2O = H3BO3
Метакислота завжди одноосновна для елементів у непарному ступені окиснення (наприклад, HBO2 H3BO3 HPO3 H3PO4 H2SiO3 H4SiO4
Властивості кислот Деякі кислоти за звичайних умов є рідинами (наприклад, H2SO4, HNO3), інші – твердими речовинами (наприклад, H3BO3, H2SiO3, H3PO4). Багато кислот, наприклад, Н2CО3, H2SО3, НМnО4 існують тільки у водних розчинах і у вільному стані їх одержати не вдається. Водні розчини кислот кислі на смак, змінюють колір деяких індикаторів (наприклад, лакмус у кислому розчині приймає червоне забарвлення, метилоранж – червоне). За ступенем дисоціації кислоти можна умовно поділити на сильні (наприклад, HClO4, HCl, HNO3, H2SO4, H2SeO4), середньої сили (наприклад, H3PO4, HF) та слабкі (наприклад, H2CO3, HClO, H2S). Кислоти дисоціюють на Гідроген-йони та кислотний залишок, наприклад:
HCl → H+ + Cl– HNO3 → H+ + NO3–
Багатоосновні кислоти дисоціюють ступінчато, наприклад: H2SO4 ↔ H+ + HSO4 – HSO4 – ↔ H+ + SO4 2–
Дисоціація легше відбувається за першим ступенем. Найбільш загальною хімічною властивістю кислот є їх здатність взаємодіяти з речовинами основного характеру (основними оксидами, основами) та амфотерного характеру, з утворенням солей. Наприклад: H2SO4 + FeO = FeSO4 + H2O H2SO3 + 2KOH = K2SO3 + 2H2O 2HNO3 + ZnO = Zn(NO3)2 + H2O 3HCl + Al(OH)3 = AlCl3 + 3H2O
Кислоти не здатні вступати в реакції солеутворення з речовинами кислотної природи (кислотами і кислотними оксидами).
Одержання кислот Найбільш загальними методами одержання кислот є: 1 Безпосередня взаємодія ангідриду з водою:
SO3 + H2O = H2SO4 N2O5 + H2O = 2HNO3
2 Витіснення більш леткої кислоти з солі менш леткою:
2NaNO3 + H2SO4 = Na2SO4 + 2HNO3
3 Витіснення більш слабшої кислоти сильнішою кислотою з розчину її солі:
FeS + 2HCl = FeCl2 + H2S Na2SO3 + H2SO4 = Na2SO4 + H2SO3 Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
4 Реакції подвійного обміну в розчині солі з кислотою, якщо один з продуктів реакції (кислота або сіль) випадає в осад:
AgNO3 + HCl = AgCl ↓+ HNO3 K2SiO3 + H2SO4 = K2SO4 + H2SiO3 ↓
5 Окиснення деяких неметалів кислотами – сильними окисниками:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
6 Перетворення однієї кислоти в іншу (звичайно при нагріванні):
H3BO3 2H3PO4
Амфотерні гідроксиди
Як і амфотерні оксиди, амфотерні гідроксиди мають двоїсту природу, тобто здатні в хімічних реакціях виступати як основи (з речовинами кислотного характеру), або як кислоти (з речовинами основного характеру). З порівняння структурних формул основ, кислот та амфотерних гідроксидів видно, що в молекулах усіх цих речовин є групи –ОН. Наприклад:
Різниця у властивостях обумовлена різною міцністю зв’язку між атомами Гідрогену та Оксигену в rpyпі –ОНта атомом Оксигену цієї групи з атомами елементу, який утворив гідрат оксиду. В основах більш міцний зв’язок між Гідрогеном і Оксигеном і тому при їх дисоціації, а також в реакціях солеутворення, відщеплюється гідроксил-йон ОН–. Наприклад:
NаOH → Nа+ + OН–
В кислотах міцніший зв’язок між атомом Оксигену та атомом кислотоутворюючого елемента і тому при їх дисоціації, а також в реакціях солеутворення, відщеплюється гідроген – йон Н+. Наприклад:
HNO3 → H+ + NO3–
В молекулах амфотерних гідроксидів міцність цих зв’язків приблизно однакова, тому вони здатні дисоціювати як за основним, так і за кислотним типом, залежно від природи речовини, з якою вони взаємодіють. Наприклад:
Zn(OH)2 ↔ Zn2+ + 2OH– H2ZnO2 ↔ 2H+ + ZnO2 2–
Дисоціація амфотерних гідроксидів у водних розчинах практично не відбувається, тому що вони нерозчинні у воді. Такий розрив зв’язків має місце в реакціях солеутворення.
Солі
Середні солі Середні солі можна розглядати як продукти повного заміщення Гідроген-катіонів в кислоті на катіони металу або як продукти повного заміщення гідроксид-йонів в основі на кислотні залишки. Наприклад, сіль СuSО4 можна розглядати як продукт заміщення двох Гідроген-йонів у сульфатній кислоті H2SО4 наодин Сu2+, або як продукт заміщення двох гідроксид-йонів ОН– в купрум (ІІ) гідроксиді Сu(ОН)2 на один сульфат-йон SO42–. Для написання хімічних формул середніх солей потрібно катіони та аніони сполучати в молекулу згідно з їх валентностями, врахувавши, що молекули солей, як і інших сполук, електронейтральні. На першому місці в формулі молекули солі записують катіон, на другому – аніон.
Наприклад:
Номенклатура середніх солей
Наприклад: Na2S – натрій сульфід, Na2SO3 – натрій сульфіт, Na2SO4 – натрій сульфат, Al(NO3)3 – алюміній нітрат, Ca3(РО4)2 – кальцій ортофосфат, Са(РО3)2 – кальцій метафосфат, KCl – калій хлорид, KClO3 – калій хлорат, KClO4 – калій перхлорат, FeSO4 – ферум(ІІ) сульфат, Fe2(SO4)3 – ферум(III) сульфат. Для деяких солей вживають ще іноді тривіальні назви, наприклад: КСlO3 – бертолетова сіль, NaNO3 – натрієва селітра тощо.
Властивості середніх солей
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1179; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.196.184 (0.426 с.) |


 ;
; 





















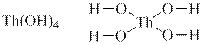






 (в оцтовій кислоті – одна).
(в оцтовій кислоті – одна).
 ,
,  )та двоосновна для елементів у парному ступені окиснення (наприклад,
)та двоосновна для елементів у парному ступені окиснення (наприклад,  ,
,  ). Основність ортокислоти звичайно більша за основність метакислоти на дві одиниці, наприклад:
). Основність ортокислоти звичайно більша за основність метакислоти на дві одиниці, наприклад:
 HBO2 + H2O
HBO2 + H2O