Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Examination guestions of disciplineСодержание книги
Поиск на нашем сайте Examination guestions of discipline «Professionally-oriented foreign language» Level Translate the text into English. Химиялық талдау деген ұғымды XVII ғасырда ағылшын ғалымы Р. Бойлъ енгізген. Физикалық әдістерде –талдау химиялық реакцияларсыз жүреді, бұл әдіс заттардың физикалық қасиеттеріне негізделеді, мысалы спектральды, рентгенқұрылымдық, масспектроскопия т.с.с. Бұл әдістерде талдау химиялық немесе электрохимиялық реакциялардың көмегімен жүреді, осы реакциялардың нәтижесінде жүйенің физикалық қасиеттері өзгереді. Химиялық құбылыстар ылғи табиғатта жүріп отырады. Өсімдік,жануар ағзаларында жүріп жатқан биологиялық процестердің негізі химиялық реакциялар. Мысалы, жасыл жапырақта күн сәулесі әсерінен көмір қышқыл газы мен судан көмірсулар түзіледі (фотосинтез). Translate the text into English. Химия өте ертеде пайда болған ғылым. Ол өте күрделі даму жолын өтуде. Химия негізінен күнделікті өмірге қажеттіліктен туған. Біздің эрамызға дейінгі 3-4 мың жыл бұрын химиялық өндіріс болған. Ертедегі Египетте түрлі кендерден таза металлдар (темір, қорғасын, мыс, қалайы) алуды білген, алтын, күміс құймалар, шыны ыдыс-аяқ, түрлі бояулар мен иіс су өндіре алған. Сондай-ақ химиялық өндіріс ертедегі Индия және Қытайда жақсы дамыған. Адам және жануарлар ағзалары қореқтік заттардың химиялық ыдрауының және тотығуының нәтижесінде өмір сүре алады. Өсімдік және жануар ағзасында қазіргі кезде 70 жуық химиялық элемент бар екендігі табылған. Олардың рөлі әр түрлі, сондықтан да жануар мен өсімдік ағзаларын химиялық жолмен зерттейді. Translate the text into English. Атом бейтарап бөлшек. Сондықтан атомдағы оң және теріс зарядтар өз ара тең. Атомның оң заряды оның периодтық жүйедегі реттік нөміріне тең. Сонымен,элементтің реттік нөмірі оның ядро зарядын және оны айналып дүрген электрон санын көрсетеді. Д.И.Менделеев ашқан периодты заң мен жүйе атом құрылысын анықтауда ерекше орындалады. Қазір химия өнеркәсібінің дамуында Қазақстанның да алатын орны ерекше. Қазақ жері әр түрлі кенге бай: Қаратау фосфориті,Теміртау темір кеңі, Қарағанды көмірі, Балқаш, Жезқазған мыс кені, Өскемен түсті металлдары, Атырау, Ақтау мұнай мен газы, Шымкент қорғасын кені т.б. Translate the text into English. Күнделікті өмірде біз отынның жануын, металлдардың тотығуын, судың булануын және қатуын, органикалық заттардың жерді құнарландыратынын байқап жүрміз. Осының бәрін құбылыстар деп атайды.Табиғатта екі түрлі құбылыс жүреді. Егер құбылыс нәтижесінде заттың пішіні, агрегаттық күйі ғана өзгеретін болса, ол физикалық құбылыс деп аталады. Атом – молекулалық ілімнің негізін М.В. Ломоносов қалаған. Бұл ілім бойынша зат ең кішкене бөлшек молекуладан, ал молекула атомдардан тұрады. Атом – заттың қасиетін көрсететін ең кіші бөлшек.Ол үнемі қозғалыста болады. . Translate the text into English. Бір заттың басқа затқа айналуы арқылы болатын барлық құбылыстарды химиялық деп есептейді де, затттың осы химиялық өзгеру процесін химиялық реакция деп атайды. Барлық химиялық реакциялар жылу бөле немесе қабылдай жүреді. Сонымен, химия-заттар жайлы, олардың өзгеруі кезіндегі құбылыстар және олардың қасиеттері, құрамы, құрылысы туралы ғылым. Молекула –бірнеше атомдардан тұратын бөлшек.Молекулада үнемі қозғалыста болады. Жай заттардың молекулалары бір түрлі атомдардан тұрады (H2, O2, CL2 және т.б.) күрделі зат молекулаларына әртүрлі атомдар кіреді (H2O, NaCL,NH3 және т.б.) . 6. Translate the text into English. Озон газ күйінде көкшіл, ал сұйык күйінде қара-көк зат. Суда жақсы, ал төрт хлорлы көміртегінде тіпті жақсы ериді. Озон-өте күшті тотыктырғыш, оның тотықтырғыштық қабілеті оттегінікіне қарағанда әлдеқайда жоғары болады, себебі озонның түзілуі эндотермиялық болғандықтан, молекуласы тұрақсыз болады да, өздігінен ыдырап оттегі молекуласы мен атомына айналады. Су - сутегінің оксиді. Ол жер шарында өте көп тараған зат. Судың жалпы мөлшері 2* 1018 т. деп есептеледі, оның 60% мұхиттарда, ал 40% өзен, көл суларында, мұзда, қарда т. б. болады. Су көптеген жай және күрделі заттармен реакцияласып, гидраттар немесе химиялық косылыстар түзеді. Сусыз тіршілік болмайды, су халық шаруашылығында кең қолданылады. Translate the text into English. Табиғи силикаттардан ақ саз немесе каолин керамика өнеркәсібінің негізгі шикізаты алынады. Негізі саздан тұратын әр түрлі заттарды керамика дейді. Керамиканың қарапайым түрлеріне кірпіш, черепица жатады. Керамиканың сапалы түріне фарфор-фаянс (кәрлен) ыдыстары жатады. Құм, сода, әктас кәдімгі шыны алу үшін негізгі шикізаттар болып табылады. Кәдімгі шыныға әртүрлі заттар қосу арқылы түрлі түсті немесе әр түрлі сапалы шынылар алуға болады. Мысалы, шыныға темір (III) ионы жасыл, кобальт (II) ионы көк, марганец (II) ионы қызыл көк түс береді. Металлдар қаттылығы бойынша ерекшеленеді. Ең қатты металл—хром (шыныны кеседі), ал ең жұмсақтары — калий, рубидий және цезий. Олар пышақпен оңай кесіледі. Translate the text into English. Магний – күмістей жарқыраған, мыстан бес есе жеңіл металл. Жеңіл алюминийдің өзі магнийден 1,5 еседей ауыр. Магний 651°С балқиды, алайда оны балқыту өте қиын, өйткені 550°С шамасында ауада көз қаратпайтын жалын түзіп жана бастайды. Магний парамагнитті, механикалық қасиеті өндеуге көп байланысты. Магний галогендермен әрекеттесіп галогенидтер түзеді. Хлор атмосферасында магний бөлме температурасында өздігінен тұтанады. Кальций 1808 ж. ашылған, латынның «калькс» (известь) деген сөзінен, яғни жұмсақ, оңай өңделетін әк, бор минералдарынан атау алған. 1808 ж. ағылшын ғалымы Дэви электролиз арқылы кальцийді алды.Кальций — металдық жылтыры бар, жұмсақ, оңай өңдеуге көнетін металл. Ауада оңай тотығатын болғандықтан оның аз мөлшерін керосинде сақтайды. Translate the text into English. Химиялық реакциялар әр түрлі жылдамдықпен жүреді. Егер бір химиялық реакция өте баяу жүретін болса, басқалары өте тез, ал кейбіреулері қопарылыс бере лезде өтеді.Химиялық реакциялардың жүру жылдамдықтарын және олардың жүру механизмін қарастыратын бөлімді химиялық кинетика деп атайды. Сутегінің оттегімен тағы бір қосылысын сутегінің асқын тотығы Н2О2 деп атайды. Таза сутегі асқын тотығы түссіз, тұтқыр сұйық. Зертханаларда3 немесе 30%-қ сутегі пероксиді қолданылады. Таза сутегі пероксиді қазіргі ракеталық және реактивтік техникада тотықтырғыш ретінде колданылады. Оның тотықтырғыштық қасиеті және түзілген заттардың усыз болуына қарап, сутегі асқын тотығын теріні, жүнді, жібекті, мақта-мата бұйымдарын ағартуға қолданады. Сутегінің асқын тотығы тамақ өнімдерін консервілеуге қолданылады. Translate the text into English. Сутегі түссіз, дәмсіз, иіссіз газ. Барлық газдардың ішіндегі ең жеңілі, ол ауадан 14,5 есе жеңіл. Тығыздығы 0,09г/см 3 (калыпты жағдайда), сұйыққа айналу температурасы—252,6°С, қату температурасы — 259, °С. Сутегі суда аз ериді, судың 100 литрінде сутегінің 2 литрі ериді. Сутегінің молекуласы екі атомнан тұрады. Кәдімгі жағдайда сутегінің белсенділігі төмен тұрақты зат, ал қыздырғанда белсенділігі артып, көптеген бейметаллдармен әрекеттеcеді. Көміртегі табиғатта бос күйінде де, қосылыс күйінде де кездеседі. Қөміртегінің көпшілік мөлшері- 99%- қосылыстар — минералдар, әсіресе кальций мен магнийдің карбонаттары түрінде тараған. Көміртегі тас көмірдің, коңыр көмірдің, мұнайдың, табиғи газдардың құрамына кіреді. Барлық тірі ағзалардың денесі (өсімдіктердің, жануарлардың, адамның) көміртегінің қосылыстарынан тұрады. Көміртегі (IV) оксиді ауада (0,03%), мұхит, теңіз, өзен суларында, шипалы суларда еріген түрде болады. Көміртегі бос күйінде алмаз, графит жай заттары түрінде тараған. Translate the text into English. Дисперстік жүйелер – дисперстік орта және дисперсті фазадан тұрады. Дисперстік орта біртекті дисперстік фаза тараған зат. Ондай ортаға тараған кішкентай зат бөлшектері дисперстік фаза болып табылады. Мысалы, лай судағы су- дисперстік орта, ал ондағы топырақтың бөлшектері-дисперстік фаза болып табылады. Органикалық қосылыстардың түрленулері химияның жалпы заңдарына, сондай-ақ тек қана органикалық қосылыстардың өздеріне тән ерекше заңдылықтарға бағынады. Органикалық қосылыстар әдетте бейорганикалық қосылыстарға қарағанда тұрақсыздау, тотығуы (жануы) оңай, олардың басым көпшілігінің атомдары арасында тек қана ковалентті байланыс бар. Level Translate the text into Кazakh and Retelling the text. The Science of Chemistry Chemistry deals with the properties, composition and structure of the materials our world and all that it contains are composed of, with the changes' by which these materials are converted into other materials and the accompanying energy changes. On the one hand chemistry is linked with biology through biochemistry, and on the other with physics through physical chemistry. Chemistry is concerned with different forms of matter, such as water, salt, iron, sugar, oxy gen, etc! The connection of chemistry with energy has to do with the energy (changes that accompany chemical transformations of matter from one form into another. All changes of one kind of matter into another are accompanied by the absorption or liberation of energy, usually in the form of heat. Now there are more than 30 different branches of chemistry. Some of them are: inorganic chemistry, organic chemistry, physical chemistry, analytical chemistry, nuclear chemistry, colloidal chemistry, and electrochemistry. Inorganic chemistry deals with substances obtained directly or indirectly from minerals, ores and similar sources. Organic chemistry deals with substances which. are composed in part of carbon, and many of which are associated in/some ways with living bodies, plants, and animals. Physical chemistry is concerned with those parts of chemistry which are closely linked with physics. Physical chemistry includes many of the principles of physics as well as those of chemistry. The knowledge of this division of the science is particularly important in all fields of chemistry, since its fundamental laws are the basis all the different divisions are established upon. Analytical chemistry is concerned with the identification, separation, and quantitative measurement of the composition of different substances that occur in nature. Nuclear chemistry deals with the transformations of atomic nuclei and with the reactions which take place between them. The States of Matter That matter may exist in three physical states: solid, liquid or gas is a common knowledge. It is usually possible to change matter from one state to the other by changing its temperature. For instance, a piece of ice is called a solid; it may melt and form a liquid; as it evaporates, liquid water changes into a vapour, i.e. into the gaseous state. Many kinds of matter, like water, can be obtained in each of the three states; for some, however, extraordinary means have to be used in order to produce one, or even two of the states; and for others, only two states are known or can be produced. Common salt for example, exists normally as a solid; at a temperature of several hundred degrees, it can be liquefied; and at still higher temperature it is converted into vapour. Carbon, a solid under normal conditions, can be vaporized, but it has never been liquefied. Solids have both a definite volume and a definite shape. Liquids too, have a definite volume, but they take the shape of their containers. Gases have neither a definite shape nor a definite volume. A chemist must have a thorough knowledge1 of the states of matter and of the physical laws which govern the behavior of matter in various states. That all matter is composed of molecules is known to everybody. The question which must be answered, then, is: if all matter is composed of molecules, what is the essential difference between the states of matter? The answer to this question is that the essential difference between these states is the relative quantities of energy molecules possess in different states. Changes of Matter None of the properties oil a substance is more important to the chemist than the changes the substance can undergo, and no knowledge about the substance is more important than information concerning the conditions that are necessary to effect these changes. We know of many changes that occur continually around us and that alter greatly the different forms of matter we are acquainted with. These changes are either physical or chemical. Chemical changes are those matter changes in which a change of composition takes place. Such changes are permanent, i.e. they cannot be undone1 by simple application of some physical means, such as heating, cooling, or evaporation, but the new substance, or substances formed persist2 unless they are subjected to another chemical change. In determining whether a given matter change is a physical or chemical change, the essential question is whether or not one or more substances, with properties different from those of the substance or substances existing before the change, have been formed. Thus iron is a hard, grayish, lustrous substance but when it is left exposed to moist air it is slowly transformed into a red crumble material (iron rust) quite different in properties from the original iron. Physical changes When physical changes occur, some of the properties of a substance may be altered for a time, but no new substances are formed. The following are the examples or a physical change: 1) the melting of ice and the condensation of steam; 2) the mixing of sugar with water to form a solution; 3) the change observed when a platinum wire1 is heated to redness. In each of these there is a change in properties. Thus, a liquid is produced from a solid when ice melts, and a gas is changed into a liquid when steam condenses. When sugar dissolves, it, too, changes from the solid to the liquid state. The platinum wire changes, when heated, from a silvery lustrous metal that reflects light to one that emits light. But there is no alteration of the fundamental character of any of the substances during these changes. Sugar dissolved in water retains, its original properties and only forms a mixture from which it is readily obtained again in its crystalline form by allowing the water to evaporate.
6. Translate the text into Кazakh and Retelling the text. Boyle's Law The quantity of matter in a given body is generally determined by weight, but it is often convenient, when the given body is a gas or a liquid, to measure the quantity of matter indirectly by volume. Volumetric analysis is based on such measurements; and the analysis of gases is nearly always connected by volume measurements. The main advantage of measurement by volume is rapid execution; the main advantage of measurement by weight arises from the fact that the result is largely independent of the physical and chemical conditions of the body in question. The weight of a gas is usually so small in comparison with its volume that it is generally possible to determine the quantity of a gas more accurately by volume than by weight. The volume of a gas is very sensitive to changes of pressure. While investigating the relation between the pressure and the volume of a gas, Robert Boyle found that the volume of a gas kept at one uniform temperature varies inversely as the pressure. This is Boyle's law. Later on some deviations from Boyle's law have been found. Water Water is a compound substance which consists of two elements hydrogen and oxygen. It can be decomposed by the electric current. By decomposing water two volumes of hydrogen and one volume of oxygen are obtained. That water is a compound substance may be shown by the reaction between water and some metals. At ordinary temperature, pure water is a tasteless, odourless and colourless liquid. We know that water boils at 100°C under 760 mm pressure. The greater the pressure, the higher the boiling point, the less the pressure, the lower the boiling point. Steam or water vapour is an invisible colourless gas that condenses to a visible cloud of small particles when it comes in contact with the atmosphere. Liquid water freezes at 0°C into crystalline ice. The expansion of water when it is cooled from 4° to 0° is very small. When the water on the surface cools it contracts. The heavier cold water sinks and the warm water rises. This circulation cools the temperature of the whole body of water down to 4°. The specific gravity of ice at 0° varies with its mode of formation. The molecules in a liquid are much closer together than it is in the case with gases and they have powerful intermolecular forces. The molecules in the body of the liquid are attracted by the other molecules in all directions. Metallic Magnesium Magnesium is made by the electrolysis of fused anhydrous magnesium chloride at temperature above the melting point of magnesium with a graphite anode and an iron cathode. Metallic magnesium melts at 632° and boils at about 1200°C. It should be noted that it is soluble in cold dry air, but in moist air it is slowly oxidized; it burns with bright flame and the brightness is partly due to the large evolution of heat and partly to the presence of a non-volatile oxide. It gives out 10 per cent of the energy as visible radiation. Magnesium has a potential to the normal hydrogen electrode of 1.31 volts. According to Nernst equation it would be in equilibrium with hydrogen under a pressure of 1045 atmospheres. If it were heated to red heat it would reduce carbon monoxide, carbon dioxide, sulphur dioxide, nitric oxide and nitrous oxide. It combines directly with nitrogen, sulphur, the halogens, phosphorus, and arsenic; at 200°C it reacts with methyl alcohol giving magnesium methylene Mg(0.CH3)2. Magnesium is of great value as a constituent of light alloys, such as magnesium-aluminium alloy; its density is from 2.0 to 2.5. As would be expected, these alloys, like magnesium itself, are all stable in air under a thin protective layer of oxide, but it would not be the case under water. Thus if stable magnesium alloys are desired, it is required that they be not kept under water. The spectrum of magnesium vapour in hydrogen at low pressures gives bands which are due to a hydride MgH2; the spectrum of the corresponding deuteride MgD has also been obtained. But of the existence of a solid insoluble hydride MgH2 there is no satisfactory evidence. There are two binary carbides of magnesium, which cannot be got pure enough, but from their behaviour it is evident that they have the compositions Mg2 and Mg2C3. Neither can be made by heating magnesium or its oxides with carbon to a high temperature and both are thermodynamically unstable above 800°C. They can only be made by heating the metal with acetylene or other hydrocarbons. Preparation of Oxygen It should be noted that the properties of oxygen are affected by the presence of other gases in the air. Consequently, to investigate its properties accurately, care should be taken to have the gas in pure form. Besides, there are many commercial use, of oxygen requiring that it should be in a high degree purity so as to eliminate the effect of the presence of other gases. It is customary to discuss the preparation of an element or compound under two categories—commercial method and laboratory method. When a substance is to be prepared on a commercial scale the method employed must utilize inexpensive and readily available materials. For laboratory preparation, on the other hand, cost is not a deciding factor in the selection of the method which is to be employed. The purity of the product and the simplicity of the procedure are the important considerations. Account is to be taken of the fact that no naturally occurring materials, except air and water, are suitable for direct use in the preparation of oxygen. One method being often employed for obtaining oxygen is by fractional distillation of air. Another method which is being employed more and more widely is to decompose water by passing through it a current of electricity. Oxygen prepared in this way is more nearly pure3 than that obtained from liquid air, but the cost is considerably greater. Properties of Oxygen This element is most widely distfibuted1/in nature; 47.3 per cent of the solid crust of the earth, 88.81 per cent of water and 23.15 per cent of air is oxygen. In air it exists in a free state. In a combined state it exists in limestone, sand, marble, clay, quartz, iron, and many other substances. It is prepared by heating certain of its compounds, some of which are mercuric oxide* potassium chlorate and manganese dioxide; it may be obtained by the decomposition of water by electrolysis. Oxygen is at an ordinary temperature a colourless, odourless and tasteless gas, heavier than air and slightly soluble in water. 100 volumes of water at 0° can dissolve 4 volumes of oxygen under the normal pressure of 760 mm. At a low temperature and a high pressure it is converted into a liquid boiling at — 181°C. Sulphuric Acid The periodic table is a tabular arrangement of the chemical elements, ordered by their atomic number (number of protons), electron configurations, and recurring chemical properties. This ordering shows periodic trends, such as elements with similar behavior in the same column. It also shows four rectangular blocks with some approximately similar chemical properties. In general, within one row (period) the elements are metals on the left hand side, and non-metals on the right hand side. The rows of the table are called periods; the columns are called groups. Six groups (columns) have names as well as numbers: for example, group 17 elements are the halogens; and group 18, the noble gases. The periodic table can be used to derive relationships between the properties of the elements, and predict the properties of new elements yet to be discovered or synthesized. The periodic table provides a useful framework for analyzing chemical behavior, and is widely used in chemistry and other sciences. Dmitri Mendeleev published in 1869 the first widely recognized periodic table. He developed his table to illustrate periodic trends in the properties of the then-known elements. Mendeleev also predicted some properties of then-unknown elements that would be expected to fill gaps in this table. Most of his predictions were proved correct when the elements in question were subsequently discovered. Mendeleev's periodic table has since been expanded and refined with the discovery or synthesis of further new elements and the development of new theoretical models to explain chemical behavior. Beryllium Beryllium oxide, BeO, is made by heating the hydroxide to 440°, or better the basic carbonate to 1,100°. It has a (4:1) lattice, showing that it is covalent in the solid state; herein it differs from the oxides of the alkaline earths (including magnesium), which all have the ionized sodium chloride (6:1) structure, the differences being due to the smaller size and hence the greater deforming power of the beryllium ton. BeO melts at 2,570°. It dissolves in acids, but the more slowly the higher it has been heated. It has been shown (from the heat of the solution in hydrofluoric acid) that the energy content of the solid is the greater the lower the temperature of preparation. This may be due to a more colloidal state of the tow temperature specimens, with the lattice becoming more complete after exposure to a high temperature; this view is supported by X-ray examination. Beryllium hydroxide, Be(OH)2 is precipitated from the solution of beryllium salts by hydroxyl ion, with the precipitate readily dissolving in the excess of alkali. Other conditions being equal, beryllium hydroxide crystallizes out from the solution slowly only on standing. This implies that there are two forms of hydroxide, one being more soluble and less stable than the other. The conclusion has been confirmed by direct measurement of solubility. The precipitate first formed is gelatinous, this being changed into an unstable crystalline a-form, and that on standing into a stable P-form, which is only about 1/25 as soluble. Contrary to earlier statements, neither the a-nor the! P-form absorbs carbon dioxide. Even the P-form will dissolve in highly concentrated (10-normal) sodium hydroxide, there being formed the beryllates NaHB2О2, or Na2BeО2. Beryllium hydroxide dissolves readily in solutions of beryllium salts. It does not dissolve in solutions of ammonium salts, or of most amines, but it does in a solution of ethelene diamine. Beryllium, unlike all other elements of Group II, will not form a peroxide. The importance of chemistry We can name chemistry an industry of wonderful changes. Chemistry makes more and more substances from animals, vegetable and mineral materials. We can manufacture various kinds of the substances with the help of materials synthesis, which it is not found in nature. There are synthetic rubber plastics, artificial fuel, colours, medicines and so on produced by chemistry industry. Basic chemistry industry products are acids, alkalis, salts and they are produced in the large quantity Chemistry plays a fundamental role in the development of agriculture. Without chemistry modern metallurgy is impossible. For example, production of such substances and facilities as: mineral fertilizers, regulators of the plants growth, chemical substances of plants protection, chemical addivatives and conservants for animal fodder, and numerous polymer materials. By chemical method different kinds of significant metals are produced and also it protection ways from corrosion are proposed. For example: spaceship, new fuel. The most consequential task of the chemistry is environmental protection, in particular sewage purification, control of water and air cleanness, nonwaste production. The deep knowledge of chemistry is necessary for development of agriculture and specialists in the other fields. Covalent bond A covalent bond is a chemical bond that involves the sharing of electron pairs between atoms; there is an attraction between these electrons and the nucleus of atoms. Covalent bonding includes many kinds of interactions, including σ-bonding, π-bonding, metal-to-metal bonding, agostic interactions, and three-center two-electron bonds. The term covalent bond dates from 1939. The prefix co- means jointly, associated in action, partnered to a lesser degree, etc.; thus a "co-valent bond", in essence, means that the atoms share "valence", such as is discussed in valence bond theory. In the molecule H2, the hydrogen atoms share the two electrons via covalent bonding. Covalency is greatest between atoms of similar electronegativities. Thus, covalent bonding does not necessarily require that the two atoms be of the same elements, only that they are comparable electronegativity. Covalent bonding that entails sharing of electrons over more than two atoms is said to be delocalized. At present 2 theories (ways) of covalent bond are considered: A) Valence bonding theory (VBT); B) Molecular orbitals theory (MOT). A) In 1927 the German scientists Baitler and London proposed VBT theory. Covalent bonds are affected by the electronegativity of the connected atoms. The electronegativity of the atom is its ability to attraction of electrons pair. The electronegativity by the period is increased, and by the group is decreased and fluorine (F) is the most electronegativity element. Two atoms with equal electronegativity will make nonpolar covalent bonds such as H–H. An unequal relationship creates a polar covalent bond such as with H−Cl.
19. Translate the text into Кazakh and Retelling the text. Chemicalequilibrium Chemical equilibrium is the state in which both reactants and products are present in concentrations which have no further tendency to change with time.[1] Usually, this state results when the forward reaction proceeds at the same rate as the reverse reaction. The reaction rates of the forward and backward reactions are generally not zero, but equal. Thus, there are no net changes in the concentrations of the reactant(s) and product(s). Such a state is known as dynamic equilibrium. The concept of chemical equilibrium was developed after Berthollet (1803) found that some chemical reactions are reversible. For any reaction mixture to exist at equilibrium, the rates of the forward and backward (reverse) reactions are equal. In the following chemical equation with arrows pointing both ways to indicate equilibrium, A and B are reactant chemical species, C and D are product species, and a,b,c and d are the stoichiometric coefficients of the respective reactants and products:
The equilibrium position of a reaction is said to lie "far to the right" if, at equilibrium, nearly all the reactants are consumed. Conversely the equilibrium position is said to be "far to the left" if hardly any product is formed from the reactants.
Nuclear reactions The transformation process of one element into another element is called nuclear reaction. When we write the nuclear reaction equation, we must keep the equality of the particles charges and masses situated in the left and right sides. The phenomenon of transformation into another element at the decomposition of the elements nuclei are called natural radioactivity dissociation (all elements after uranium are predisposed to radioactive dissociation). At natural radioactivity atoms nuclei radiate from one of 1) 2)
3)
Sulphuric Acid Sulphuric acid is a heavy colourless liquid which forms a constant boiling solution containing 98.33 per cent sulphuric acid. The boiling point of such a solution is 338°. Having been heated such a solution dissociates, yielding sulphur trioxide in water. One has to take into account that sulphuric acid has a great affinity for water, with which it unites with great evolution of heat. For this reason, the acid when it is to be diluted with water, must always be poured gradually into an excess of water. One should not proceed in the reverse manner, i.e. to pour the water into acid, for the great amount of heat suddenly liberated is certain to lead to explosions throwing the acid out of the container. On the other hand, this affinity for water makes sulphuric acid one of the best drying agents for gases it does not react chemically with. Some of them when heated with sulphuric acid contain less moisture than otherwise. When the concentrated acid is poured into water the liberation of heat indicates that the acid reacts with water to form hydrates. From the general properties of oxy acids we might expect that sulphuric acid is much stronger than sulphurous acid and this is really the case.
Level 1. Topic “Physical-chemical properties of alcohols”. 2. Topic “Chemistry in my life” 3. Topic “Qualitative analysis of analytical chemistry” 4. Topic “Theoretical foundation of organic chemistry” 5. Topic “Chemical properties of Hydrochloric acid” 6. Topic “Quantitative analysis of analytical chemistry” 7. Topic “Chemical properties of phosphorus” 8. Topic “ Ecological problems of our region” 9. Topic “Ecological problems of air protection” 10. Topic “Pollution of water”. 11. Topic “Chemical glassware and instrument” 12. Topic “Industrial production of inorganic compounds”. 13. Topic “Freons and ozone” 14. Topic “Aerosols”. 15. Topic “Basic chemical concepts” 16. Topic “Electrolysis” 17. Topic “Carbohydrates” 18. Topic “Classification of inorganic substances” 19. Topic “The theory of hybridization” 20. Topic “Aromatic hydrocarbons” 21. Topic “Modern problems of ecology and chemical industry” 22. Topic “Proteins” 23. Topic “General properties of metals” 24. Topic “Carbon and its properties” 25. Topic “Classification of organic compounds” Examination guestions of discipline «Professionally-oriented foreign language» Level
|
||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 514; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.170 (0.011 с.) |

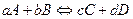
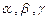 rays.
rays.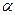 - helium nucleus
- helium nucleus 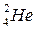 ;
;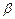 - high-speed stream of electrons;
- high-speed stream of electrons; - electrons stream;
- electrons stream;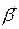 - positron stream.
- positron stream.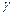 - short electromagnetic waves.
- short electromagnetic waves.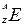
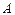 – mass number;
– mass number;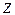 – atomic number.
– atomic number.