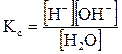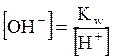Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Частные случаи принципа Ле Шателье
1) Повышение температуры смещает равновесие в сторону эндотермической, а понижение температуры — в сторону экзотермической реакции. Рассмотрим влияние температуры на равновесие обратимой биохимической реакции Hb + O2 При повышении температуры равновесие смешается влево (кровь отдает кислород тканям), при понижении температуры равновесие смещается вправо (кровь обогащается кислородом). 2) При повышении давления равновесие смещается в сторону меньшего количества газообразных веществ, а при понижении давления — в сторону их большего количества. Изменение давления не влияет на смещение химического равновесия, если: (а) в реакции не участвуют газы; (б) реакция протекает без изменения количества газообразных веществ. Например, N2 + O2 Используя данный принцип, можно рассмотреть влияние давления на равновесие обратимой реакции окисления гемоглобина в оксигемоглобин. Венозная кровь поступает в легкие, где испытывает повышенное давлении кислорода О2. В результате равновесие смещается вправо (кровь насыщается кислородом). Артериальная кровь, поступающая в ткани, оказывается при пониженном давлении кислорода, в результате чего равновесие смещается влево (кровь отдает кислород тканям). 3) При увеличении концентрации вещества, участвующего в обратимом превращении, равновесие смещается в сторону той реакции, которая протекает с убылью этого вещества (и наоборот). Например, при увеличении содержания гемоглобина в крови равновесие смещается вправо (ткани обогащаются кислородом). При недостатке гемоглобина (анемия) равновесие смещается влево (больной страдает от кислородной недостаточности).
Равновесие в биологических средах
Важнейшей биологической средой является вода. Описание процессов, протекающих в водных растворах, возможно с позиций теории химического равновесия. Многие процессы, играющие важную роль в метаболизме живых организмов, связаны с обратимым переносом протонов (протолитические равновесия). К важнейшим протолитическим равновесиям относится диссоциация воды, протекающая по уравнению: H2O Вода – очень слабый электролит; при комнатной температуре из 5 млн. молекул воды только одна молекула диссоциирует на ионы. Поскольку молярная концентрация молекул воды значительно превышает молярную концентрацию ионов ([H2O] >>[H+]), то можно считать, что концентрация молекул воды является величиной постоянной ([H2O] = const). Применив закон действующих масс, напишем выражение для концентрационной константы равновесия рассматриваемого процесса:
Умножив левую и правую части уравнения на [H2O], получим уравнение Кс [H2O] = [H+][OH-], где Kс [H2O] = Kw Kw — ионное произведение воды; эта величина является константой равновесия, описывающей обратимую диссоциацию воды. При стандартной температуре (t = 25oC) Кw = [H+][OH-] = 10-14. Для воды и водных растворов:
Не менее важным является протолитическое равновесие, устанавливающееся при диссоциации слабых кислот и оснований. Уксусная кислота является слабым электролитом. Ее диссоциация протекает обратимо по уравнению: CH3COOH Константа равновесия, описывающая данный обратимый процесс обозначается Ka и называется константой кислотности:
Аммоний гидроксид является слабым электролитом. Его диссоциация протекает обратимо по уравнению: NH4OH Константа равновесия, описывающая данный обратимый процесс обозначается Kb и называется константой основности:
Чем больше Ка и Kb, тем сильнее диссоциируют кислоты и основания в водных растворах. К протолитическим равновесиям, играющим важную биологическую роль, относятся реакциигидролитического разложения веществ.Гидролиз солей — это реакция ионного обмена между составными частями соли и воды, протекающая с изменением кислотности раствора. Гидролизу подвергаются растворимые соли, в состав которых входят катионы слабых оснований или анионы слабых кислот.
|
|||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 689; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.150.119 (0.006 с.) |
 HbO2,ΔrН = – 10 кДж.
HbO2,ΔrН = – 10 кДж.