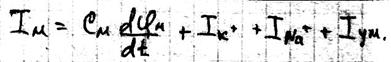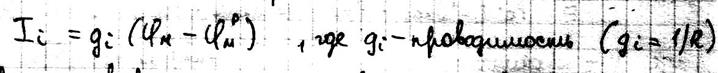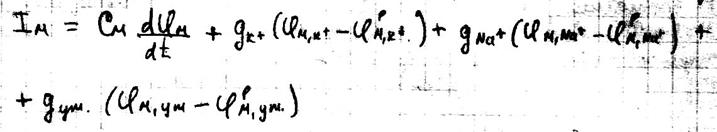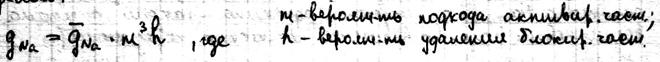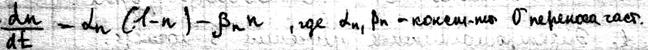Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные энергетические опроцессы в биосфереСтр 1 из 8Следующая ⇒
Основные энергетические опроцессы в биосфере Согласно современным представлениям вселенная появилась в результате взрыва малого сгустка большой плотности. Примерно 10 в 10-й степени лет стал расширяться взрывным образом. Из фотонов и нейтрина возникали электроны и нуклоны (протон+нейтрон). По мере охлаждения Вселенной возникали тяжелые и легкие ядра. Сила всемирного тяготения (гравитация) определила возникновение галактик и звезд. При высоком гравитационном сжатии плазмы резко повышается температура и возникают термоядерные процессы – взрывы сверхновых звезд. Наша солнечная система возникла как вспышка сверхновой звезды 4,5 млрд. лет назад. А жизнь возникла 3,5 млрд. лет назад. Основа нашей жизни – космическое новообразование. Источник жизни является энергия солнечного излучения. Живой мир зависит от термоядерной реакции на Солнце (происходит непрерывное превращение водорода в гелий.
Где h – постоянная Планка, а v – частота испускаемого света. Преобразование одного атома гелия ведет к потере частиц, масса которых превращается в энергию. На 4 грамма гелия исчезает 0,029 грамм массы. Т.о. на солнце каждую минуту исчезает сотни млн тонн массы, которая превращается в энергию и излучается в космос. Излучение идет в виде света, рентгеновсого излучения, радиоволн, инфракрасного излучения. Большая часть Е поглощается атмосферой, в основном это УФ свет. Атмосферой поглощается 30% солнечной Е. Около 50% превращ в тепло и излучается с поверхности земли обратно в атмосферу в виде инфракрасного излучения. Часть излучения задерживается при этом (парниковый эффект) 20% Е расходуется на образование облаков. 0,02% поглощается растениями, которые используют солнечную энергию для образования молекул, богатых Е (сахара фотосинтеза). Вся жизнь биосферы зависит от поглощения Е. Высшие растения и животные используют запасенную Е для окисления пищи и выделения Е в виде тепла, которое запасается в виде Е для работы организма
Хим Е, запасающаяся в высокомолекулярных веществах, организмом превращается в механическую, электрическую и физ-хим Е рабочих процессов. При этих превращениях образуются вещества, которые не могут быть использованы и поэтому они выводятся в окружающую среду. Так совершается биологический цикл: поступление à превращение à выведение веществ и Е из организма в окружающую среду.
Отличие живых объектов от неживых с точки зрения биологии и термодинамики Живой организм – открытая саморег, саморазвив. и самовоспроизводящаяся гетерогенная система, важнейшими функциональными веществами которой являются биополимеры (Б и НК). Организм – система историческая, так как развивается в процессе эволюции с момента зарождения до смерти. Неживая природа не имеет дела с историей и эволюцией. Электроны, атомы, молекулы характеризуются постоянными свойствами, не зависящими от их происхождения и на все время остаются постоянными. Следовательно, неживая природа не рассматривается как индивид природног развития. Отличительные черты живого от неживого: самовоспроизведение, саморегуляция, саморазвитие. Открытые ТС обмениваются с окр средой и Е и веществом. Все живые организмы являются открытыми термодинамическими системами.
Первый закон термодинамики I начало термодинамики показывает, что внутренняя энергия сис-мы – это кол-во теплоты, поглощенное телом за вычетом работы, совершаемой сис-мой.
Внутренняя энергия сис-мы не зависит от пути, который прошла сис-ма из одного состояния в другое, а зависит от исходного и конечного состояния. Теплота и работа зависят от этого пути. I начало термодинамики – это закон сохранения энергии. В состоянии равновесия Если отнести кол-во теплоты к t0, то получается одна из основных характеристик сис-мы – энтропия.
В термодинамической сис-ме совершаются следующие виды работы: 1) механическая dW = Fdx(F – сила, х - перемещение), если сил несколько, то dW = ∑Fidx. 2) работа по изменению объема dW0 = рdV(осмотическая работа). 3) работа электрических сил dWэ = ∑Еidq (Е- электродвижущие силы, q - заряд). 4) работа химических сил dWх = -∑nkRTD(ln Ck) (nk – число молей в-ва, R – универсальная газовая постоянная, Т – t0 абсолютная, Ck – объем, приходящийся на 1 моль). Полная запись I начала термодинамики.
В применении к биологическим сис-мам выражение для механической работы используется для описания мышечного сокращения. Электрическая работа важна для описания работы мембран. Химическая работа – для изучения ферментативной активности. Функциональная деятельность организма может быть представлена как ∑ внешних рабочих процессов. Наиболее общим свойством живой материи является способность излучать тепло. Следствием I начала термодинамики является закон Гесса – II закон термодинамики – кол-во тепла, которое выделяется при химических процессах зависит только от начального и конечного состояния сис-мы тел, и не зависит от пути по которому протекают р-ции.
Теорема Пригожина Важным понятием термодинамики необратимых процессов является понятие стационарного состояния. Отличие стационарного состояния от равновесного состояния в том, что макроскопические процессы не прекращаются, а идут с постоянной скоростью. Основным вопросом является то, по какому критерию оценивать состояние. Был введен экстремальный принцип (теорема Пригожина) для оценки стационарного состояния – в стационарном состоянии при фиксированных внешних параметрах скорость продукции энтропии постоянна во времени и минимальна по величине. Из этого следует, что если система выведена из стационарного состояния, то она будет изменяться до тех пор, пока удельная скорость продукции энтропии не примет наименьшего значения:
Теорема Пригожина нашла отражение в биологических системах и получила название автостабилизации или принципа Ле-Шателье – если система находится в состоянии равновесия, то при действии на неё сил, вызывающих нарушение равновесия, система приходит в состояние, при котором эффект внешнего воздействия ослабляется. Применительно к живым системам это означает, что увеличение потока положительной энтропии при отклонении био системы от стационарного состояния приводит к ограничению этого потока за счет внутренних изменений в био системе. Система настраивается на термодинамически более выгодный режим функционирования Константа равновесия. Особенностью кинетики биологических процессов является наличие в системе агентов, способных влиять на скорость р-ций. К ним относятся ферменты, катализирующие биохим. превращения. Ферментативная кинетика изучает закономерности влияния химической природы реагирующих веществ и усл. их взаимодействия на скорость р-ций. На скорость хим. Р. влияют следующие факторы: -t0. v скорость р-ций увеличивается с увеличением температуры до определенного предела. -т.к.ферменты содержат Ко-ферменты и металлы, то скорость р.зависит от концентрации Ко-ферментов и металлов. -присутствия в р-ре разл. активизаторов и ингибиторов ферментов.
v1,v-1-v прям. И обр. р-ций. Чтобы выразить эту v: v1=k1[A]*[В], v-1=k-1[C]*[D] v1 пропорциональна произведению концентраций А и В, v-1 –концентраций С и D.к1 –константа скорости. это нормированная скорость, т.е. она равна скорости р-ции при концентрации реагирующих веществ =1. Если имеет место химическое равновесие, т.е. v1 = v-1 то можно записать: k1[A]*[В]= k-1[C]*[D] или k1\ k-1= [C]*[D]) \ ([A]*[В]) = keq, keq-константа равновесия -она равна произведению концентрации исх.в-в при состоянии равновесия.
Уравнение Михаэлеса-Ментен. В начале 20 в.было установлено, что если концентрацию F поддерживать, t- const, а начальную концентрацию субстрата изменять в широких пределах, то изменение начальной скорости р-ции выражается прямой с насыщением:
k2 k1
k1 1 2 на первой обратимой стадии образуется фермент-субстратный комплекс, который затем необратимо распадается на конечный продукт и освобождает молекулу F для участия в следующем цикле. Кинетическое изменение концентрации реагирующих веществ имеют вид: ds\dt= -k2 es + k -1 (es) de\dt = -k2 es + k -1 (es) +k1(es) d(es)\dt = k2es – k -1 (es) – k1(es) dp\dt = k1(es) = - ds\dt чтобы решить эту систему уравнений, наложим дополнительное условие закрытости на систему.Общее количество s, p в реакции остается сопst. Общ количество молекул F также постоянно. s+p = const e + (es) = e0 =const d(e+es))\dt=0 de\dt= -de\dt используя эти данные запишем с-му уравнений так: des\dt=k2s[e0 – (es)]-k-1(es-k1(es) des\dt=k2e0s – es (k2s + k-1 +k1)
(es)= k2e0s\ (k2s + k-1 +k1) или (es)= e0s\km+s –уравнение Михаэлис-Ментена
К m=к-1 +к1\к2 + s, Кm –константа Михаэлеса. По размерности и физ.смыслу Кm представляет собой концентрацию субстрата, при которой половина молекула субстрата, при котором половина молекул фермента пребывает в состоянии комплекса. Стационарность ферментативного процесса имеет место там,где конкуренция субстрата больше конкуренции фермента, т.е. происходит непрерывный приток субстрата и отток продуктов. Для скорости р-ции V=-ds\dt имеем V=k1е0\(кm+S) При очень большой концентрации S,Vстремиться VmaxS\(km+S) Лайнувер и Берк предложили перейти к линейной форме, где показывают обратную зависимость:1\v=1\vmax(km\S +1) – уравнение Лайнувер-Берка.
Это у-ние наиболее удобно для проверки:
Константа равновесия. Особенностью кинетики биологических процессов является наличие в системе агентов, способных влиять на скорость р-ций. К ним относятся ферменты, катализирующие биохим. превращения. Ферментативная кинетика изучает закономерности влияния химической природы реагирующих веществ и усл. их взаимодействия на скорость р-ций. На скорость хим. Р. влияют следующие факторы: -t0. v скорость р-ций увеличивается с увеличением температуры до определенного предела. -т.к.ферменты содержат Ко-ферменты и металлы, то скорость р.зависит от концентрации Ко-ферментов и металлов. -присутствия в р-ре разл. активизаторов и ингибиторов ферментов.
v1,v-1-v прям. И обр. р-ций. Чтобы выразить эту v: v1=k1[A]*[В], v-1=k-1[C]*[D] v1 пропорциональна произведению концентраций А и В, v-1 –концентраций С и D.к1 –константа скорости. это нормированная скорость, т.е. она равна скорости р-ции при концентрации реагирующих веществ =1. Если имеет место химическое равновесие, т.е. v1 = v-1 то можно записать: k1[A]*[В]= k-1[C]*[D] или k1\ k-1= [C]*[D]) \ ([A]*[В]) = keq, keq-константа равновесия -она равна произведению концентрации исх.в-в при состоянии равновесия.
25 стационарное состояние и классификация полиферментных систем. Весь цикл обмена представляет собой открытую систему, в кот. Всё время поступают в-ва из внешней среды. Они претерпевают превращения в организме и удаляются в виде конечных продуктов. Регуляция биохимических процессов в клетке осуществляется с помощью прямой и обратной связи. Назначение регуляции состоит в том, чтобы поддерживать концентрации азличных в-в в клетке на уровне, кот. Определяется потребностями клетки. Большинство биохимических реакций катализируется ферментами, поэтому механизм регуляции заключается в изменении активности и концентрации фермента. Полиферментной называется система, взаимосвязанных ферментов, катализирующих различные стадии метаболических процессов. Если в полиферментной с-ме концентрации всех компонентов, а именно фермента, субстрата и продуктов р-ции, с течением времени остаются const, то с-ма нах-ся в стационарном состоянии. Отличие стационарной состояния от равновесного, что в стац состоянии ч\з с-му проходит постоянный стационарный поток в-ва и такое состояние х-ся const потоком энергии. По своему составу полиферментные системы могут быть гомои гетерогенными. Наиболее важными процессом в полиферментных с-мах можно классифицировать на следующие типы:
Разветвленные цепи; Полилинейные Цепи.
Распределительные системы Циклические системы;
Отдельно можем выделить саморегулирующая с-ма (с-мы с обратной связью)
26 свободно радикальные процессы в биологических системах
в биологических процессах все виды пластического синтеза иэ энергообмена осуществляется дискретным путем, в котором большую роль играет одноэлектронная передача энергии и образование парамагнитных частиц с одиночными или неспаренными эл-ми(свободные радикалы). Свободные радикалы обладают высокой активностью. Меж числом неспаренных эл-нов и понятием свободная валентность атома есть прямое тождество. В-ва с неспаренными э-ми разделены на 2 гр: - в - ва,у которых неспаренные электроны связаны либо со всей мол екулой, либо с её большей частью. Эти неспаренные э-ны перемещаются по сильно делокализованным молекулярным орбиталям и обуславливают высокую активность внешних групп атомов. - в-ва, у которых неспаренные эл-ны связываются с молекулой с одним атомом. Они не перемещаются по молекулярным орбиталям, которые охватывали все атомы. Такие неспаренные Эл-ны связ. с атомами переходной группы(Fe,Co,Ni)/ эти неспаренные электроны представляют собой интерес для исследования полупроводниковых механизмов.
Именно этим определяется -монорадикалы с одним неспаренным Эл-ном(ОН-) -бирадикалы с 2-мя неспаренными Эл-ми. -ионрадикалы
Функции белков. Б. молекулы – самые сложные и разнообр. из всех молекул, входящих в состав клеток организма. Ф-ции белков разнообр. Важнейш. – каталит. ф. Ни одна био. р-ция не проходит без участия белкового катализатора – фермента. Б. выполн. роль опорных веществ, входя в состав кожи (коллаген), волос, перьев (кератин). Б. отвеч. За клеточн. и внутриклеточн. движ. Сокр.Б. (миозин, актин, тропомиозин, тропонин) вход. в состав мышечных волокон и осущ. превр. хим. енерг. в механическую. Б. в компл. с липидами вход. в состав мембр. кл. и обеспеч. актив. транспорт в-в в кл. и из неё. Б. участв. в проц. дых. и обеспеч. окисление пищи.
Строение белковой глобулы. Глобулярные белки- это б. полипептидные звенья которых свёрнуты в компакт или эллипсоид структуры, кот наз глобулами. Представители таких б. – альбумины, глобулины, гистоны. Глобулярные б. вып динамические ф-ции. белковая глобула обр в клетке в водной среде. Вода влияет на водор св глобулы. для стабилизации элем 2-й структ необх чтобы образов внутримол водор св давало бы больш выигрыш своб энергии, чем обр водор св с мол воды. АК остатки могут быть условно разделены на: неполяр (гидрофоб) и поляр (гидрофил). Неполярные углеводородные радикалы АК остатков взаимод в осн друг с другом, а поляр с водой. В результ гибкая макромол сворач в глобулу. Неполяр радикалы расп внутри глобулы, а поляр гидрофил- на её поверх, соприкасаются с водой. Это предполож высказал Бреслер и Томиун в 1944г, т.е. что определяющая роль в формир простр структуры глобулы принадл гидрофоб взаимод. Идея состояла в том, что макромол Б. сворач в глобулу потому что поляр радикалы стремятся к max контакту с водой, а неполяр к min. А min поверх при задан объёме – шар. Чтобы рассчит форму глобулы необх знать отношение полярных АК к неполяр. Предполож, что все АК имеют одинак объём. Найдём соотнош числа поляр остатков к неполяр для сферич глобулы радиусом r0. Отнош поляр ост к неполяр равно отнош V этой части. Тогда параметр: bs=Ve/Vi, где Ve – V поляр части глобулы. Vi – V неполяр части. Обозначим через S площадь поверх гидрофоб ядра (S=4pr2). Тогда: Vi= Sr/3 – объём гидрофоб ядра. Ve=S/d – объём гидрофил фазы. d- толщина мол слоя поляр остатков. Т. о. bs=Ve/Vi = 3Sd/Sr = 3d/r. b- поляр остатки, bs- неполяр. Из этого ур-я след, что чем меньше радиус глобулы, тем больше д. б. относительная гидрофильность Б. Глобула м.б. сферической только при усл., что b=bs. Если b>bs форма глобулы эллипсоидная. Если поляр остатков больше чем необх. чтобы покрыть гидрофоб ядро гидрофил слоем, то глобула вытяг в эллипс, кот имеет больш поверх чем сфера. Если b значительно меньше bs, то возм фибриллярная структ. Если b<bs, то возм надмолекуляр структ – гидрофил остатки неполностью закрыв гидрофоб, гидрофоб взаимод меж такими участками ведут к агрегации Б. и воз-ю надмолек стр-р. Формиров гидрофоб ядра имеет принципиал знач для функционир Б. Компактноупаков глобула нах. в устойчивой конформации (состоянии).
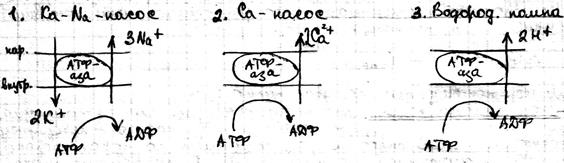
Активный транспорт Это перенос веществ из мест с меньшим значением электрохимического потенциала в места с большим его значением. Он сопровождается ростом энергии Гиббса и не может идти самостоятельно, а возможен только с процессом гидролиза АТФ. За счёт активного транспорта в организме создаются градиенты концентрации, электрический потенциал, давления, которое поддерживает все жизненные процессы. С точки зрения термодинамики организм поддерживается в неравновесном состоянии. Согласно современным представлениям в биологических мембранах существуют электрогенные ионные насосы. Они работают за счёт свободной энергии гидролиза АТФ. Известно три типа насосов:
Ка-Na – насос работает по следующим этапам: · Образование комплекса с ферментами на внутренней поверхности мембран · Связывание комплекса 3 по Na+ · фосфорилирование ферментов с образованием АДФ · переворот (флип-флоп) ферментов внутри мембран · реакция ионного обмена Na+ на K+ на внутренней поверхности мембран · обратный переворот ферментного комплекса с переносом K+ внутрь клетки · возвращение фермента в исходное состояние с освобождением ионов K+
Потенциал покоя в клетках Биоэлектрические явления. Важное свойство мембран – генерация и передача биопотенциалов. Это явление лежит в основе возбудимости клеток и регуляция внутриклеточочных потенциалов, определяет нервную работу и мышечные сокращения. В процессе жизнедеятельности молекул возникают различные электрические потенциалы: · Вследствие переноса электронов от одной молекулы к другой возникает ОВ потенциал · Вследствии возникновения градиента концентрации и переносом через мембрану ионов возникает мембранный потенциал, который является преобладающим в организме. Мембранный потенциал – это разность потенциалов между внутренней (ЦПМ) и наружной поверхностью мембраны.
Потенциал покоя. Это стационарная разность электрических потенциалов между внутренней и наружной поверхностью мембраны, находятся в невозбыждённом состоянии. Он определяется разницей концентраций ионов по разные стороны мембраны и диффузией ионов через мембрану:
Если мембранный потенциал обусловлен переносом K+ при том, что [K+]вн > [K+]нар и Z=+1, то
В случае переноса иона Na+ при условии, что [Na +]вн < [Na +]нар и Z=+1, то
Одновременная диффузия через мембрану ионов Na+, K+,Cl- описывается уравнением Гольдмана:
Где Р – проницаемость мембраны для конкретных ионов. В состоянии покоя проницаемость мембран для K+ больше, чем для Na+ и Cl- . И в этом случае из уравнения Гольдмана мы получаем уравнение Нернста для ионов K+
Потенциал действия Живой организм – это электрифицированная система. Без электричества нет жизни. С помощью электрических нервных импульсов передаётся возбуждение от рецепторов к нейронам мозга и от них к мышцам. Нервный электрический импульс открыл Гальвани. Доказательство того, что нервный импульс – это импульс электрического тока осуществил в 20в. Ходжкин и Хаксли. Потенциал действия – это электрический импульс, обусловленный изменением ионной проницаемости мембран и связан с распространением по нервам и мышцам волны возбуждения. Возбуждение мембраны описаны уравнением Ходжкина-Хаксли.
Где: Cм – ёмкость мембраны Ii – ионные токи через мембрану, сума которых складывается из токов K+ и Na+ и т.к. тока утечки.
Это уравнение может иметь вид: Каждый ионный ток определяется разностью мембранных потенциалов и выражается как:
Полное выражение для ионного тока через мембрану имеет вид:
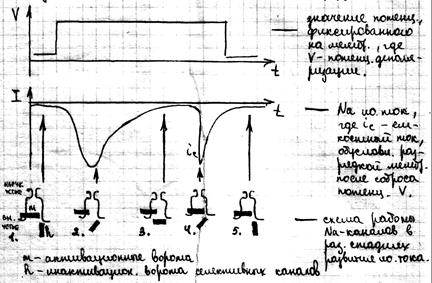
Ионные токи через мембрану. Механизмы генерации ПД. Опыты доказывающие увеличение проницаемости мембран для ионов Na+ и K+ при возникновении ПД проведены в 1951г. Льюисом и Кайпесом. Они исследовали проницаемость мембран аксона с использованием радиоактивных ионов Na+ и K+ . изменение проницаемости мембран для Na+ и K+ начались с того момента когда потенциал на мембране по абсолютной величине становится меньше потенциала покоя: |φм| < |φn| Т.е. считается что мембрана была деполяризована, потенциал деполяризации имеет вид: V= φм – φn Рассмотрим формирование ионного тока при деполяризации мембраны:
1– кривая прогнозирует собственные изменения тока через мембрану после того как потенциал на мембране был скачком изменён по отношению к потенциалу покоя. После такой деполяризации мембран ток идёт внутрь волокна (участок А), затем входящий ток сменяется выходящим и кривая идёт вверх. Ранний входящий ток обусловлен ионами Na+, а выходящий обусловлен выходом К+ из клетки. Кривая 2 показывает суммарный ток. Ходжкин и Хаксли представили формирование ионных токов схемой (схема работы Na – каналов возбудимой мембраны):
Стадии селективных каналов: 1,5 – исходное положение покоя 2 – активация 3 – инактивация 4 – рефрактерность (нечувствительность к новому раздражению) В покоящемся нервном волокне (ст.1) Na– каналы закрыты воротами (m). Поляризация мембраны ведёт к их открытию и усиливанию Na тока (2). Затем начинают закрываться ворота (h) (2,3). Ворота (m) открывается быстро до тех пор, пока ток не снизится и потенциал не упадёт. На 4 стадии ворота (m) возвращаются в исходное закрытое положение и мембрана остаётся невосприимчивой к следующей деполяризации некоторое время – рефрактерный период. Ворота (h) некоторое время остаются закрытыми, а затем открываются. В стадии 5 мембраны опять готова к новому возбуждению. На основании этих опытов было показано два положения: – образование потенциала действия связано с переносом ионов Na и K через мембрану – проводимость мембран для этих ионов изменяется в зависимости от величины мембранного потенциала и времени.
Модель Ходжкина-Хаксли Исходя из этого Ходжкин и Хаксли предложили математическую модель, которая описывает изменения проводимости токов, ионов Na и K через мембрану в процессе возбуждения. Постулаты модели: – в мембранах существуют отдельные каналы для переноса Na и K – во внутренней структуре мембраны существуют некоторые заряженные частицы, которые управляют проводимостью каналов. В зависимости от напряжённости электрического поля эти частицы могут передвигаться по мембране увеличивая или уменьшая токи ионов Na и K через мембрану. Ходжкин и Хаксли предположили, что ионы К могут проходить через канал если к его участку под действием электрического поля одновременно подойдут 4 однозарядных частицы. В таком случае проводимость К-го канала выражается формулой:
Предполагают, что Na канал открывается тогда, когда к нему попадают одновременно 3 активирующие частицы и удаляется 1 блокирующая. Проводимость Na канала описывается формулой:
Численное значение n,m,h имеют смысл вероятности нахождения соответствующей частицы на участке канала и изменяется от 0 (частицы нет) до 1 (частица находится в данном месте). Кинетика перераспределения частиц через мембрану описывается системой однотипных уравнений. Для К-канала она следующая:
Зависимость вероятностей нахождения активирующей и блокирующей частицы от мембранного потенциала: Ходжкин и Хаксли нашли форму ПД, который совпал с экспериментом с точностью 10%. Физическая интерпретация модели требовала наличия внутри мембраны заряженной частицы, которая должна была передвигаться под действием электрического поля. Для подтверждения второго постулата модели необходимо было зарегистрировать передвижение заряженной частицы внутри мембраны при изменении мембранного потенциала. Т.е. надо было обнаружить воротные токи. Но активирующие частиц внутри мембран мало – воротные токи слабы. Для их обнаружения используют блокаторы Na тока и в наружном растворе исключали ионы Na. Меняя напряжение мембранного потенциала было зарегистрировано наличие воротного тока. Изменение воротного тока при изменении потенциала связано с изменением тока Na. Т.о. модель Ходжкина и Хаксли описала возникновение и развитие во времени ионных токов через мембрану.
Радиочувствительность. Основополагающими понятиями являются радиочувствительности и радиоустойчивости (радиорезистентности). Понятие радиочувствительности определяет собой способность организма проявить наблюдаемую реакцию при малых дозах ионизирующей радиации. Ее мерой является полулетальная доза (ЛД50/30), при которой происходит гибель 50% особей в течение 30 суток. Для оценки применяются также летальные дозы ЛД100 и различные частично летальные дозы ЛД30, ЛД50, ЛД90. Вероятность развития острой лучевой болезни той или иной степени тяжести при данной дозе облучения определяется индивидуальной радиочувствительностью организма. При дозах 1-6Гр развивается ОЛБ по кроветворному синдрому. При дозах 6-10Гр развивается переходная форма болезни, протекающая как 3-я степень тяжести, но с поражением кишечника. При дозах 10-20 Гр возникает типичная форма ЖКТ, заканчивающаяся смертельным исходом через 8-16 сут. При дозах 20-80Гр развиваются токсемические поражения. Смерть наступает на 4-7 сутки при мозговой и менингитной симптоматике. Наконец, при дозах выше 80 Гр возникает церебральная форма поражения с коллапсом и судорогами, завершающаяся смертью на 1-3 сутки. Основные энергетические опроцессы в биосфере Согласно современным представлениям вселенная появилась в результате взрыва малого сгустка большой плотности. Примерно 10 в 10-й степени лет стал расширяться взрывным образом. Из фотонов и нейтрина возникали электроны и нуклоны (протон+нейтрон). По мере охлаждения Вселенной возникали тяжелые и легкие ядра. Сила всемирного тяготения (гравитация) определила возникновение галактик и звезд. При высоком гравитационном сжатии плазмы резко повышается температура и возникают термоядерные процессы – взрывы сверхновых звезд. Наша солнечная система возникла как вспышка сверхновой звезды 4,5 млрд. лет назад. А жизнь возникла 3,5 млрд. лет назад. Основа нашей жизни – космическое новообразование. Источник жизни является энергия солнечного излучения. Живой мир зависит от термоядерной реакции на Солнце (происходит непрерывное превращение водорода в гелий.
Где h – постоянная Планка, а v – частота испускаемого света. Преобразование одного атома гелия ведет к потере частиц, масса которых превращается в энергию. На 4 грамма гелия исчезает 0,029 грамм массы. Т.о. на солнце каждую минуту исчезает сотни млн тонн массы, которая превращается в энергию и излучается в космос. Излучение идет в виде света, рентгеновсого излучения, радиоволн, инфракрасного излучения. Большая часть Е поглощается атмосферой, в основном это УФ свет. Атмосферой поглощается 30% солнечной Е. Около 50% превращ в тепло и излучается с поверхности земли обратно в атмосферу в виде инфракрасного излучения. Часть излучения задерживается при этом (парниковый эффект) 20% Е расходуется на образование облаков. 0,02% поглощается растениями, которые используют солнечную энергию для образования молекул, богатых Е (сахара фотосинтеза). Вся жизнь биосферы зависит от поглощения Е. Высшие растения и животные используют запасенную Е для окисления пищи и выделения Е в виде тепла, которое запасается в виде Е для работы организма
Хим Е, запасающаяся в высокомолекулярных веществах, организмом превращается в механическую, электрическую и физ-хим Е рабочих процессов. При этих превращениях образуются вещества, которые не могут быть использованы и поэтому они выводятся в окружающую среду. Так совершается биологический цикл: поступление à превращение à выведение веществ и Е из организма в окружающую среду.
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 530; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.233.58 (0.147 с.) |


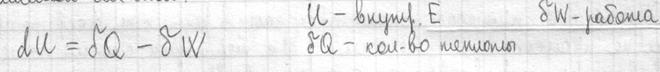
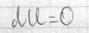
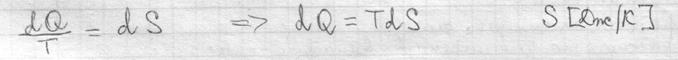

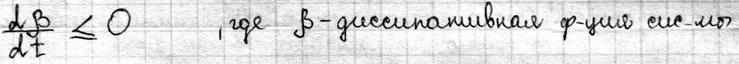

 Скорость р-ций подчиняется закону, согласно которому реакция идет быстрее, чем больше конц. в-в. Пусть мы имеем р-цию А+В С+D
Скорость р-ций подчиняется закону, согласно которому реакция идет быстрее, чем больше конц. в-в. Пусть мы имеем р-цию А+В С+D Эта кривая показывает, что зависимость вначале близка к линейной(при малых концентрациях субстрата), а затем достигает максимального значения. р-ции первого порядка при малых концентрациях субстрата переходят в р-ции нулевого порядка(т.е.при которых скорость р-ции не зависит от конц. Реагир-х в-в), скорость р-ции остается пропорциональной концентрации фермента.. Мат. модель F-ого катализа была разработана Михаэлесом и Ментеном в 1913г. они предложили двухстадийную последовательность процессов:
Эта кривая показывает, что зависимость вначале близка к линейной(при малых концентрациях субстрата), а затем достигает максимального значения. р-ции первого порядка при малых концентрациях субстрата переходят в р-ции нулевого порядка(т.е.при которых скорость р-ции не зависит от конц. Реагир-х в-в), скорость р-ции остается пропорциональной концентрации фермента.. Мат. модель F-ого катализа была разработана Михаэлесом и Ментеном в 1913г. они предложили двухстадийную последовательность процессов:

 E+S
E+S 
 ES E + P, где Р-продукт, S-субстрат, Е- фермент.
ES E + P, где Р-продукт, S-субстрат, Е- фермент.
 это означает, что кинетическая кривая компл.(es)будет содержать максимум. Производная в области макс. des\ dt=0 – условие стационарности процесса E +S Es E +P
это означает, что кинетическая кривая компл.(es)будет содержать максимум. Производная в области макс. des\ dt=0 – условие стационарности процесса E +S Es E +P решение уравнения при des\dt=0 дает нам:
решение уравнения при des\dt=0 дает нам: 23 уравнение Лайнувера-Берка
23 уравнение Лайнувера-Берка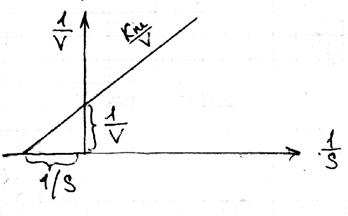

 Скорость р-ций подчиняется закону, согласно которому реакция идет быстрее, чем больше конц. в-в. Пусть мы имеем р-цию А+В С+D
Скорость р-ций подчиняется закону, согласно которому реакция идет быстрее, чем больше конц. в-в. Пусть мы имеем р-цию А+В С+D однолинейные цепи,
однолинейные цепи,


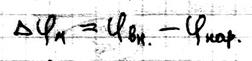 Мембранные потенциалы делят на два типа:
Мембранные потенциалы делят на два типа:

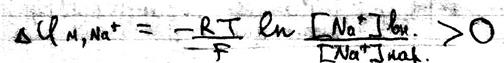
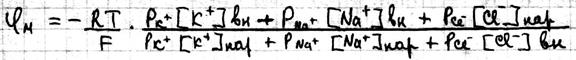
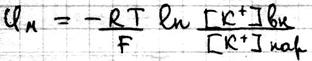 Таким образом формула Нерста является частным случаем уравнения Гольдмана. Но уравнение Гольдмана не учитывает наличие активного транспорта в мембранах. Повреждение мембраны приводит к повышению проницаемости мембран для всех ионов, вследствие чего уменьшается различия в проницаемости для ионов и снижается мембранный потенциал.
Таким образом формула Нерста является частным случаем уравнения Гольдмана. Но уравнение Гольдмана не учитывает наличие активного транспорта в мембранах. Повреждение мембраны приводит к повышению проницаемости мембран для всех ионов, вследствие чего уменьшается различия в проницаемости для ионов и снижается мембранный потенциал.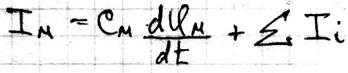
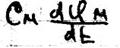 – ёмкостный ток, обусловленный перезарядкой мембраны.
– ёмкостный ток, обусловленный перезарядкой мембраны.