Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Из водных растворов на активированном угле ⇐ ПредыдущаяСтр 2 из 2
Цель работы: Формирование навыков экспериментального изучения явления адсорбции на границе раствор – твердое тело, получение изотермы адсорбции, расчет геометрических и термодинамических характеристик. Теоретическая часть Адсорбция представляет собой процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. Более плотная фаза (вещество, на поверхности которого происходит адсорбция) называется адсорбентом. Адсорбент может быть твердым и жидким. Вещество, которое перераспределяется и поэтому находится обычно в газообразной или жидкой фазе, называется адсорбатом. В зависимости от агрегатного состояния смежных фаз различают адсорбцию газов на твердых адсорбентах, адсорбцию растворенных веществ на границах твердое тело жидкость и жидкость – жидкость, а также адсорбцию на границе жидкий раствор – газ. Для количественного описания адсорбции применяют в основном две величины. Первая измеряется числом моль или граммов, приходящихся на единицу поверхности или на единицу массы адсорбента (для порошкообразного состояния); ее принято обозначать буквой А. Вторая характеристика величины адсорбции определяется избытком вещества в поверхностном слое по сравнению с его количеством в таком же объеме фазы, также отнесенным к единице площади поверхности или единице массы адсорбента. Эту величину называют гиббсовской адсорбцией и обозначают буквой Г. Величина адсорбции зависит от природы адсорбента и адсорбата, а также от концентрации (давления) адсорбата и температуры. Зависимость величины адсорбции от концентрации (или парциального давления) вещества при постоянной температуре называется изотермой: А = Зависимость величины адсорбции от температуры при постоянной концентрации (или парциальном давлении) вещества называется изопикной (изобарой): А = Зависимость концентрации (или парциального давления) вещества в объеме от температуры при постоянной величине адсорбции называется изостерой: С = Наиболее распространенной зависимостью, получаемой экспериментально, является изотерма. Другие две зависимости можно графически построить из серии изотерм, полученных при различных температурах. На рис. I показано, что точки пересечения изотерм прямой, параллельной оси ординат соответствуют изопикне, а при пересечении изотерм прямой, параллельной оси абсцисс, получаются точки изостеры. По полученным точкам строят зависимости величины адсорбции (изопикна) или концентрации (изостера) от температуры.
Рис. 1 Построение изостер С термодинамической точки зрения адсорбция является самопроизвольным процессом выравнивания химических потенциалов веществ в объеме системы и межфазном (поверхностном) слое. Этот процесс происходит вследствие стремления к минимуму поверхностной энергии или энергии Гиббса всей системы. Адсорбцию можно рассматривать как взаимодействие молекул адсорбата с активными центрами поверхности адсорбента. Такое рассмотрение удобно для адсорбции на твердых адсорбентах. Поверхность твердых тел как правило геометрически и химически неоднородна, и чтобы получить простейшие закономерности адсорбции, необходимо предположить, что поверхность адсорбента однородна и распределение адсорбата происходит в мономолекулярном слое. Тогда при малых концентрациях адсорбента изотерма адсорбции описывается законом Генри: А = КгС или А = КгР. При средних и больших концентрациях адсорбата возникают отклонения от закона Генри, связанные с ограниченностью адсорбционного объема или поверхности адсорбента, приводящей к адсорбционному насыщению поверхности адсорбента по мере увеличения концентрации адсорбата. Уравнение изотермы адсорбции, полученное Ленгмюром, описывает все области концентраций (парциальных давлений) адсорбата (рис.2): А = где Экспериментальные результаты по определению изотермы адсорбции обычно обрабатывают с помощью уравнения Ленгмюра, записанного в линейной форме:
Такая линейная зависимость позволяет графически определить оба постоянных параметра адсорбционной изотермы (рис.3).
Рис.2 Изотерма адсорбции Ленгмюра
Рис.3 Изотерма адсорбции в координатах линейной формы уравнения Ленгмюра.
В области средних концентраций (парциальных давлений) изотерма адсорбции Ленгмюра подчиняется закономерности, найденной эмпирически Фрейндлихом: А = КР1/n и A = KC1/n. где К и 1/n – постоянные. Уравнение Фрейндлиха широко используется при обработке экспериментальных адсорбционных данных и инженерных расчетах. Чаще всего оно применяется в логарифмической форме, позволяющий построить линейную зависимость lnA = f (ln C) и графически определить оба постоянных параметра К и n (рис.4): lnA = ln K +
Рис. 4. Изотерма адсорбции в координатах линейной формы уравнения Фрейндлиха.
Уравнение Ленгмюра используется для определения удельной поверхности адсорбентов, катализаторов и других дисперсных систем. Удельная поверхность Sуд. связана с емкостью монослоя Sуд. = где NA – число Авогадро; S0 –площадь, занимаемая одной молекулой адсорбанта в насыщенном адсорбционном слое. Стандартная энергия Гиббса адсорбции связана с константой равновесия адсорбции из уравнения Ленгмюра соотношением: ΔG0 = - RTlnK. Экспериментальная часть Приборы и реактивы: Весы технические; колбы конические, емкостью 100 мл; пипетки Мора, емкостью 10, 20, 50 мл; уголь активированный; воронки и фильтры; бюретка, емкостью 25 мл; раствор уксусной кислоты 0,1 н; стандартный раствор едкого натрия 0,1 н; раствор фенолфталеина. Порядок выполнения работы Определяют концентрацию исходного раствора уксусной кислоты посредством титрования стандартным раствором едкого натрия в присутствии фенолфталеина. Результаты титрования записывают в таблицу 1. Таблица 1.
Из исходного раствора кислоты готовят 5 водных растворов в соответствии с данными таблицы 2: Таблица 2
Кислоту и воду необходимо отбирать пипетками. Берут 5 навесок предварительно измельченного активированного угля по 1 г. В растворы кислоты вносят навески адсорбента и встряхивают в течении 10 минут. Затем растворы отфильтровывают, отбирают аликвоты по 10 мл и титруют стандартным раствором щелочи. Данные заносят в таблицу 3. Таблица 3
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 595; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.112.155 (0.012 с.) |
 .
. .
. или Р =
или Р =  .
.
 по изотермам.
по изотермам. или А =
или А =  .
.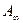 - емкость адсорбционного монослоя или число адсорбционных центров, приходящихся на единицу поверхности или на единицу массы адсорбента; К – константа адсорбционного равновесия, характеризует энергию взаимодействия адсорбата с адсорбентом.
- емкость адсорбционного монослоя или число адсорбционных центров, приходящихся на единицу поверхности или на единицу массы адсорбента; К – константа адсорбционного равновесия, характеризует энергию взаимодействия адсорбата с адсорбентом. .
.

 ln C.
ln C.