Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Законы электролиза (М. Фарадей)
1. Весовое количество выделяемого при электролизе вещества пропорционально количеству протекшего через раствор электричества и практически не зависит от других факторов. 2. Равные количества электричества выделяют при электролизе из различных химических соединений эквивалентные количества веществ. 3. Для выделения из раствора электролита одного грамм-эквивалента любого вещества нужно пропустить через раствор 96500 кулонов электричества.
m(x) = ((I • t) / F) • (M(x) / n), (1.10)
где m(x) - количество восстановленного или окисленного вещества, г; I - сила пропускаемого тока, а; t - время электролиза, с; M(x) - молярная масса, г/моль; n - число приобретенных или отданных в окислительно-восстановительных реакциях электронов; F = 96500 кул/моль - постоянная Фарадея.
Исходя из этой формулы, можно производить ряд расчетов, связанных с процессом электролиза, например: 1) вычислять количества веществ, выделяемых или разлагаемых определенным количеством электричества; 2) находить силу тока по количеству выделившегося вещества и времени, затраченному на его выделение; 3) устанавливать, сколько времени потребуется для выделения определенного количества вещества при заданной силе тока. Коррозия металлов Коррозия металлов - это разрушение их в результате химического, физико-химического и механического взаимодействия с внешней средой. Металл при этом переходит в окисленное состояние и теряет свою прочность и другие качества. Примерно около 15 % ежегодной добычи металла расходуется на возмещение потерь из-за коррозии металлических деталей и конструкций. Вред, приносимый коррозией, обусловлен не только потерей большого количества металла, но и порчей и выходом из строя самих металлических изделий, т.к. вследствие коррозии они теряют прочность, герметичность, пластичность, электро- и теплопроводимость и другие требуемые качества, причем коррозионная стойкость различных металлов неодинакова. Ущерб, причиняемый коррозией, определяется также громадными затратами на всевозможные защитные мероприятия, ухудшением состояния оборудования и качества продукции, возрастанием возможностей аварий и т.д. Все вышеуказанное объясняет необходимость детального и глубокого изучения коррозионных процессов и актуальность работ, связанных с повышением коррозионной стойкости металлов.
Коррозия является окислительно-восстановительным процессом. При этом происходит переход катионов металла в окружающую среду: M – ne = M n+ и связывание освобождающихся электронов частицами окислителя, которые имеются в окружающей среде. Если процессы окисления металла и восстановления окислителя происходят одновременно и не разделены в пространстве, то говорят о химической коррозии металла. Такая коррозия происходит чаще всего в сухих газах, например, при разрушении стальных труб при производстве хлора: 2Fe + 3Cl = 2FeCl. Если процессы окисления металла и восстановления окислителя происходят не одновременно и разделены в пространстве цепью переноса освободившихся электронов, то говорят об электрохимической коррозии. Такая коррозия имеет место в растворах электролитов и влажном воздухе. Чаще всего в этих случаях окислителем являются катионы водорода Н+, всегда присутствующие в водном растворе 2Н+ + 2е = Н2, или молекулы кислорода в присутствии молекул воды по уравнению: О2 + 2Н2О + 4е = 4ОН-. Говорят, что в первом случае происходит коррозия с водородной деполяризацией, во втором – с кислородной деполяризацией. Слово «деполяризация» следует понимать так: окислитель, который отводит электроны от разрушающегося металла и снимает появившуюся поляризацию (избыточные заряды) с этого металла. Фактором, который изменяет, иногда катастрофически, скорость электрохимической коррозии, является контакт двух металлов различной активности. В этом случае более активный металл начинает разрушаться быстрее, а менее активный металл оказывается защищённым от коррозии (на нем происходит восстановление частиц окислителя-деполяризатора). В качестве мер защиты от коррозии или снижения её скорости применяют следующие: 1) изолирующие (защитные) покрытия: лаки, краски, плёнки, смазки и т.п. - эти покрытия уменьшают скорость коррозии как в результате затруднения выхода металла в окружающую среду, так и в результате затруднения доступа окислителя к поверхности металла;
2) создание препятствий выходу катионов металла (электрохимическая защита) - это достигают либо подключением защищаемого металла к отрицательному полюсу источника тока (катод, катодная защита), либо соединяя защищаемое металлическое изделие с более активным металлом («жертвенный анод»)*; 3) использование специальных (легированных) сплавов, состав которых подбирают таким образом, чтобы скорость коррозии в данной коррозионно-активной среде была наименьшей; 4) использование ингибиторов коррозии, которые уменьшают скорость разрушения металла; ингибиторы коррозии могут как добавлять в агрессивную среду, например, при перевозке кислот по железной дороге или транспортировке газа по газопроводам, так и вводить в состав защитного покрытия (ингибированные смазки и др.); 5) снижение агрессивности среды путем ее обработки; например, использование деаэрации воды (удаление растворенного в воде кислорода) является обязательным приемом снижения коррозионных потерь на всех промышленных предприятиях. 6) рациональное конструирование и эксплуатацию металлических сооружений и деталей, которые предполагают исключение неблагоприятных металлических контактов или применение изоляции, устранение щелей и зазоров в конструкции, устранение зон застоя влаги, ударного действия струй, резких изменений скоростей потоков в конструкциях и т.д. Наибольший эффект в борьбе с коррозией достигается при использовании наиболее действенных или нескольких методов защиты.
Электрохимическая коррозия
Рассмотрим коррозию железа как электрохимический процесс. Ржавление железа есть не что иное, как анодная реакция
* Часто применяют так называемую анодную защиту, при этом потенциал корродирующего металла специальными способами сдвигают в область пассивации.
Катодная реакция – восстановление атмосферного кислорода:
Водородные ионы поставляет вода. Если бы в воде не было растворенного кислорода, то коррозия была бы невозможна. Следовательно, железо корродирует в слое воды, насыщенном кислородом. Таким образом, начальную стадию коррозии железа можно передать реакцией
На скорость коррозии существенное влияние оказывает концентрация ионов H+. Повышение концентрации ионов водорода pH приводит к замедлению коррозии, поскольку восстановление O2 из H2O замедляется. При pH = 9…10 коррозия железа практически прекращается. Известно, что в водной среде ионы Fe2+ в присутствии кислорода окисляются до Fe3+. Вторая стадия коррозии соответствует реакции образования гидратированного оксида железа (ржавчины) Fe2O3∙nH2O:
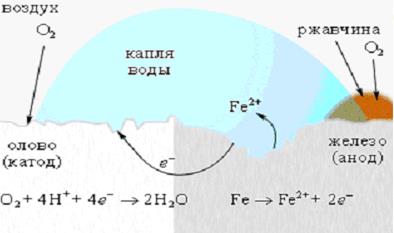
Для защиты железа от коррозии используются всевозможные покрытия: краска, слой металла (олова, цинка). При этом краска и олово предохраняют от коррозии до тех пор, пока защитный слой цел. Появление в нем трещин и царапин способствует проникновению влаги и воздуха к поверхности железа, и процесс коррозии возобновляется, причем в случае оловянного покрытия он даже ускоряется, поскольку олово служит катодом в электрохимическом процессе (рисунок 4).
Оцинкованное железо ведет себя иначе. Поскольку цинк выполняет роль анода, то его защитная функция сохраняется и при нарушении цинкового покрытия (рисунок 6).
Катодная защита широко используется для уменьшения коррозии подземных и подводных трубопроводов и стальных опор высоковольтных передач, нефтяных платформ и причалов.
Экспериментальная часть Цель работы 1) исследовать окислительные свойства соединений в высших, низших и промежуточных степенях окисления; 2) изучить влияние величины рН на состав продуктов окислительно-восстановительной реакции.
Опыт 1. Вытеснение металлов из солей другими металлами Железную проволоку или железный гвоздь опустить в пробирку с раствором сульфата меди на 1…2 минуты. Вынуть. Сполоснуть водой. Обратить внимание на происходящее явление и написать уравнение реакции. Внимание: после опыта слейте растворы в емкость «для слива»! Вопросы и задания: 1) опишите наблюдаемое явление. 2) напишите уравнения химических реакции и расставьте коэффициенты методом электронного баланса; 3) рассчитайте стандартные значения DЕ0э, DG, Кр реакции; 4) сделайте выводы.
Опыт 2. Окисление азотной кислотой В пробирку положить несколько кусочков медной стружки и прилить разбавленную азотную кислоту. Вопросы и задания: 1) опишите наблюдаемое явление; 2) напишите уравнения химических реакций и расставьте коэффициенты методом электронного баланса; 3) рассчитайте стандартные значения DЕ0э, DG0 и Кр; 4) сделайте выводы. Опыт3. Окислительные свойства MnO4- в различных средах а). Проведите реакцию между сульфатом железа (соль Мора), перманганатом калия в кислой среде – добавьте серной кислоты. Что наблюдаете?
FeSO4 + KMnO4 +H2S O4 ® K2S O4 + Fe2(S O4)3 + MnSO4 +H2O
б). проведите реакцию между сульфатом железа, перманганатом калия в щелочной среде. В чем разница между этими реакциями? В какой среде Mn7+ проявляет большие окислительные свойства?
FeSO4 + KMnO4 +KOH ® K2SO4 + Fe(OH)3 + К2MnO4 Вопросы и задания: 1) опишите наблюдаемое явление; 2) напишите уравнение химической реакции и расставьте коэффициенты методом электронного баланса; 3) как влияет среда на состав продуктов реакции? 4) рассчитайте стандартные значения DЕ0э, DG0 и Кр.
Опыт 4. Окислительно-восстановительные свойства хрома в высших и низших степенях окисления а). Восстановление Cr6+ ® Cr3+ К раствору KIприлейте разбавленную серную кислоту и раствор бихромата калия.
KJ + H2SO4 + K2Cr2O7 ® Cr2 (SO4)3 + K2SO4 + J2 + H2O
б). Окисление Cr3+ ® Cr6+ К раствору сульфата хрома прилейте раствор щёлочи KOH до растворения осадка, затем добавьте раствор перманганата калия. Нагрейте.
Cr2 (SO4)3 +KOH + KMO4 ® K2SO4+K2CrO4+ MnO2+ H2O Вопросы и задания: 1) опишите наблюдаемое явление; 2) напишите уравнение химических реакций и расставьте коэффициенты методом электронного баланса; 3) приведите три примера веществ, проявляющих как свойства окислителя, так и восстановителя; 4) рассчитайте стандартные значения DЕ0э, DG0 и Кр. 5) сделайте выводы.
Техника безопасности При работе в лаборатории студент должен иметь халат. Рабочее место не должно быть захламлено ненужной посудой и приборами. Перед началом работы необходимо проверить наличие реактивов, тщательно ознакомиться со свойствами веществ, используемых в работе, чтобы принять все меры предосторожности в случае их вредного действия или огнеопасности. При ожоге кислотой или щёлочью промывают ожог большим количеством воды (не менее пяти минут под краном), затем двухпроцентным раствором питьевой соды (при ожоге кислотой) или трехпроцентным раствором уксусной кислоты (при ожоге щелочью). Если щёлочь попала в глаза, необходимо обильно промыть глаз струёй воды, затем одно или двухроцентным раствором борной кислоты. При ранении очищают раны от осколков стекла стерильной марлей, смазывают окружность раны (но не саму рану) настойкой иода и забинтовывают рану. При ранениях с одновременным поражением кислотой или щёлочью очищают рану от осколков стекла и промывают ее трехпроцентным раствором питьевой соды или одно либо двухпроцентным раствором уксусной кислоты, затем смазывают иодом края раны и забинтовывают.
4 Контрольные вопросы для допуска к лабораторной работе 1. Какие реакции называются окислительно-восстановительными? Приведите примеры. 2. Какой процесс называют окислением? Какое вещество называют восстановителем? 3. Какой процесс называют восстановлением? Какое вещество называют окислителем? 4. Классификация химических реакций. 5. Что понимают под степенью окисления? 6. Какие виды окислительно-восстановительных реакций существуют? 7. Методика проведения работы 8. Техника безопасности при проведении лабораторной работы.
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 80; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.254.28 (0.058 с.) |
 -
-