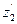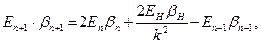Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Новая теория строения атомов.
Г.И. Сухоруков, Э.Г. Сухоруков, Р. Г. Сухоруков Братск, Россия.
Бор и Зоммерфельд строго обосновали резерфордовскую планетарную модель атома [1,2]. Однако вследствие трудностей, возникших при объяснении тонкой структуры спектра атома водорода и строения сложных атомов, их теория была отвергнута. В настоящее время строение атомов описывается сложным трехмерным дифференциальным уравнением Шредингера [3-5]. Даже для атома водорода решение этого уравнения не удается выразить через элементарные функции [6]. Для атомов, имеющих два и более электронов, уравнение Шредингера не может быть решено даже численным образом [7]. Чтобы рассчитать спектральные термы одного сложного атома, требуется работа электронно-вычислительных машин в течении сотен часов [8] или нескольких лет [9]. Наша теория является логическим продолжением теории Бора-Зоммерфельда. При ее создании использовался обширный экспериментальный материал, связанный с определением значений ионизационных потенциалов и энергий термов оптических и рентгеновских лучей. В справочной литературе значения ионизационных потенциалов и энергий термов приводятся с очень высокой точностью, достигающей восьми - десяти значащих цифр. Эти данные надежны, так как получены в результате обобщения экспериментального материала, которым располагает все человечество. Результаты теоретических исследований, выполненных с использованием методик, разработанных на основе нашей теории, хорошо согласуются с вышеназванными экспериментальными данными. Скорость распространения взаимодействия равна скорости света. Конечность этой скорости обусловлена наличием мировой среды (эфира). Законы Ньютона и Кулона точно выполняются только для тел, неподвижных относительно этой среды. Для движущихся тел эффективность взаимодействия зависит от скорости их движения относительно мировой среды. Формулы эффекта движения аналогичны формулам эффекта Доплера в оптике и акустике. Для случая, когда оба взаимодействующих тела движутся, формула имеет вид [10, 11]
где X – величина, зависящая от скорости движения, С – скорость света, V и U – скорости движения взаимодействующих тел, a1 и b1 - углы между направлениями движений источника и приемника волн и линией соединяющей точку, в которой волна излучилась, с точкой, в которой она встретилась с приемником. Буквами со штрихами и без штрихов обозначены величины, полученные соответственно с учетом и без учета эффекта движения. В атоме движением ядра можно пренебречь и тогда для величин, характеризующих движение электрода по круговой орбите можно записать
где a и b – величины, значения которых соответственно увеличиваются или уменьшаются вследствие эффекта движения. Интеграл энергии системы электрон – ядро имеет вид [12]
где m – масса электрона, V’ – скорость электрона, b = 1+ m/М, М – масса ядра, r’ – радиус- вектор, m’ = (z’e2c210-7)/m, z’ – зарядовое число, e – элементарный заряд, l – длина большой оси орбиты. Определив с помощью интеграла энергии орбитальную скорость и ее радиальную и тангенсальную составляющие, можно вывести уравнение, описывающее движение электрона по финитной незамкнутой кривой [12]:
где j’ – угол поворота радиуса-вектора r; n – число характеризующее степень вытянутости орбиты; k – номер стационарного состояния; Va, Vn – скорости электрона в апоцентре и перицентре; ra, rn – апоцентральный и перицентральный радиусы. Результаты расчетов по формулам авторов с высокой точностью совпадают с экспериментальными данными. В таблице 1 приведены значения фундаментальных физических констант, полученных экспериментально и вычисленных по нижеприведенным формулам:
Физические константы Таблица 1
В качестве исходных данных взяты значения четырех констант [13]: скорость света с = 2,99792458×108 м/с; элементарный заряд e’ = 1,60217733×10-19 Кл; Масса электрона m = 9,10938968×10-31 кг; боровский радиус r’н = 5,29177249 10-11 м. Для атома водорода bн = 1,000544617. Параметры орбит сложных атомов можно выразить через параметры боровской орбиты [12]. Если электрон движется по круговой орбите, то:
а если по эллиптической, то:
где z’ – эффективное зарядовое число, Полная энергия системы электрон-атом:
Период обращения электрона и ядра вокруг центра масс:
С помощью формул (1) и (2) определены rн = 0,529191323×10-10 м; Vн = 2,186442460×106 м/с; Ен= 21,78571660×10-19 Дж; e = 1,602156024×10-19 Кл; Тн = 1,520657574×10-16 с. Таким образом, зная эффективное зарядовое число, можно вычислить все величины, характеризующие движение электрона по орбите в атоме. Атомы имеют планетарное строение. При переходе электрона из одного стационарного состояния в другое происходит поглощение или излучение волн. При этом в многоэлектронных атомах изменяется полная энергия не только у того электрона, который совершил переход с одной орбиты на другую, но и у всех остальных электронов. Длины оптических и рентгеновских волн, излучаемых сложными атомами, можно вычислить по формуле [12]
где
Энергии спектральных термов атома водорода Таблица 2
В таблице 2 приведены значения термов атома водорода, взятые из справочника [14] и вычисленные по формуле (6). Расхождения между расчетными и справочными данными наблюдаются после пятой или шестой значащей цифры. Это объясняется тем, что последние цифры значений термов получены не экспериментально, а расчетом по ныне принятой методике. Разности же термов, характеризующих тонкую структуру спектров согласно существующей и новой теории совпадают точно. Параметры орбит многоэлектронных атомов можно рассчитать, используя значения ионизационных потенциалов. Расчет ведется в такой последовательности. Вначале по значениям ионизационных потенциалов [15] находятся приблизительные значения эффективных зарядовых чисел. Затем определяются кратности периодов обращения электронов по формулам:
Выразив с помощью этих формул зарядовые числа всех электронов через зарядовое число наружного электрона и подставив новые выражения для зарядовых чисел в формулу (6), получим уравнение с одним неизвестным
Теперь можно определить точные значения В невозбужденном атоме гелия оба электрона находятся в первом стационарном состоянии и движутся по круговым орбитам. Период обращения наружного электрона в два раза больше периода обращения внутреннего электрона. Чтобы удалить электрон из невозбужденного атома гелия, нужно затратить энергию Е=198310,76 Сн-1 = 39,3933902×10-19 Дж [14]. Для этого случая уравнение (7) примет вид:
Вычислив с помощью этого уравнения значения
Орбиты электронов в атоме гелия Таблица 3
В таблице 3 приведены вычисленные аналогичным образом зарядовые числа электронов в атоме гелия для случаев, когда наружный электрон находится в одном из трех стационарных состояний. Как видно из таблицы 3, наружный электрон атома гелия в первом стационарном состоянии может иметь только одну круговую орбиту, во втором – 4 круговых и одну эллиптическую, а в третьем – 5 круговых и две эллиптические. Первая орбита электрона во втором стационарном состоянии очень устойчива. Переход электрона с этой орбиты на орбиту в первом стационарном состоянии возможен только при соударении атомов [16]. Гелий обычно состоит из двух типов атомов. В одних атомах наружный электрон движется по орбите первого стационарного состояния, а в других по первой орбите второго стационарного состояния. Первые атомы являются атомами парагелия, а вторые атомами ортогелия.
Для ионов с одинаковым числом электронов, но разными зарядами ядер выполняется равенство:
где Ен- ионизационный потенциал атома водорода, Еn+1, Еn и Еn-1 - ионизационные потенциалы ионов трех рядом расположенных элементов, n – порядковый номер элемента, k – номер стационарного состояния наружных элементов в ионах. По этой формуле вычислены ионизационные потенциалы и значения k у 24 элементов [12]. Никаких принципиальных трудностей нет для вычисления ионизационных потенциалов и параметров орбит электронов у всех элементов периодической системы.
Потенциалы ионизации атомов Таблица 4
В таблице 4 приведены расчетные и справочные значения ионизационных потенциалов у атомов фтора, неона и натрия. Как видим, расчетные значения ионизационных потенциалов хорошо согласуются со справочными. Химические и ряд физических свойств элементов обусловлены энергией связи наружных электронов с атомами. Энергия связи, а следовательно, и свойства имеют периодическую зависимость от порядкового номера элемента в таблице Менделеева. Если сравнить первые потенциалы ионизации у всех атомов [15], то можно четко выделить семь периодов, что и отражено в таблице Менделеева. Если же сравнить потенциалы ионизации у всех ионов с разными зарядами ядер, но с одинаковым количеством электронов, то также четко можно различить у известных нам элементов 12 периодов, которые приведены в таблице 5. В таблице приведен также 13-ый период для элементов, которые возможно существуют во Вселенной в условиях, отличных от условий Солнечной системы.
Периодический закон. Таблица 5
В таблице 6 показано, как идет заполнение электронных слоев в атомах элементов 13-го периода, но по нему можно представить, как происходит заполнение электронных слоев в атомах всех остальных элементов. Число слоев в атоме соответствует номеру периода, в котором он находится. Максимально возможное число электронов в слое равно числу элементов в периоде, в котором заполняется этот слой. В первом слое оба электрона находятся в первом стационарном состоянии. Восемь электронов второго слоя находятся во втором, электроны третьего и четвертого слоя – в третьем, а электроны всех остальных слоев – в четвертом стационарном состоянии.
Распределение электронов в атомах 13 периода. Таблица 6
В уточненной периодической таблице элементов один период содержит два элемента, шесть периодов содержат по 8 элементов, четыре по 10 элементов, и два по 14 элементов. В некоторых периодах наблюдается одинаковая закономерность изменения свойств элементов по мере увеличения числа электронов во внешнем слое атома. Такие периоды будем называть подобными. Так подобными являются второй и третий периоды, начинающиеся с щелочных элементов; пятый, седьмой, десятый и тринадцатый, начинающиеся с элементов группы меди; четвертый, шестой, девятый и двенадцатый, содержащие по 10 элементов; восьмой и одиннадцатый, содержащие по 14 элементов.
ЛИТЕРАТУРА
1. Шпольский Э.В. Атомная физика. т.I – М.: Физмат, 1963. 2. Зоммерфельд А. Строение атомов и спектры. т. I – М.: Гостехиздат, 1956. 3. Вихман Э. Квантовая физика. т.4 – М.: Наука, 1986. 4. Борн М. Атомная физика. – М.: Мир, 1967. 5. Шпольский Э.В. Атомная физика т.2 – М.: Наука, 1984. 6. Спролул Р. Современная физика. – М.: Фмзматгиз, 1961. 7. Ландау Л.Д., Лифшиц Е.М. Квантовая механика. – М.: Физматгиз, 1961. 8. Кравцов В.А. Массы атомов и энергии связи ядер. – М.: Атомиздат, 1974. 9. Намбу Е. Кварки. – М.: Мир, 1984. 10. Сухоруков В.И., Сухоруков Г.И. Эффект Доплера при движении источника и приемника волн в произвольном направлении // Акустический журнал. – 1986, т.32, №1. – с. 134-136. 11. Сухоруков Г.И. Теоретические модели физического эксперимента. Диссертация на соискание ученой степени доктора физико-математических наук – Братск: 1998. 12. Сухоруков Г.И., Сухоруков В.И., Сухоруков Р.Г. Реальный физический мир без парадоксов. – Иркутск: Изд-во иркут. ун-та, 1993. 13. Власов А.Д., Мурин Б.П. Единицы физических величин в науке и технике: Справочние. – М.: Энергоатомиздат, 1990. 14. Радциг А.А., Смирнов В.М. Справочник по атомной и молекулярной физике. – М.: Атомиздат, 1980. 15. Таблицы физических величин. Справочник. Под ред. И.К. Кикоина. – М.: Атомиздат, 1976. 16. Гольдин Л.П., Новиков Г.И. Введение в атомную физику. – М.: Наука, 1969.
БУДУЩЕЕ ЗА ФИЗИКОЙ БЕЗ ПАРАДОКСАЛЬНЫХ ТЕОРИЙ!
Сухоруков Г.И., Сухоруков Э.Г., Сухоруков Р.Г.
Братский Государственный технический университет 40, Макаренко, г. Братск 665709, Россия. E-mail:nil_mu@brstu.ru
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 53; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.211.23 (0.076 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
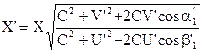 ,
,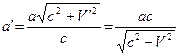 , (1)
, (1) , (2)
, (2)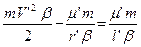 ,
,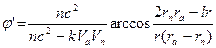 ,
,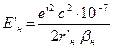 ;
;  :
: 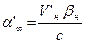 :
: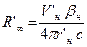 ;
; 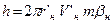 :
: 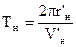 .
. , (3)
, (3) ;
; ,
,
 - энсцентриситет.
- энсцентриситет.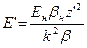 . (4)
. (4)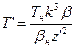 . (5)
. (5) , (6)
, (6)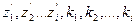 - зарядовые числа и стационарные состояния электронов у невозбужденного атома;
- зарядовые числа и стационарные состояния электронов у невозбужденного атома;  - соответствующие величины у возбужденного атома. Нумерация электронов идет в направлении от ядра к периферии атома. Постоянная Ридберга R¥= 1,097314784×107 м-1 имеет одну и ту же величину у всех атомов.
- соответствующие величины у возбужденного атома. Нумерация электронов идет в направлении от ядра к периферии атома. Постоянная Ридберга R¥= 1,097314784×107 м-1 имеет одну и ту же величину у всех атомов.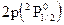

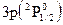
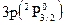

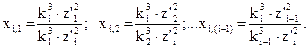
 . (7)
. (7) решая последовательно задачи для ионов данного атома, имеющих соответственно 2, 3, …, i электронов. Как показано выше, зная значение z’ для электрона, можно определить все параметры его орбиты. В опубликованных работах приведены расчетные значения параметров орбит электронов у всех возможных ионов первых двенадцати элементов таблицы Менделеева. В данной статье приведен пример расчета атома гелия.
решая последовательно задачи для ионов данного атома, имеющих соответственно 2, 3, …, i электронов. Как показано выше, зная значение z’ для электрона, можно определить все параметры его орбиты. В опубликованных работах приведены расчетные значения параметров орбит электронов у всех возможных ионов первых двенадцати элементов таблицы Менделеева. В данной статье приведен пример расчета атома гелия.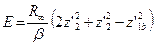 .
.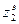 =1,3914422, из соотношения
=1,3914422, из соотношения 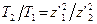 = 2 найдем
= 2 найдем  =1.9677965. Теперь по формулам (3), (4) и (5) можно вычислить параметры орбит обоих электронов, находящихся в первом стационарном состоянии.
=1.9677965. Теперь по формулам (3), (4) и (5) можно вычислить параметры орбит обоих электронов, находящихся в первом стационарном состоянии.