
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
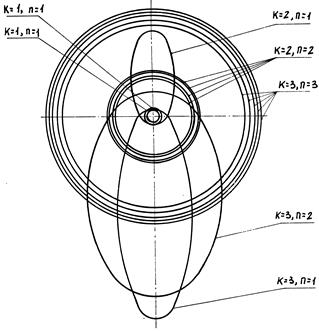
Параметры орбит электронов в атоме гелия
Рис. 8. Орбиты электронов в атоме гелия
Расчет параметров орбит многоэлектронных атомов можно производить, используя значения ионизационных потенциалов и спектры оптических и рентгеновских лучей.При излучении волн многоэлектронными атомами изменяется полная энергия не только у того электрона, который совершил переход с одной орбиты на другую, но и у всех остальных электронов. Для таких атомов формула Бора имеет вид
где z/1, z/2, …, z/i, k1, k2, ….., ki – зарядовые числа и стационарные состояния электронов у невозбужденного атома; z/1B, z/2B, …, z/iB, k1в, k2в, …, kiв- соответствующие величины у возбужденного атома. Формула (23) используется для определения длин волн, излучаемых возбужденными атомами. После некоторых преобразований её можно применять для расчета параметров орбит электронов сложных атомов. Расчет ведется в такой последовательности. Вначале по значениям ионизационных потенциалов, выраженных в волновых числах, находятся приблизительные значения эффективных зарядовых чисел
Затем определяются кратности периодов обращения электронов по формулам
Выразив с помощью этих формул зарядовые числа всех электронов через зарядовое число наружного электрона и подставив новые выражения для зарядов в формулу (23), получим уравнение с одним неизвестным
Теперь можно определить точные значения z/2, z/3, …, z/i, решая последовательно задачи для атомов, имеющих соответственно 2, 3, …..., i электронов. Как показано выше, зная значение z/ для электрона, можно определить все параметры его орбиты. Параметры орбит в невозбужденных атомах первых двенадцати элементов таблицы Менделеева приведены в работе [5].
Для ионов с одинаковым числом электронов, но разными зарядами ядер выполняется равенство:
где ЕН – ионизационный потенциал атома водорода, Еn+1, Еn и Еn-1 – ионизационные потенциалы ионов трех рядом расположенных элементов, n – порядковый номер элемента, k – номер стационарного состояния наружных электронов в ионах. Данная формула не учитывает эффект движения. Ею можно пользоваться только в случаях, когда электроны в атомах движутся с малыми скоростями. Чтобы производить точные расчеты, с учетом эффекта движения, нужно знать скорости движения электронов в атомах. Скорость электрона без учета эффекта движения можно вычислить по формуле [6]
Ионизационный потенциал с учетом эффекта движения будет равен
Последняя формула получена с помощью интеграла энергии системы двух взаимодействующих тел (11), но ее можно вывести другим способом. Масса электрона является постоянной величиной, а его скорость зависит от эффекта движения
С учетом этого сила, действующая на электрон в атоме равна
Энергия электрона равна работе совершенной над ним электрическим полем ядра.
Подставив вместо F и V' их значения согласно (27) и (26), находим
Полная энергия системы “электрон-атом” будет равна
что совпадает с полученной ранее формулой (25) В работе [6] приведены значения ионизационных потенциалов для 36 элементов, вычисленных по формулам (24), (25). Результаты расчетов хорошо согласуются с экспериментальными данными. По методике, изложенной выше, можно рассчитать параметры орбит для всех 36 элементов. Никаких принципиальных трудностей нет для вычисления ионизационных потенциалов и параметров орбит электронов у всех элементов периодической таблицы. Химические и ряд физических свойств элементов обусловлены энергией связи наружных электронов с атомами. Энергия связи, а следовательно, и свойства имеют периодическую зависимость от порядкового номера элемента в таблице Менделеева. Если сравнить первые потенциалы ионизации у всех атомов [7], то можно четко выделить семь периодов, что и отражено в таблице Менделеева. Если же сравнить потенциалы ионизации у всех ионов с разными зарядами ядер, но с одинаковым количеством электронов, то так же четко можно различить у известных нам элементов 12 периодов, которые приведены в таблице 3. В таблице приведен также 13-й период для элементов, которые, возможно, существуют во Вселенной в условиях, отличных от условий Солнечной системы.
Таблица 3. Периодический закон
В таблице 4 показано, как идет заполнение электронных слоев в атомах элементов 13-го периода, но по нему можно представить, как происходит заполнение электронных слоев в атомах всех остальных элементов. Число слоев в атоме соответствует номеру периода, в котором он находится. Максимально возможное число электронов в слое равно числу элементов в периоде, в котором заполняется этот слой. В первом слое оба электрона находятся в первом стационарном состоянии. Восемь электронов второго слоя находятся во втором, электроны третьего и четвертого слоя - в третьем, а электроны всех остальных слоев – в четвертом стационарном состоянии.
Таблица 4
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 48; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.87.196 (0.014 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
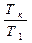
 , (23)
, (23)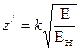 .
.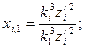

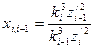 .
.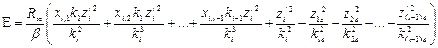 .
.
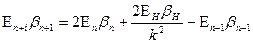
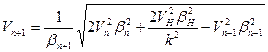 . (24)
. (24)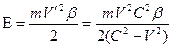 . (25)
. (25)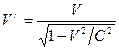 . (26)
. (26)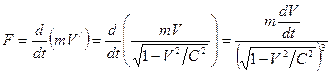 . (27)
. (27)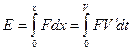 .
.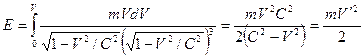 .
.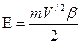 ,
, 


