Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ГЛАВА VI . Нуклеиновые кислотыСтр 1 из 7Следующая ⇒
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 30 нм фибрилла 5.3 BLAST 8.4 C-бендинг 5.4 G-бендинг 5.4 Mapviewer 8.4 N-бендинг 5.4 Pubmed 8.4 QTL 9.3 Q-бендинг 5.4 R-бендинг 5.4 β-талассемия 9.3 Аберрации хромосом 5.9 Акроцентрики 5.1 Алалия 11.1 Алкаптонурия 9.3 Аллель 2.1 Альтернативный сплайсинг 6.4 Амплификация 5.9 Анафаза 5.2 Андрогенитальный синдром 9.3 Анеуплоидия 5.8 Антикодон 6.5 Аутосомно-доминантный тип наследования 2.4 Аутосомное сцепление 2.7 Аутосомно-рецессивный тип наследования 2.4 Аутосомный, ограниченный полом тип наследования 2.4 Аходроплазия 11.4 Ацентрический фрагмент 5.9 Биоинформатика 7.8 Блот-гибридизация по Саузерну 7.3 Болезнь Гирке 9.3 Болезнь Гоше 9.3 Болезнь Коновалова-Вильсона 9.3 Болезнь Ниманна-Пика 9.3 Вербальная диспраксия 11.1 Возвратное скрещивание 2.1 Галактоземия 9.3 Гамета 5.2 Гаплоидное число хромосом 5.2 Гемизигота 2.1 Гемоглобинопатии 9.3 Генеалогическое древо 2.3 Генеративные (половые) клетки 5.2 Генетическая гетерогенность 9.3 Генетический груз глава 3 Генетический риск 10.2 Генная конверсия 6.8 Генные болезни 9.3 Геномика 7.1 Геномная база данных 8.4 Геномные библиотеки 7.4 Геномный фингерпринтинг 7.7 Генотерапия 12.1 Генотерапия 12.1 Гены-кандидаты 9.3 Гетерозигота 2.1 Гетерозиготное носительство 10.2 Гетерохроматин 5.4 Гибридизация in situ 5.5 Гибридизация нуклеиновых кислот 7.3 Гибриды 2.1 Гираза 6.2 Гистоны 5.3 Глазо-кожный альбинизм 1 9.3 Голандрический тип наследования 2.4 Гомоцистинурия 11.2 Гридированные геномные библиотеки 7.4 Группа сцепления 2.7 Дейтеранопии 11.6 Делеция 5.9 Дефишенси 5.9 Диагностика хромосомных болезней 10.1 Дигенные различия 2.5 Дигибридное скрещивание 2.5 Диплоидное число хромосом 5.2 Дислексия 11.1 Дисперсные повторы 8.1 Дисплазия соединительной ткани (ДСТ) 11.4 Дистрофия Дюшенна 11.4 Дифференциальное окрашивание 5.4 Дицентрическая хромосома 5.9 Длинные интерсперсные повторы (LINE) 8.1 ДНК 6.1 ДНК-полимераза 6.2 Доминантный аллель 2.1 Дот-блот-гибридизация 7.3 Дрейф генов глава 3 Дупликация 5.9 Закон Харди-Вайнберга глава 3 Изохоры 8.2 Изохромосома 5.9 Инверсия 5.9 Инвертированный повтор 8.1 Индивидуальная терапия 9.3 Инсерция 5.9 Интерфаза 5.2 Интрон 6.4 Искусственные хромосомы бактерий (BAC) 7.4 Искусственные хромосомы дрожжей (yacs) 7.4
Искусственные хромосомы фага P1 (PAC) 7.4 Истинная микроцефалия 11.2 Клонирование нуклеиновых кислот 7.2 Клоны 7.2 Кодоминирование 2.2 Колхицин 5.2 Кольцевая хромосома 5.9 Комплементарная ДНК (кднк) 7.2 Комплементарность 2.6 Комплементарность оснований 6.1 Конкордантность глава 4 Консолидированные повторы 8.1 Контиг 7.7 Копаралог 8.3 Короткие интерсперсные повторы (SINE) 8.1 Космиды 7.4 Криминальное поведение 11.3 Кроссоверные гаметы 2.7 Кумулятивная полимерия 2.6 Кэпирование 6.4 Лигаза 6.2 Малая интерферирующая РНК 6.1 Малая ядерная РНК 6.1 Медико-генетическое консультирование 12.2 Межаллельная комплиментация 2.2 Мейоз 5.2 Метафаза 5.2 Метафазный анализ 5.2 Метацентрики 5.1 Метод дробовика 7.7 Микросателлиты 8.1 Микротия 11.5 Микроцитогенетические синдромы 10.1 Минисателлиты 8.1 Миотоническая дистрофия 11.4 Миссенс-мутация 6.10 Митоз 5.2 Митохондриальный тип наследования. 2.4 Митохондрии 5.1 Мобильные генетические элементы (МГЭ) 6.9 Мозаицизм 5.8 Молекулярное маркирование 9.3 Моногибридное скрещивание 2.1 Мононуклеотидные полиморфные сайты (SNP) 9.3 Моносомия 5.8 Муковисцидоз 9.3 Мукополисахаридозы 9.3 Мутации 5.8 Наследственная патология 9.1 Наследственные катаракты 11.6 Наследственный дальтонизм 11.6 Наследственный сфероцитоз 9.3 Некумулятивная полимерия 2.6 Непереносимость лактозы 9.3 Неполное доминирование 2.2 Несовершенный остеогенез (НО) 11.4 Нозерн блот-гибридизация 7.3 Нонсенс-кодонов 6.5 Нонсенс-мутация 6.10 Нуклеиновые кислоты 6.1 Нуклеонема 5.3 Нуклеосомы 5.3 Нуклеотиды 6.1 Обтурационная гидроцефалия 11.2 Однояйцовые (монозиготные) близнецы глава 4 Оогенез 5.2 Ортология 8.3 Паралогия 8.3 Паралогон 8.3 Парацентрическая инверсия 5.9 Патогенетическое лечение 12.1 Патология 9.1 Пенетрантность 2.1 Перицентрическая инверсия 5.9 Пигментная ксеродерма 6.6 Плейотропия 2.6 Подагра 9.3 Позиционное клонирование 9.3 Полигенные различия 2.5 Полигибридное скрещивание 2.5 Полимеразная цепная реакция (ПЦР) 7.5 Полимерия 2.6 Полиовуляция глава 4 Полиплоидия 5.8 Правило Чаргаффа 6.1 Предел Хейфлика 5.6 Предрасположенность к алкоголизму 11.3 Пренатальная диагностика 10.1
Пробанд Сибсы полусибсы 2.3 Прогредиентное течение болезни 9.1 Промотор 6.3 Пронатопия 11.6 Протеомика 7.1 Профаза 5.2 Процессинг РНК 6.4 Прямая репарация 6.6 Псевдогены 8.1 Разнояйцовые (дизиготные) близнецы глава 4 Ранний детский аутизм 11.3 Реверсия 6.10 Редукционное деление 5.2 Рекомбинационное 2.7 Рекомбинация 6.7 Репарация ДНК 6.6 Репликационная вилка 6.2 Репликация ДНК 6.2 Ретротранспозоны с длинными концевыми повторами (LTR) 8.1 Рецессивный аллель 2.1 Реципрокная транслокация 5.9 Реципрокные скрещивания 2.7 Решетка Пеннета 2.5 Рибосомная РНК 6.1 Ринолалия 11.1 РНК 6.1 РНК-интерференция 6.1 РНК-полимераза 6.3 Робертсоновская транслокация 5.9 РТ-ПЦР 7.5 Рутинная окраска 5.4 Сайленсер 6.3 Сантиморган 2.7 Сателлиты 8.1 Сверхдоминирование 2.2 Сдвиг рамки считывания 6.10 Секвенирование ДНК 7.6 Серповидноклеточная анемия 9.3 Сестринские хроматидные обмены 5.2 Сестринские хроматиды 5.1 Симптоматическое лечение 12.1 Синдром Альпорта 11.5 Синдром Альстрема 11.6 Синдром Ангельмана 11.2 Синдром Апера 11.6 Синдром Ваарденбурга 11.5 Синдром Варкани 5.8 Синдром Вильсона 11.2 Синдром Вольфа-Хиршхорна 5.9 Синдром Дауна 5.8 Синдром дефицита внимания и гиперактивности (СДВГ) 11.3 Синдром дополнительной Y-хромосомы 5.8 Синдром Дюэйна 11.6 Синдром Жервелла и Ланге 11.5 Синдром Клайнфельтера 5.8 Синдром Корнелии де Ланге 11.2 Синдром кошачьего крика (синдром Лежена) 5.9 Синдром Крузона 11.5 Синдром Ленца 11.6 Синдром Леша-Нихена 9.3 Синдром ломкой X-хромосомы 5.9 Синдром Мартина-Белл 5.9 Синдром Марфана 9.3 Синдром Маршалла 11.6 Синдром множественных лентиго 11.5 Синдром Патау 5.8 Синдром Пендреда 11.5 Синдром Прадера-Вилли 11.2 Синдром Ригера 11.6 Синдром Ричардса-Рандля 11.5 Синдром Рубинштейна-Тейби 11.2 Синдром Санфилиппо 9.3 Синдром Смита-Магениса 11.2 Синдром Сотоса 11.2 Синдром Тричера-Коллинза 11.5 Синдром тройной Х-хромосомы 5.8 Синдром Ушера 11.5 Синдром Хантера 9.3 Синдром Хурлера 9.3 Синдром Шерешевского-Тёрнера 5.8 Синдром Эдвардса 5.8 Синдром Элерса-Данлоса 11.4 Системная биология 7.8 Соматические клетки 5.2 Сперматогенез 5.2 Сплайсинг 6.4 Сравнительная геномная гибридизация (CGH) 5.5 Субклонирование 7.7 Субметацентрики 5.1 Супрессия 2.6 Супрессорная мутация 6.10 Сцепленное с полом доминантное 2.4 Сцепленноес полом рецессивное наследование 2.4 Тандемный повтор 8.1 Т-бендинг 5.4 Теломера 5.1 Теломераза 5.6 Теломерные повторы 5.6 Телофаза 5.2 Тельце Барра 10.1 Тестикулярная феминизация 9.3 Топоизомераза 6.3 Точковая мутация 6.10 Транзиция 6.10 Трансверсия 6.10 Транскриптомика 7.1 Транскрипционный фактор 6.3 Транскрипция 6.3 Транслокация 5.9 Трансляция 6.5 Транспозоны 6.9 Транспортная РНК 6.1 Триплоидия 5.8 Трисомия 5.8 Туберозный склероз 11.2 Умственная отсталость 12.2 Уникальные последовательности ДНК 8.1 Фенилкетонурия 9.3 Фибродисплазия 9.3 Филадельфийская хромосома 5.9 Фрагильный сайт 5.9 Фрагмент Оказаки 6.2 Хеликаза 6.2 Химеризм 7.4 Хроматида 5.1 Хроматин 5.3 Хромомеры 5.3 Хромонема 5.3 Хромосомный пейнтинг 5.5 Хромосомы 5.1 Хронический миелобластный лейкоз (ХМЛ) 5.9 Хроническое течение болезни 9.1 Центромера 5.1 Центромерный индекс 5.1 Шизофрения 11.3 Эквационное деление 5.2 Экзон 6.4 Экспрессивность 2.1 Эксцизионная репарация 6.6 Энхансер 6.3 Эпистаз 2.6
Этиологическое лечение 12.1 Эухроматин 5.4 Эффект бутылочного горлышка глава 3 Ядро 5.1 Ядрышко 5.1
Учебное издание
Алексей Александрович Сазанов
ОСНОВЫ ГЕНЕТИКИ
Учебное пособие
Редактор Технический редактор Оригинал-макет
Ленинградский государственный университет имени А.С. Пушкина 196605, Санкт-Петербург, Петербургское шоссе, 10
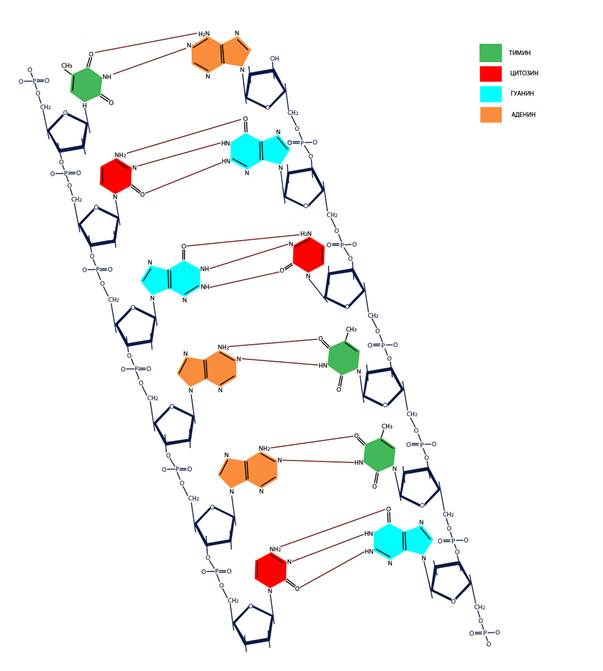
ГЛАВА VI. Нуклеиновые кислоты 6.1 Структура ДНК и РНК Нуклеиновые кислоты – полимерные (состоящие из повторяющихся единиц) химические вещества, содержащие информацию о структуре белковых молекул (кодирующие последовательности ДНК и матричная РНК), управлении их синтезом (регуляторные последовательности ДНК и сигнальные последовательности РНК) или выполняющие самостоятельные функции, так или иначе связанные с передачей наследственной информации (рибосомная РНК, транспортная РНК, малая ядерная РНК, малая интерферирующая РНК). ДНК и РНК состоят из нуклеотидов – фосфорных эфиров нуклеозидов (связанных с сахаром – дезоксирибозой или рибозой азотистых оснований) аденозина (А), гуанидина (Г), тимидина (Т), уридина (У) и цитидина (Ц). Азотистые основания – гетероциклические органические соединения, производные пурина – аденин и гуанин, или пиримидина – тимин, урацил, цитозин. Комплементарность (образование связей между взаимодополняющими фрагментами молекул) пар АТ (АУ) и ГЦ обеспечивается наличием двух или трех водородных связей соответственно. В одной цепи нуклеотиды связаны путем образования 5’-3’ сахарофосфатной ковалентной связи (Рисунок VI, 1). При этом комплементарные цепи ориентированы в противоположных направлениях одна 5’→3’, а другая - 3’→5’ (они антипараллельны).
Рисунок VI, 1. Первичная структура ДНК. У всех живых существ, кроме некоторых вирусов, молекула ДНК имеет спиральную вторичную структуру, в которой азотистые основания находятся внутри, а сахарофосфатный остов – снаружи (Рисунок VI, 2).
Рисунок VI, 2. Вторичная структура ДНК.
Из принципа комплементарности (возможности образования пар аденина с тимином (урацилом) и гуанина с цитозином) следует правило Чаргаффа: - количество аденина равно количеству тимина, а количество гуанина — количеству цитозина: А=Т, Г=Ц; - количество пуринов равно количеству пиримидинов: А+Г=Т+Ц; - количество оснований с 6 аминогруппами равно количеству оснований с 6 кетогруппами: А+Ц=Г+Т.
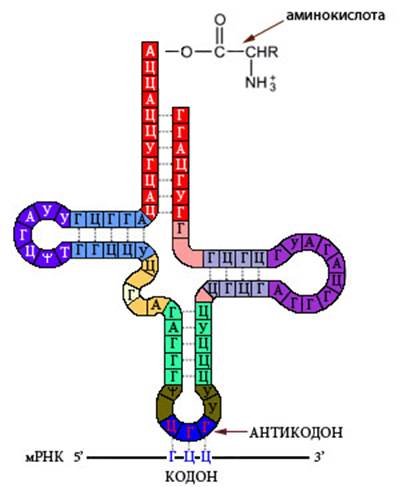
Соотношения АТ- и ГЦ- могут быть различны в разных районах хромосом. Например, у млекопитающих G+-районах превалируют АТ-пары, а в R+-районах – ГЦ (раздел 5.4). Интересно, что основная «молекула жизни» - ДНК сама по себе мертва и оживляется только в процессах репликации и транскрипции при помощи особых ферментов – полимераз, которые обеспечивают ее копирование и прочтение. Существует несколько типов РНК, имеющих различную вторичную и третичную структуры. Наибольшее биологическое значение имеют матричная (информационная) РНК (мРНК), транспортная РНК (тРНК), рибосомная РНК (рРНК), малая ядерная РНК (мяРНК) и малая интерферирующая РНК. мРНК комплементарна кодирующим последовательностям ДНК и содержит информацию об аминокислотной последовательности своего белкового продукта. Считывание мРНК происходит в процессе трансляции - синтеза белка на основе мРНК. Каждой из 20 канонических (универсальных для живых организмов) аминокислот соответствует набор из трех – триплет - нуклеотидов – кодон. Одной аминокислоте может соответствовать два или несколько кодонов – в этом заключается вырожденность генетического кода. Три кодона не кодируют аминокислот, поэтому синтез белка на них останавливается. Это стоп-кодоны или нонсенс-кодоны - УАГ (амбер), УГА (опал) и УАА (охра). Кроме содержащей кодоны – транслируемой – области, зрелая мРНК содержит нетранслируемые области, которые регулируют стабильность молекулы и интенсивность считывания. Молекулы мРНК иногда имеют двуцепочечные участки – шпильки и псевдоузлы, – которые могут участвовать в регуляции трансляции. тРНК имеет вторичную структуру, напоминающую лист клевера (Рисунок VI, 3). На центральной петле находится антикодон – триплет, комплементарный кодону соответствующей данной молекуле тРНК аминокислоты. К противоположному концу молекулы тРНК прикрепляется аминокислота.
Рисунок VI, 3. Транспортная РНК.
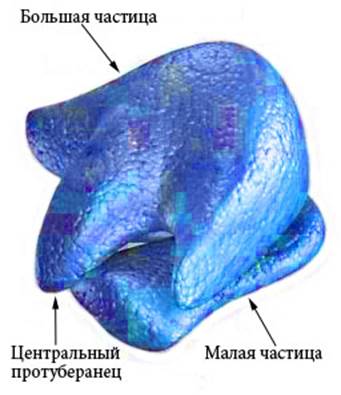
рРНК входит в состав рибосом (Рисунок VI, 4) и выполняет каталитическую функцию при образовании пептидных связей между аминокислотными остатками в процессе трансляции. Малая частица рибосомы эукариот представляет собой рибонуклеопротеиновый комплекс на основе субъединицы РНК с константой седиментации (скорости осаждения при центрифугировании) 40S (S – единица Сведборга), которая состоит из молекул 18S РНК. Основой большой частицы рибосомы является субъединица 60S, которая состоит из трех молекул рРНК — 28S, 5,8S и 5S. Рибосомная РНК составляет около 70% от общего количества РНК в клетке. Митохондрии имеют свои особые рибосомы, состоящие из 50S и 30S субъединиц (подобно бактериальным рибосомам).
Рисунок VI, 4. Схема строения рибосомы. По материалам сайта http://www.cartage.org.lb/en/themes/sciences/zoology/animalphysiology/anatomy/animalcellstructure/Ribosomes/Ribosomes.htm.
мяРНК представлена молекулами с большим содержанием уридина длиной 100-300 нуклеотидов, которые входят в состав мелких рибонуклеопротеиновых гранул ядра. Функция этого типа РНК заключается в участии в созревании молекул мРНК.
Малая интерферирующая РНК представлена короткими (20-25 нуклеотидов) двуцепочечными молекулами, которые, связываясь с отдельными мРНК по принципу комплементарности, могут подавлять синтез определенных белков и приводить соответствующую молекулу мРНК к деградации. В этом заключается явление РНК-интерференции. Особое значение этот тип РНК имеет в онтогенезе – индивидуальном развитии организмов.
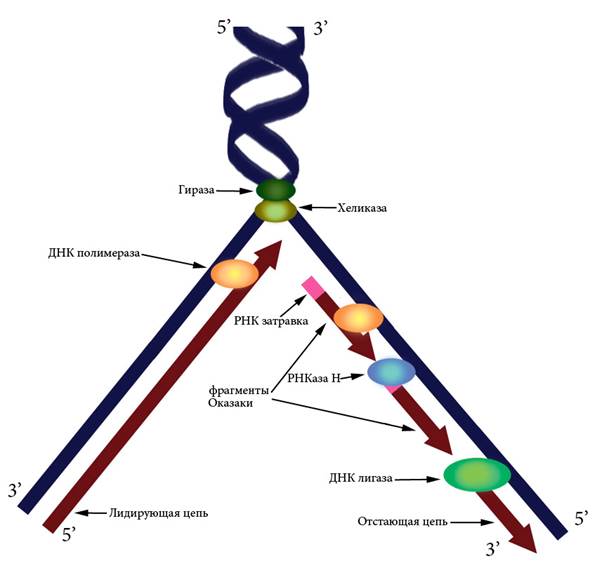
6.2 Репликация ДНК Репликация ДНК — это процесс удвоения молекулы дезоксирибонуклеиновой кислоты с образованием идентичных дочерних молекул. У человека репликация происходит в фазе S клеточного цикла. Репликацию ДНК осуществляет фермент ДНК-полимераза. Для протекания процесса репликации необходимо расплести двойную спираль ДНК, вращать макромолекулу и удерживать ее в расплетенном состоянии. Эти функции выполняют гираза (расплетение спирали), хеликаза (разделение нитей), и ДНК-связывающие белки (удержание). Точность репликации обеспечивается принципом комплементарности пар оснований и свойствами ДНК-полимеразы, благодаря которым этот фермент способен распознать и исправить ошибку. У эукариотических организмов в процессе репликации принимают участие несколько типов ДНК-полимераз. После удвоения происходит суперспирализация синтезированных молекул и дальнейшая компактизация ДНК. Процесс репликации требует затрат энергии. Ранее существовали три модели механизма репликации ДНК. Согласно консервативному механизму в результате репликации одна молекула ДНК состоит только из родительских цепей, а другая — только из дочерних цепей. Дисперсионная модель предполагала, что все получившиеся в результате репликации молекулы ДНК состоят из цепей, одни участки которых вновь синтезированы, а другие взяты из родительской молекулы ДНК). Полуконсервативный механизм репликации заключается в том, что каждая молекула ДНК состоит из одной цепи исходной родительской молекулы и одной вновь синтезированной цепи. Полуконсервативный механизм был доказан в 1958 г. опытами М. Мезельсона и Ф. Сталя. Поскольку ДНК-полимераза не умеет начинать синтез новой нити на однонитевой матрице, а может только прикреплять новые нуклеотиды к уже имеющейся цепи, инициация репликации происходит путем образования небольшого участка ДНК-РНК при помощи фермента ДНК-праймазы. К 3’-концу РНК-затравки ДНК-полимераза добавляет новые нуклеотиды, а РНКаза H потом разрушает РНК в гибридных участках. Лигаза сшивает синтезированные фрагменты ДНК (Рисунок VI, 5). ДНК-полимераза может вести синтез только в направлении 5’→ 3’, то есть присоединять новый нуклеотид к 3’-концу уже синтезированной части. Двунитевая структура ДНК предполагает необходимость синтеза в двух направлениях 5’→ 3’ и 3’→ 5’. Эта задача решается путем образования Y-образной структуры – репликационной вилки (Рисунок VI, 5). При этом цепь 3’→ 5’ является лидирующей – синтез на ней идет непрерывно, а цепь 5’→ 3’ – отстающей, поскольку на ней синтез идет в отдельных участках – фрагментах Оказаки, каждый из которых начинается с новой РНК-затравки.
Рисунок VI, 5. Схема репликационной вилки.
6.3 Транскрипция Транскрипцией называется синтез мРНК на матрице ДНК. Процесс синтеза РНК протекает в направлении от 5'- к 3'- концу, то есть по матричной цепи ДНК ДНК-зависимая РНК-полимераза – фермент, осуществляющий транскрипцию - движется в направлении 3'→5', прикрепляя новый рибонуклеозидтрифостат к 3'-концу уже синтезированной молекулы РНК. Инициация транскрипции — сложный процесс, зависящий от последовательности ДНК, находящейся вблизи транскрибируемой последовательности – промотора и от более удаленных от точки начала синтеза участков генома — энхансеров (активирующих транскрипцию) и сайленсеров (дезактивирующих транскрипцию). Во всех этих участках есть сайты связывания транскрипционных факторов – белков, регулирующих процесс транскрипции и входящих в состав транкрипционного комплекса. При переходе транскрипции от инициации к следующей стадии - элонгации - происходит диссоциация связей между РНК-полимеразой, промотором и факторами инициации транскрипции. В период элонгации в ДНК расплетено примерно 18 пар нуклеотидов. Примерно 12 нуклеотидов матричной нити ДНК образует гибридную спираль с растущей цепью РНК. По мере движения РНК-полимеразы по матрице впереди нее происходит расплетание, двухцепочечной молекулы ДНК, а позади фермента двойная спираль ДНК восстанавливается. В этот момент из комплекса освобождается очередное звено растущей цепи РНК с матрицей и РНК-полимеразой. Все эти перемещения подразумевают относительное вращение РНК-полимеразы и ДНК. Поэтому для предотвращения такого вращения двигающуюся по ДНК РНК-полимеразу сопровождают топоизомеразы. На стадии элонгации в процессе транскрипции немаловажную роль играют также основные элонгирующие факторы, которые необходимы для предотвращения преждевременной терминации матричного процесса. Следующая фаза процесса транскрипции называется терминацией. В этот момент растущий транскрипт освобождается и происходит диссоциация РНК-полимеразы и ДНК-матрицы. После завершения стадии терминации транскрипции происходит разрезание РНК, а затем к её 3' концу с помощью фермента полиА-полимеразы добавляется 100-200 оснований аденина, которые оказывают влияние на стабильность полученного транскрипта.
6.4 Процессинг РНК. Созревание мРНК называется процессинг. Биологическое значение процессинга в эукариотической клетке заключается в возможности получения различных комбинаций экзонов гена, а значит, получения большего разнообразия белков, кодируемых одной нуклеотидной последовательностью ДНК. Кроме того модификация 3’- и 5’-концов мРНК служит для регуляции ее экспорта из ядра, поддержания стабильности в цитоплазме и для улучшения взаимодействия с рибосомами. Еще до завершения транскрипции происходит полиаденилирование 3’-конца (раздел 6.3). К 5'-концу мРНК посредством трифосфатного моста присоединяется 7-метилгуанозин, соединяющийся в необычной позиции 5'→5', и происходит метилирование рибоз двух первых нуклеотидов. Этот процесс называется кэпирование. Процесс вырезания определенных нуклеотидных последовательностей из молекул РНК и соединения последовательностей, сохраняющихся в «зрелой» молекуле, в ходе процессинга РНК, называется сплайсингом. В ходе сплайсинга из мРНК участки, не кодирующие белок (интроны) удаляются, а экзоны - участки, кодирующие аминокислотную последовательность, соединяются друг с другом, и незрелая пре-мРНК превращается в зрелую мРНК, с которой синтезируются (транслируются) белки клетки. Для сплайсинга необходимо наличие специальных 3'- и 5' — последовательностей. Сплайсинг катализируется, состоящим из РНК и белков большим комплексом, который называется сплайсосомой. Сплайсосома включает пять малых ядерных рибонуклеопротеидов (мяРНП) - U1, U2, U4, U5 и U6. РНК, входящая в состав мяРНП, взаимодействует с интроном и, возможно, участвует в катализе. Она принимает участие в сплайсинге интронов, содержащих в 5' сайте ГУ, и АГ в 3' сплайсинг-сайте. Иногда мРНК в процессе созревания могут подвергаться альтернативному сплайсингу. Альтернативный сплайсинг заключается в том, что имеющиеся в составе пре-мРНК интроны вырезаются в разных альтернативных комбинациях, при которых вырезаются и некоторые экзоны. Некоторые из продуктов альтернативного сплайсинга пре-мРНК нефункциональны, как например, при определении пола у плодовой мушки дрозофилы, однако часто в результате альтернативного сплайсинга пре-мРНК одного гена образуются многочисленные мРНК и их белковые продукты. В настоящее время известно, что у человека 94 % генов подвержено альтернативному сплайсингу (остальные 6 % генов не содержат интронов). Альтернативный сплайсинг у многоклеточных эукариот является ключевым механизмом увеличения разнообразия белков, не создавая избыточных копий гена, а также позволяет осуществлять тканеспецифическую и стадиеспецифическую регуляцию экспрессии (проявления) генов.
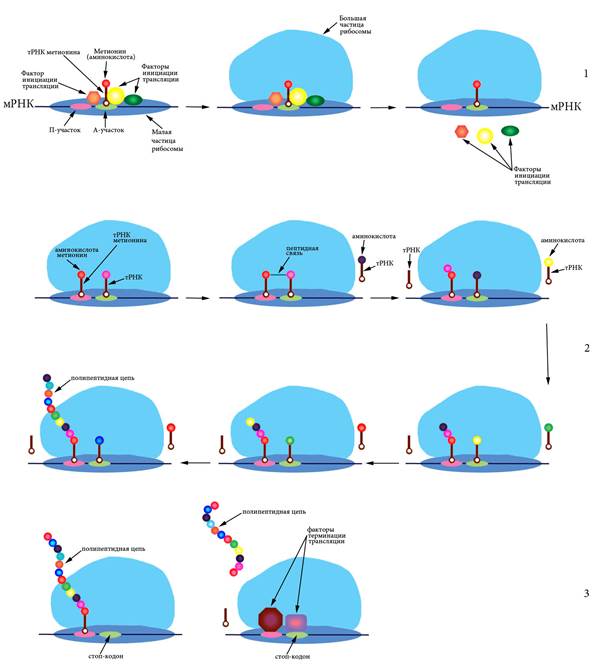
6.5 Трансляция Синтез белковых молекул из аминокислот на матрице мРНК при участии рибосом и тРНК называется трансляцией. Процесс происходит в цитоплазме на полисомах – комплексах, состоящих из мРНК и многих рибосом с прикрепленными молекулами тРНК (Рисунок VI, 6).
Рисунок VI, 6. Схема трансляции. 1 – инициация, 2 – элонгация, 3 – терминация.
Процесс состоит из инициации (узнавания рибосомой стартового кодона и начала синтеза), элонгации (синтеза белка) и терминации (узнавания стоп-кодона и отделения белкового продукта). Поскольку каждый кодон состоит из трех нуклеотидов, каждая последовательность может быть прочитана трояко – начиная с первого, второго либо третьего нуклеотида, иными словами имеется три возможных рамки считывания. Стартовым кодоном почти всегда является АУГ. Рамки считывания, начинающиеся с этого кодона, называются открытыми. Для инициации рибосома сканирует мРНК пока не найдет кодон АУГ. Обычно она воспринимает только те стартовые кодоны, которые находятся вблизи 5’-кэпа. Специальные белки – факторы инициации трансляции – участвуют в узнавании стартового кодона и присоединении инициаторной тРНК, содержащей антикодон УАЦ, соответствующий аминокислоте метионин. К этой тРНК метионин присоединен при помощи фермента аминоацил-тРНК-синтетазы. Вначале малая частица рибосомы (сама или в комплексе с тРНК) садится на мРНК, а затем к ней присоединяется большая частица и происходит отсоединение факторов инициации трансляции. Собранная рибосома начинает элонгировать цепь. В ходе элонгации один белковый фактор переносит тРНК в аминоацильный центр рибосомы (А-центр), а после формирования пептидной связи в петидильном центре (П-центре) второй фактор элонгации катализирует смещение рибосомы на один триплет (Рисунок VI, 6). Когда рибосома доходит до одного из нонсенс-кодонов - УАГ (амбер), УГА (опал) или УАА (охра), – подходящей тРНК не обретается и новая пептидная связь не образуется. Под действием специальных белковых факторов происходит отделение рибосомы от мРНК и освобождение готовой белковой молекулы.
6. 6 Рекомбинация. Генетическая рекомбинация – процесс, при котором происходит разрыв молекулы нуклеиновой кислоты (обычно ДНК, но возможно и РНК) и соединение с другой молекулой ДНК. Рекомбинация может происходить как между сходными молекулами ДНК – гомологичная рекомбинация – так и между различающимися - негомологичная рекомбинация. У эукариот рекомбинация происходит в процессе мейоза в ходе кроссинговера и иногда в соматических клетках. Процесс кроссинговера приводит к появлению потомков с комбинациями генов, отличными от родительских, и появлению новых химерных аллелей. У организмов, имеющих адаптивную иммунную систему, имеется особая система рекомбинации, благодаря которой быстро образуется большое разнообразие лимфоцитов, способных узнавать новые антигены. В генной инженерии под рекомбинантной ДНК понимают молекулы, полученные в результате искусственно осуществленной рекомбинации молекул ДНК, часто принадлежащих разным видам. Лучшим примером такого подхода является получение рекомбинантных белков, нашедших свое применение в фармакологии и медицине. Этот метод очень важен для биомедицинских исследований, поскольку позволяет изучать эффекты определенных генов. В процессе рекомбинации задействовано множество различных ферментов, называемых рекомбиназами. В мейозе в процессе кроссинговера происходит рекомбинация между спаренными гомологичными хромосомами, унаследованными от каждого из родителей. В ходе профазы I все четыре хроматиды расположены достаточно близко друг от друга, так что две хроматиды могут перекрещиваться одна с другой, и в этот момент может происходить обмен генетической информацией в гомологичных сайтах (раздел 5.2).
6. 7 Репарация ДНК Репарация — исправление повреждений в молекулах ДНК, возникших из-за ошибок ДНК-полимеразы в процессе репликации или вследствие воздействия физических или химических агентов. Процессы репарации осуществляются специальными ферментными системами клетки. Дефекты ферментов систем репарации приводят к развитию ряда наследственных заболеваний, таких как пигментная ксеродерма. Имеется, по крайней мере, две ферментные системы репарации — прямая и эксцизионная. При прямой репарации задействованы специфические ферменты, быстро (обычно в одну стадию) устраняющие соответствующее повреждение, восстанавливая исходную структуру нуклеотидов. Это наиболее простой путь устранения повреждений ДНК. Так действует, например, O6-метилгуанин-ДНК-метилтрансфераза, которая переносит метильную группу с азотистого основания на один из собственных остатков цистеина. Эксцизионная репарация заключается в удалении (эксцизии) повреждённых азотистых оснований из ДНК с последующим восстановлением нормальной структуры молекулы. Системы репарации включают следующие компоненты: - фермент, способный узнавать изменённые участки в цепи ДНК и делать надрез цепи вблизи повреждения; - фермент, удаляющий повреждённый участок; - фермент (ДНК-полимераза), синтезирующий соответствующий участок цепи ДНК взамен удалённого; - фермент (ДНК-лигаза), восстанавливающий непрерывность полимерной цепи. Существует также рекомбинационная репарация.
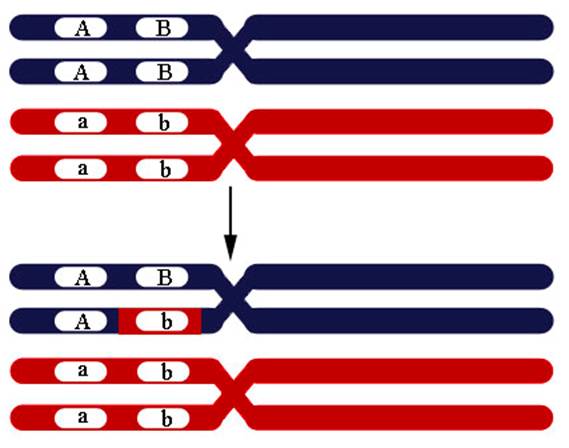
6.8 Генная конверсия. Генная конверсия – процесс, при котором информация последовательности ДНК передается (переносится) с одной нити ДНК, которая остается неизменной, на другую нить ДНК, последовательность которой изменяется. Это один из механизмов генных мутаций. Генная конверсия может быть причиной неменделевского наследования. Такая конверсия одной аллели в другую происходит по причине репарации неправильно спаренных оснований в ходе рекомбинации. При коньюгации одной из четырех нитей с другой из гомологичной хромосомы репарация неправильно спаренных оснований может пройти по матрице другой хромосомы, что приводит к замене аллеля (Рисунок VI, 7). В норме диплоидный организм несет по одному аллелю от каждого из родителей (соотношение гамет в мейозе 1А:1а у гетерозиготы). При конверсии это соотношение изменяется (3A:1a, 1A:3a, 5A:3a или 3A:5a). Генные конверсии могут быть причиной наследственных заболеваний.
Рисунок VI, 7. Конверсия генов.
6.9 Подвижные элементы генома. Мобильные генетические элементы (МГЭ) представляют собой участки ДНК, способные перемещаться по геному. К ним относятся: - транспозоны; - плазмиды; - бактериофаги; - интроны группы 2. Для млекопитающих из всех МГЭ наиболее характерны транспозоны. Транспозон — это последовательность ДНК, которая способна перемещаться внутри генома в результате процесса, который называется транспозицией. Встраиваясь в геном, транспозоны могут вызывать различные мутации, в том числе и хромосомные перестройки. Транспозоны обычно состоят из двух прямых или инвертированных повторяющихся последовательностей ДНК, между которыми находятся гены, необходимые для транспозиции. Иногда в составе центральной части транспозонов находятся гены, которые обеспечивают эволюционное преимущество для организма, содержащего мобильный элемент. Различают два класса транспозонов: к первому относят ретротранспозоны, перемещение которых по геному происходит путём обратной транскрипции, второй класс - ДНК-транспозоны, перемещающиеся путём прямого вырезания и вставки с использованием фермента транспозазы. Транспозоны могут играть важную роль в геноме организма. Так, например, некоторые гены-регуляторы, обеспечивающие адекватную реакцию растений на изменения освещенности, появились в результате встраивания в их геном транспозонов. Транспозоны могут быть причиной дестабилизации генома. Не менее 80 % мутаций являются следствием активности этих мобильных элементов. Выше было сказано о возможном влиянии происходящей с возрастом дерепрессии транспозонов на темп укорочения теломер (раздел 5.6), что определяет старение как биологический феномен. 6.10 Генные мутации Мутация — это изменение генетического аппарата, которое может быть унаследовано дочерними клетками или потомками организма. Мутации принято подразделять на спонтанные (самопроизвольно возникающие в течение всей жизни организма в условиях окружающей среды, являющихся нормальными для данного организма) и индуцированные - возникающие под воздействием неблагоприятных условий окружающей среды или в ходе экспериментов в лабораторных условиях. Частота возникновения спонтанных мутаций колеблется в пределах 10 − 9 — 10 − 12 на нуклеотид за клеточную генерацию. В живой клетке постоянно происходят такие процессы как репликация ДНК, репарация ДНК и генетическая рекомбинация, в ходе которых постоянно возникают мутации. К возникновению мутаций приводят спонтанные изменения химической структуры нуклеотидов, которые происходят при репликации. Так, например, при дезаминировании цитозина в одной из цепей ДНК образуется урацил. В этом случае вместо канонической пары оснований ГЦ появляется пара ГУ. В дальнейшем в процессе репликации в новую цепь комплиментарно урацилу включается уже аденин, и образуется пара АУ, а в следующем цикле репликации она заменяется на каноническую пару АТ. Таким образом, происходит транзиция – точечная замена одного пиримидина на другой пиримидин. Аналогично происходит и замена одного пурина на другое пуриновое основание. Из всех рекомбинационных процессов мутации чаще всего происходят в ходе неравного кроссинговера. Как правило, неравный кроссинговер происходит в тех участках хромосом, где локализуется несколько копий одного и того же гена, возникших в результате дупликации или мультипликации, и сохранивших высокую степень гомологии. В результате неравного кроссинговера в одной из хромосом появляется делеция некоторого участка, а в другой – его дупликация. В течение жизни любой клетки довольно часто происходят спонтанные повреждения ДНК. Для того чтобы устранять эти повреждения существуют особые ферментные системы - системы репарации (раздел 6.7). Если по каким-либо причинам в работе систем репарации происходит сбой, возникают мутации. Мутации могут появляться и в генах, кодирующих сами ферменты систем репарации, что приводит к резкому повышению (мутаторный эффект) или снижению (антимутаторный эффект) частоты мутаций других генов. У человека известно заболевание пигментная ксеродерма, при котором под действием ультрафиолетового облучения возникают дерматиты, а позднее и злокачественные новообразования кожи. Причиной данного заболевания является мутация, в результате которой нарушается работа системы репарации. Существенно увеличить частоту мутаций могут не только изменения в системах ферментов репарации клетки, но и многие другие факторы, которые называются мутагенными. Различают химические (вещества, вызывающие мутации, например, нитрозометилмочевина, этиленимин и др.), физические (ионизирующее и ультрафиолетовое излучения, высокая температура и т.д.) и биологические (ретровирусы, ретротранспозоны) мутагены. Генные мутации встречаются чаще, чем другие типы мутаций. Генные мутации представляют собой замены, делеции и вставки одного или нескольких нуклеотидов, транслокации, дупликации и инверсии различных частей гена. Мутация, затрагивающая только один нуклеотид, называется точковой. Замены одного нуклеотида другим называются транзициями (замена пурина на пурин или пиримидина на пиримидин) или трансверсиями (замена пурина на пиримидин или наоборот). Последствия точковых мутаций могут быть различными. Если в результате замены нуклеотида смысл кодона сохраняется из-за вырожденности генетического кода, то такая замена называется синонимической. Нуклеотидная замена может изменить смысл кодона и привести к замене соответствующего данному кодону аминокислотного остатка в полипептидной цепи (миссенс-мутация). В результате замены одного нуклеотида возможна также преждевременная терминация трансляции из-за образования бессмысленного кодона: амбер — УАГ, охра — УАА или опал — УГА. Подобные мутации называются также нонсенс-мутациями. Возможны также мутации, приводящие к замене стоп-кодонов на смысловые. Из-за триплетности генетического кода, в случае если происходит делеция или вставка числа нуклеотидов, не кратного трем, происходит сдвиг рамки считывания, обессмысливающий трансляцию.
|
|||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 124; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.194.170 (0.114 с.) |