
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Алгоритм розв ’ язання задач⇐ ПредыдущаяСтр 11 из 11
1.Виявити в ГЕ (А) і (К), за значеннями електродних потенціалів (Е0 – беремо в ряду напруг металів Н.Н.Бекетова). 2. Записати: 2.1) електрохімічну формулу ГЕ; 2.2) електронне напіврівняння анодного процесу; 2.3) електронне напіврівняння катодного процесу; 2.4) сумарне рівняння роботи ГЕ; 3. Привести розрахунок ЕРС (ΔЕ). 4. Обчислити можливість роботи ГЕ і зробити висновок. Приклад розв ’ язання задачі за алгоритмом Запишіть електрохімічну формулу ГЕ, складеного зі стандартного магнієвого електрода, зануреного у розчин своєї солі та залізного електрода, зануреного в 0,01 М розчин FeSO4. Запишіть електронні напіврівняння анодного та катодного процесів та сумарне рівняння реакції. Розрахуйте ЕРС та ΔG цього ГЕ. Зробіть висновки про можливість роботи цього ГЕ та залежність електродного потенціалу від концентрації електроліту, у який занурен електрод. Задачу розв’язуємо згідно алгоритму. 1. Знаходимо в ряду напруг М.М. Бекетова 2. Розрахуємо
При розведенні розчину електроліту, у який занурен електрод, його електродний потенціал зменшується, а активність збільшується.
3. Запишемо електрохімічну формулу ГЕ: (А) Mg | Mg2+||Fe2+SO4 | Fe (K)
електронне напіврівнення анодного процесу: Mg0 - 2ē → Mg2+ 1 + електронне напіврівняння катодного процесу: Fe 2+ + 2ē → Fe 0 1 Сумарне рівняння: Mg0+Fe2+→Mg2++Fe0 4. Розрахуємо ЕРС з рівняння (3): ЕРС(ΔЕ)=ЕК-ЕА=-0,50-(-2,38)=1,88 (В). 5.Обчислимо ΔG з рівняння (2): ΔG<0 – ГЕ буде робити. Методика рішення задач з теми «Електрохімічна корозія металів» Щоб розв’язати задачи з цієї теми, треба знати, що електрохімічна корозія відбувається в середовищі електроліту. При контакті між собою металів різної активності, або електрохімічній корозії сплаву виникають мікрогальванопари і процесс електрохімічної корозії йде подібно процессам при роботі ГЕ, тобто анод завжди окислюється, а на катоді йде відновлення електроліту (деполярізація). При атмосферній корозії (рН≥7), катодний процес записуємо: 2Н2О+О2+4ē → 4ОН-, оксигенова деполярізація.
При корозії в кислому середовищі (рН<7), катодний процес записуємо: 2Н++2ē → Н2, гідрогенова деполярізація. Алгоритм розв ’ язання задач і 1. Виявляємо (А) і (К) згідно значенням стандартних електродних потенціалів (Е0), які беремо з ряду напруг металів. 2. Виявляємо електроліт і значення рН. 3. Складаємо електрохімічну формулу гальванопари, напіврівняння анодного та катодного процесів та сумарне рівняння. 4. Визначаємо деполярізатор, чи розраховуємо ЕРС. Приклад розв’язання задач і Які хімічні процеси протікають при атмосферній корозії сталевого виробу (Fe), вкритого цинком (Zn) (рН≥7), та вкритого міддю(Cu) в кислому середовищі (рН<7), якщо покриття зруйновано. Визначте вид деполярізації в цих процессах, розрахуйте ЕРС (не враховуючи вплив середовища на Е0). Якщо Fe вкрит Zn, а покриття зруйновано, виявляємо (А) – це Zn ( Запишемо електрохімічну формулу утворенного ГЕ: (А) Zn | H2O, O2 |Fe (K) -0,76 рН ≥7 -0,44
електронне напіврівнення катодного процесу 2 H 2 O + O 2 +4ē→ 4 OH - 1 Сумарне рівняння: 2Zn0+2H2O+O2→2Zn(OH)2 Якщо Fe вкрите Cu, а покриття зруйновано, виявляємо (А) – це Fe, ( Запишемо електрохімічну формулу утворенного ГЕ: (А) Fe | 2H+ |Cu (K) -0,44 рН <7 +0,34
+ електронне напіврівнення катодного процесу: 2 H + + 2ē → H 2 1 Сумарне рівняння: Fe0+2H+ →Fe2++ H2
Д о д а т о к 2 КОНТРОЛЬНІ ЗАВДАННЯ ЕКВІВАЛЕНТИ Й ЕКВІВАЛЕНТНІ МАСИ ПРОСТИХ І СКЛАДНИХ РЕЧОВИН. ЗАКОН ЕКВІВАЛЕНТІВ 1. Визначте еквівалент і молярну масу еквівалента Фосфору, Оксигену та Брому в сполуках РН 3, H2O, HBr. 2. У якій масі NaOH міститься стільки ж еквівалентів, скільки у 140 г КОН? Відповідь: 100 г. 3. З 1,35 г оксиду металу утворюється 3,15 г його нітрату. Обчисліть молярну масу еквівалента цього металу. Відповідь: 32, 5 г/моль. 4. З 1,3 г гідроксиду металу утворюється 2,85 г його сульфату. Обчислите молярну масу еквівалента цього металу. Відповідь: 9 г/моль. 5. Оксид тривалентного елемента містить 31,58% Оксигену. Обчисліть еквівалентну, молярну й атомну маси цього елемента. 6. Чому дорівнює при н.у. мольний об'єм еквівалента водню? Обчисліть молярну масу еквівалента металу, якщо на відновлення 1,017г його оксиду витратилося 0,28 л водню (н.у.). Відповідь: 32, 68 г/моль. 7. Виразити в молях: а) 6,02 × 1022 молекул С2Н2; б) 1,80 × 1024 атомів Нітрогену; в) 3,01 × 10 молекул NH3. Яка молярна маса зазначених речовин? 8. Обчисліть еквівалент і молярну масу еквівалента Н3 РО 4 у реакціях утворення: а) гідрофосфату; б) дігідрофосфату; в) ортофосфату. 9. В 2,48 г оксиду одновалентного металу міститься 1,84 г металу. Обчисліть молярні маси еквівалентів металу і його оксиду. Чому дорівнює мольна й атомна маса цього металу? 10. Чому дорівнює при н.у. мольний об'єм еквівалента кисню? На спалювання 1,5 г двовалентного металу потрібно 0,69 л кисню (н.у.). Обчисліть молярну масу еквівалента, мольну масу й атомну масу цього металу. 11. З 3,31 г нітрату металу утворюється 2,78 г його хлориду. Обчисліть молярну масу еквівалента цього металу. Відповідь: 103,6 г/моль. 12. Напишіть рівняння реакцій Fe(OH)3 із хлороводневою (соляною) кислотою, при яких утворяться наступні сполуки заліза: а) хлорид дигідроксoзаліза; б) діхлорид гідроксозаліза; в) трихлорид заліза. Обчисліть еквівалент і молярну масу еквівалента Fe(OH)3 у кожній з цих реакцій. 13. Надлишком гідроксиду калію подіяли на розчини: а) Калія дігідрофосфат; б) дігідроксобісмута (III) нітрату. Напишіть рівняння реакцій цих речовин з КОН і визначте їхні еквіваленти та молярні маси еквівалентів. 14. У якій кількості С r (ОН)3 міститься стільки ж еквівалентів, скільки в 174,96 г Мg (ОН)2? Відповідь: 208,2 г. 15. Надлишком хлоридної (соляної) кислоти подіяли на розчини: а) Кальція гідрокарбонату; б) гідроксоалюмінія діхлориду. Напишіть рівняння реакцій цих речовин з HCl і визначите їхні еквіваленти й мольні маси еквівалентів. 16. При окислюванні 16,74 г двовалентного металу утворилося 21,54 г оксиду. Обчисліть молярні маси еквівалентів металу і його оксиду. Чому дорівнюють мольна й атомна маси металу? 17. При взаємодії 3,24 г тривалентного металу з кислотою виділяється 4,03 л водню (н.у.). Обчисліть молярну масу еквівалента, мольну й атомну маси металу. 18. Виходячи з мольної маси Карбону і води, визначте абсолютну масу атома Карбону і молекули води в грамах. Відповідь: 2,0 × 10-23 г, 3,0 × 10-23 г. 19. На нейтралізацію 9,797 г ортофоcфатноЇ кислоти витрачено 7,998 г NaOH. Обчисліть еквівалент, молярну масу еквівалента і основність Н3 РО 4 у цій реакції. На підставі розрахунку напишіть рівняння реакції. Відповідь: 0,5 моль, 49 г/моль, 2. 20. На нейтралізацію 0,943 г фосфористої кислоти Н3 РО 3 витрачено 1,291 КОН. Обчисліть еквівалент, еквівалентну масу й основність кислоти. На підставі розрахунку напишіть рівняння реакції.
Відповідь: 0,5 моль, 41 г/моль, 2.
БУДОВА АТОМУ 21. Напишіть електронні формули атомів елементів з порядковими номерами 9 і 28. Покажіть розподіл електронів цих атомів по квантових комірках. До якого електронного сімейства ставиться кожний з цих елементів? 22. Напишіть електронні формули атомів елементів з порядковими номерами 16 і 26. Розподілите електрони цих атомів по квантових комірках. До якого електронного сімейства відноситься кожний з цих елементів? 23. Яке максимальне число електронів можуть мати s-, p-, d- і f-орбіталі даного енергетичного рівня? Чому? Напишіть електронну формулу атома елемента з порядковим номером 31. 24. Напишіть електронні формули атомів елементів з порядковими номерами 25 і 34. До якого електронного сімейства відноситься кожний з цих елементів? 25. Які орбіталі атому заповнюються електронами раніше: 4s або 3d; 5s або 4р? Чому? Напишіть електронну формулу атому елемента з порядковим номером 21. 26. Ізотоп нікелю - 57 утворюється при бомбардуванні 27. Які орбіталі атому заповнюються електронами раніше: 4d або 5s; 6s або 5р? Чому? Напишіть електронну формулу атому елемента з порядковим номером 43. 28. Що таке ізотопи? Чим можна пояснити, що в більшості елементів періодичної системи атомні маси виражаються дробовим числом? Чи можуть атоми різних елементів мати однакову масу? Як називаються подібні атоми? 29. Ізотоп кремнію- 30 утворюється при бомбардуванні 30. Напишіть електронні формули атомів елементів з порядковими номерами 14 і 40. Скільки вільних d-орбіталей має атом останнього елемента? 31. Ізотоп Карбону - 11 утворюється при бомбардуванні протонами ядер атомів Нітрогену - 14. Складіть рівняння цієї ядерної реакції й напишіть його у скороченій формі. 32. Напишіть електронні формули атомів елементів з порядковими номерами 15 і 28. Чому дорівнює максимальний спін р-електронів в атомі першого та d-електронів у атомі другого елемента? 33. Напишіть електронні формули атомів елементів з порядковими номерами 21 і 23. Скільки вільних d-орбіталей мають атоми цих елементів?
34. Скільки і які значення може приймати магнітне квантове число ml при орбітальному числі l = 0, 1, 2 й 3? Які елементи в періодичній системі називають s-, р-, d- і f-елементами? Приведіть приклади. 35. Які значення можуть приймати квантові числа n, 36. Які з електронних формул, що відтворюють будову незбудженого атому деякого елемента, невірні: a) 1s22s22p53s1; б) 1s22s22p6; в) 1s22s22p63s23p63d4; г) 1s22s22p63s23p64s2; д) 1s22s22p63s23d2? Чому? Атомам яких елементів відповідають правильно складені електронні формули? 37. Напишіть електронні формули атомів елементів з порядковими номерами 24 і 33, з огляду на те, що у першого відбувається "провал" одного 4s-електрона на 3d-підрівень. Чому дорівнює максимальний спін d-електронів у атома першого та р-електронів у атома другого елементів? 38. Квантові числа електронів зовнішнього енергетичного рівня атомів деякого елемента мають наступні значення: n =4; 39. У чому полягає принцип Паулі? Чи може бути на якому-небудь підрівні атому р7- або d12-електронів? Чому? Складіть електронну формулу атому елемента з порядковим номером 22 і вкажіть його валентні електрони. 40. Складіть електронні формули атомів елементів з порядковими номерами 32 і 42, з огляду на те, що у останнього відбувається "провал" одного 5s-електрона на 4d-підрівень. До якого електронного сімейства відноситься кожний з цих елементів? ЕНЕРГЕТИКА ХІМІЧНИХ ПРОЦЕСІВ Стандартні теплоти (ентальпії) утворення
41. Обчисліть, яка кількість теплоти виділиться при відновленні Fe2O3 металевим Алюмінієм, якщо було отримано 335,1 г заліза. Відповідь: 2543,1 кДж. 42. Газоподібний етиловий спирт С2Н5ОН можна одержати при взаємодії етилену С2Н4 (г) і водяної пари. Напишіть термохімічне рівняння цієї реакції, обчисливши її тепловий ефект. Відповідь: - 45,76 кДж. 43. Обчисліть тепловий ефект реакції відновлення оксиду заліза (II) воднем, виходячи з наступних термохімічних рівнянь: FeО (т) + СО (г) = Fe (т) + СО2 (г); Δ Н = -13,18 кДж. СО (г) + 1/2 О2 (г) = СО2 (г); Δ Н = -283,0 кДж. Н 2 (г) + 1/2 О2 (г) = Н2О (г); Δ Н = -241,83 кДж. Відповідь: +27,99 кДж. 44. При взаємодії газоподібних сірководню та діоксиду вуглецю утворюються пари води та сірковуглець CS2 (г). Напишіть термохімічне рівняння цієї реакції, обчисливши її тепловий ефект. 45. Напишіть термохімічне рівняння реакції між СО (г) і воднем, у результаті якої утворюються СН 4 (г) і Н2О (г). Скільки теплоти виділиться при цій реакції, якщо було отримано 67,2 л метану в перерахуванні на нормальні умови? Відповідь: 618,48 кДж.
46. Тепловий ефект якої реакції дорівнює теплоті утворення NO? Обчислите теплоту утворення NO, виходячи з наступних термохімічних рівнянь: 4 NH3 (г) + 5 О2 (г) = 4 NO (г) + 6 Н2О (р); Δ Н =-1168,80 кДж. 4 NH3 (г) + 3 О2 (г) = 2 N2 (г) + 6 Н2О (р); Δ Н =1530,28 кДж. Відповідь: 90,37 кДж./моль. 47. Кристалічний хлорид амонію утворюється при взаємодії газоподібних аміаку з хлоридом водню. Напишіть термохімічне рівняння цієї реакції, обчисливши її тепловий ефект. Скільки теплоти виділиться, якщо в реакції було витрачено 10 л аміаку в перерахуванні на нормальні умови? Відповідь: 78,97 кДж. 48. Тепловий ефект якої реакції дорівнює теплоті утворення метану? Обчислите теплоту утворення метану, виходячи з наступних термохімічних рівнянь: Н 2 (г) + 1/2 O2 (г) = Н2О (р); Δ Н = -285,84 кДж. С (т) + О2 (г) = СО2 (г); Δ Н = -393,51 кДж. СН 4 (г) + 2 О2 (г) =2 Н2О (р) + СО2 (г); Δ Н = -890,31 кДж. Відповідь: -74,88 кДж/моль. 49. Тепловий ефект якої реакції дорівнює теплоті утворення гідроксиду кальцію? Обчислите теплоту утворення гідроксиду кальцію, виходячи з наступних термохімічних рівнянь: Са (т) + 1/2 О2 (г) = СаО (т); Δ Н = -635,60 кДж. Н2(г) + 1/2О2(г) = Н2О(р); Δ Н = -285,84 кДж. СаО (т) + Н2О (р) = Са (ОН)2 (т); Δ Н = -65,06 кДж. Відповідь: -986,50 кДж/моль. 50. Тепловий ефект реакції згоряння рідкого бензолу з утворенням пари води та діоксиду вуглецю дорівнює -3135,58 кДж. Складіть термохімічне рівняння цієї реакції та обчисліть теплоту утворення С6Н6 (р). Відповідь: +49,03 кДж/моль. 51. Обчисліть, скільки теплоти виділиться при згорянні 165л (н.у.) ацетилену С2Н2 (г), якщо продуктами згоряння є діоксид вуглецю та пари води? Відповідь: 9248,8 кДж. 52. При згорянні газоподібного аміаку утворюються пари води та оксид азоту. Скільки теплоти виділиться при цій реакції, якщо було отримано 44,8 л NO (г) у перерахуванні на нормальні умови? Відповідь: 452,37 кДж. 53. Реакція горіння метилового спирту виражається термохімічним рівнянням CH3OH (г) + 3/2 О2 (г) = СО2 (г) + 2 Н2О (р); Обчисліть тепловий ефект цієї реакції, якщо відомо, що мольна теплота пароутворення СН3ОН(ж) дорівнює +37,4 кДж. Відповідь: - 726,62 кДж. 54. При згорянні 11,5 г рідкого етилового спирту виділилося 308,71 кДж теплоти. Напишіть термохімічне рівняння реакції, якщо утворюються пари води та діоксид вуглецю. Обчисліть теплоту утворення С2Н5ОН (р). Відповідь: - 277,67 кДж/моль. 55. Реакція горіння бензолу виражається термохімічним С6Н6 (г) + 7 1/2 О2 (г) = 6 СО2 (г) + 3 Н2О (г); Обчисліть тепловий ефект цієї реакції, якщо відомо, що мольна теплота пароутворення бензолу дорівнює +33,9 кДж. Відповідь: - 3135,58 кДж. 56. Обчисліть тепловий ефект і напишіть термохімічне рівняння реакції горіння 1 моль етану С2Н6 (г), якщо утворюються пари води та діоксид вуглецю. Скільки теплоти виділиться при згорянні 1 м3 этана в перерахуванні на нормальні умови? Відповідь: 63742,86 кДж. 57. Реакція горіння аміаку виражається термохімічним 4 NH3 (г) + 3 O2 (г) = 2 N2 (г) + 6 H2O (р); Δ Н = 1530,28 кДж. Обчислите теплоту утворення NH3 (г). Відповідь: - 46,19 кДж/моль. 58. При взаємодії 6,3 г заліза із сіркою виділилося 11,31 кДж теплоти. Обчисліть теплоту утворення сульфіду заліза (П). Відповідь: - 100,26 кДж/моль. 59. При згорянні 1 л ацетилену (н.у.) виділяється 56,053 кДж теплоти. Напишіть термохімічне рівняння реакції, якщо утворюються пари води та діоксид вуглецю. Обчисліть теплоту утворення C2Н2 (г). Відповідь: 226,75 кДж/моль. 60. При одержанні еквівалентної маси гідроксиду кальцію з СаО (т) і Н2О (р) виділяється 32,53 кДж теплоти. Напишіть термохімічне рівняння цієї реакції і обчисліть теплоту утворення оксиду кальцію. Відповідь: - 635,6 кДж/моль. ХІМІЧНА СПОРІДНЕНІСТЬ Стандартна енергія Г і ббса утворення
Стандартні абсолютні ентропії
61. Обчисліть б) РbО 2 (т) + 2 Zn (т) = Рb (т) + 2 ZnО (т) Чи можна одержати фтор по реакції (а) і відновити РbО 2 цинком по реакції (б)? Відповідь: + 313,94 кДж; -417,4 кДж. 62. При якій температурі наступить рівновага системи 4 НС 1 (г) + О2 (г) ↔ 2 Н2О (г) + 2 Сl 2 (г); ΔH = -114,42 кДж? Хлор або кисень у цій системі є більш сильним окиснювачем і при яких температурах? Відповідь: 891 К. 63. Відновлення Fe3O4 оксидом вуглецю йде за рівнянням Fe3O4 (т) + CO (г) = 3 Fe (т) + СО2 (г). Обчисліть Відповідь: +24,19 кДж; +31,34 Дж/·К. 64. Реакція горіння ацетилену йде за рівнянням С2Н2 (г) + 5/2 О2 (г) = 2 СО2 (г) + Н2О (р) Обчисліть 65. Зменшується або збільшується ентропія при переходах: Відповідь: а) 118,78 Дж/·К; б) -3,25 Дж/К. 66. Чим можна пояснити, що за стандартних умов неможлива екзотермічна реакція Н 2 (г) + СО2 (г) = СО (г) + Н2О (р); Δ Н = -2,85кДж? Знаючи тепловий ефект реакції і абсолютні стандартні ентропії відповідних речовин, визначте Відповідь: +19,91 кДж. 67. Пряма або зворотна реакція буде відбуватися за стандартних умов у системі 2 NO (г) + О2 (г) ↔ 2 NО 2 (г) Відповідь мотивуйте, обчисливши Відповідь: -69,70 кДж. 68. Виходячи зі значень стандартних теплот утворення і абсолютних стандартних ентропій відповідних речовин, обчисліть NH3 (г) + HCl (г) = NH4Cl (т) Чи може ця реакція проходити за стандартних умов? Відповідь: -92,08 кДж. 69. При якій температурі наступить рівновага системи СО (г) + 2 Н2 (г) ↔ СН 3 ОН (р); Δ Н = -128,05 кДж? Відповідь: ≈ 385,5 К. 70. При якій температурі наступить рівновага системи СН 4 (г) + СО2 (г) = 2 СО (г) + 2 Н2 (г); Δ Н = +247,37 кДж? Відповідь: ≈ 961,9 К. 71. На підставі стандартних теплот утворення і абсолютних стандартних ентропій відповідних речовин обчисліть 4 NН 3 (г) + 5 O2 (г) = 4 NO (г) + 6 Н2О (г). Чи можлива ця реакція за стандартних умов? Відповідь: - 957,77 кДж. 72. На підставі стандартних теплот утворення і абсолютних стандартних ентропій відповідних речовин обчисліть СО2 (г) + 4 Н2 (г) = СН 4 (г) + 2 Н2О (р) Чи можлива ця реакція за стандартних умов? Відповідь: - 130,89 кДж. 73. Обчисліть Fe2O3 (т) + 3 Н2 (г) = 2 Fe (т) + 3 Н2О (г) Чи можлива реакція відновлення Fе 2 О3 воднем при температурах 500 і 2000 К? Відповідь: + 96,61 кДж; 138,83 Дж/К; 27,2 кДж; – 181,05 кДж. 74. Які з карбонатів у ряду ВеСО 3, СаСО3, ВаСО 3 можна одержати по реакції взаємодії відповідних оксидів з СО2? Яка реакція йде найбільш енергійно? Висновок зробіть, обчисливши Відповідь: + 31,24 кДж; - 130,17 кДж; – 216,02 кДж. 75. На підставі стандартних теплот утворення і абсолютних стандартних ентропій відповідних речовин обчисліть СО (г) + 3 Н2 (г) = СН 4 (г) + Н2О (г) Чи можлива ця реакція за стандартних умов? Відповідь: - 142,16 кДж. 76. Обчисліть ТiО2 (т) + 2 С (т) = Тi (т) + 2 СО (г) Чи можлива реакція відновлення ТiО2 вуглецем при температурах 1000 і 3000 К? Відповідь: + 722,86 кДж; 364,84 Дж/ К; + 358,02 кДж; - 371,66 кДж. 77. На підставі стандартних теплот утворення і абсолютних стандартних ентропій відповідних речовин обчисліть С2Н4 (г) + 3 O2 (г) = 2 СО2 (г) + 2 Н2О (р) Чи можлива ця реакція за стандартних умов? Відповідь: - 1331,21 кДж. 78. Визначте, при якій температурі почнеться реакція відновлення Fе3О4, що проходить за рівнянням Fe3O4 (т) + СО (г) = 3 Fe (т) + СО2 (г); Δ Н = + 34,55 кДж. Відповідь: 1102,4 К. 79. Обчисліть, при якій температурі почнеться дисоціація пентахлориду фосфору, що проходить за рівнянням РСl 5 (г) = РС 13 (г) + С12 (г); Δ Н = + 92,59 кДж. Відповідь: 509 К. 80. Обчисліть зміну ентропії реакцій, що відбуваються за рівняннями: 2 СН 4 (г) = С2Н2 (г) + 3 Н2 (г); N2 (г) + 3 H2 (г) = 2 NH3 (г); С (графіт) + О2 (г) = СО2 (г). Чому в цих реакціях Відповідь: 220,21 Дж/ К; - 198,26 Дж/ К; 2,93 Дж/ К.
ХІМІЧНА КІНЕТИКА ТА РІВНОВАГА 81. Окиснення сірки та її діоксиду проходить за рівняннями: а) S(к) + О2 = SO2(к); б) 2SO2(г) + O2 = 2SO3(г). Як зміняться швидкості цих реакцій, якщо об'єми кожної із систем зменшити в чотири рази? 82. Напишіть вираз константи рівноваги гомогенної системи N2+3Н2↔2NН3. Як зміниться швидкість прямої реакції - утворення амоніаку, якщо збільшити концентрацію водню в три рази? 83. Реакція йде за рівнянням N2 + O2 = 2NO. Концентрації вихідних речовин до початку реакції були: [N2] = 0,049 моль/л; [О2] = 0,01 моль/л. Обчисліть концентрації цих речовин у момент, коли [NO] = 0,005 моль/л. Відповідь: [N2] = 0,0465 моль/л; [О2] = 0,0075 моль/л. 84. Реакція йде за рівнянням N2 + 3H2 = 2NH3. Концентрації речовин, що беруть участь у ній, були: [N2] = 0,80 моль /л; [Н2] = 1,5 моль /л; [NН3] = 0,10 моль/л. Обчисліть концентрацію водню і амоніаку, коли [N2] = 0,5 моль/ л. Відповідь: [NH3] = 0, 70 моль/л; [H2] = 0,60 моль/л. 85. Реакція йде за рівнянням Н2 + I2 = 2НI. Константа швидкості цієї реакції при деякій температурі дорівнює 0,16. Вихідні концентрації реагуючих речовин: [Н2] = 0,04 моль/л; [I2] = 0,05 моль/л. Обчисліть початкову швидкість реакції і її швидкість, коли [Н2] = 0,03 моль/л. 86. Обчисліть, у скільки разів зменшиться швидкість реакції, що проходить в газуватій фазі, якщо знизити температуру з 120 до 800С. Температурний коефіцієнт швидкості реакції дорівнює 3. 87. Як зміниться швидкість реакції, що йде в газуватій фазі, якщо підвищити температуру на 600С. Температурний коефіцієнт швидкості даної реакції дорівнює 2? 88. У гомогенній системі СО + Cl2 ↔ COCl2 рівноважні концентрації реагуючих речовин: [СО] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Обчисліть константу рівноваги системи і вихідні концентрації хлору і СО. Відповідь: K = 20; [Сl2]вих= 1,5 моль/л; [СО]вих= 1,4 моль/л. 89. У гомогенній системі А + 2В ↔ С рівноважні концентрації реагуючих газів: [A] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Обчисліть константу рівноваги системи та вихідні концентрацій речовин А і В. Відповідь: К = 2,5; [А]вих= 0,276 моль/л; [В]вих=0,552 моль/л. 90. У гомогенній газуватій системі А + В ↔ С + D рівновага встановилася за концентраціями: [В] = 0,05 моль/л і [С] = 0,02 моль/л. Константа рівноваги системи дорівнює 0,04. Обчисліть вихідні концентрації речовин А і В. Відповідь: [А]вих= 0,22 моль/л; [В]вих= 0,07 моль/л. 91. Константа швидкості реакції розкладання N2О, що йде за рівнянням 2N2O = 2N2 + О2, дорівнює 5·10-4. Початкова концентрація N2O = 6,0 моль/л. Обчисліть початкову швидкість реакції та її швидкість на час розкладання 50% N2O. Відповідь: 1,8·10-2; 4,5·10-3. 92. Напишіть вираз константи рівноваги гетерогенної системи СО2 + С ↔ 2СО. Як зміниться швидкість прямої реакції - утворення СО, якщо концентрацію СО2 зменшити в чотири рази? Як варто змінити тиск, щоб підвищити вихід СО? 93. Напишіть вираз константи рівноваги гетерогенної системи С + Н2О(г) ↔ СО + Н2. Як варто змінити концентрацію і тиск, щоб змістити рівновагу у бік зворотної реакції - утворення водяної пари? 94. Рівновага гомогенної системи 4HCl(г) + O2 ↔ 2Н2О(г) + 2С12 (г) встановилася за наступними концентраціями реагуючих речовин: [Н2О]P= = 0,14 моль/л; [С12]P = 0,14 моль/л; [НСl]P = 0,20 моль/л; [О2]P = 0,32 моль/л. Обчисліть вихідні концентрації хлороводню і кисню. Відповідь: [НСl]вих =0,48,моль/л; [О2]вих = 0,39 моль/л. 95. Обчисліть константу рівноваги гомогенної системи СО(г) + Н2О(г) ↔ CО2(г) + Н2(г) якщо рівноважні концентрації реагуючих речовин: [СО]Р= 0,004 моль/л; [Н2О]Р = 0,064 моль/л; [СО2]Р = 0,016 моль/л; [Н2]Р = 0,016 моль/л. Чому дорівнюють вихідні концентрації води і СО? Відповідь: К = 1; [Н2О]вих =0,08 моль/л; [СО]вих = 0,02 моль/л. 96. Константа рівноваги гомогенної системи СО(г) + Н2О(г) ↔ СО2 + Н2(г) при деякій температурі дорівнює 1. Обчисліть рівноважні концентрації всіх реагуючих речовин, якщо вихідні концентрації: [СО]вих = 0,10 моль/л; [Н2О]вих= 0,40 моль/л. Відповідь: [СО2]Р = [Н2]Р = 0,08 моль/л; [СО]Р = 0,02 моль/л; [Н2О]Р = 0,32 моль/л. 97. Константа рівноваги гомогенної системи N2 + 3Н2 ↔ 2NН3 при деякій температурі дорівнює 0,1. Рівноважні концентрації водню і амоніаку відповідно дорівнюють 0,2 і 0,08 моль/л. Обчисліть рівноважну і вихідну концентрації азоту. Відповідь: [N2]P = 8 моль/л;[N2]вих =8,04 моль/л. 98. При деякій температурі рівновага гомогенної системи 2NO + О2 ↔ 2NO2 встановилась при наступних концентраціях реагуючих речовин: [NO]Р = 0,2 моль/л; [О2]Р = 0,1 моль/л; [NO2]Р = 0,1 моль/л. Обчисліть константу рівноваги та вихідні концентрації NO і О2. Відповідь: К = 2,5; [NО]вих = 0,3 моль/л; [О2]вих = 0,15 моль/л. 99. Чому при зміні тиску зміщується рівновага системи N2 + 3H2 ↔ 2NH3 і не зміщується рівновага системи N2 + O2 ↔ 2NO? Відповідь мотивуйте на підставі розрахунку швидкості прямої та зворотної реакцій у цих системах до і після зміни тиску. Напишіть вираз констант рівноваги кожної з даних систем. 100. Вихідні концентрації [NО]вих і [Сl2]вих у гомогенній системі 2NO + Cl2 ↔ 2NOCl становлять відповідно 0,5 й 0,2 моль/л. Обчисліть константу рівноваги, якщо на час встановлення рівноваги прореагувало 20% NO. Відповідь: 0,416. СПОСОБИ ВИРАЖЕННЯ КОНЦЕНТРАЦІЇ РОЗЧИНУ 101. Обчисліть молярну і еквівалентну концентрації 20%-ного розчину Кальція хлориду, якщо його густина 1,178 г/см3. Відповідь: 2,1 М; 4,2 н. 102. Чому дорівнює нормальність 30%-ного розчину NaOH густиною 1,328 г/см3? До 1 л цього розчину додали 5 л води. Обчисліть відсоткову концентрацію отриманого розчину. Відповідь: 9,96 н.; 6,3%. 103. До 3 л 10%-ного розчину HNO3 густиною 1,054 г/см3 додали 5 л 2%-ного розчину тієї ж кислоти густиною 1,009 г/см3. Обчисліть відсоткову і молярну концентрації отриманого розчину, об'єм якого дорівнює 8 л. Відповідь: 5,0%; 0,82 М. 104. Обчисліть еквівалентну і моляльну концентрації 20,8%-ного розчину HNO3 густиною 1,12 г/см3. Скільки грамів кислоти міститься у 4 л цих розчинів? Відповідь: 3,70 н.; 4,17 г; 931,8 г. 105. Обчисліть молярну, еквівалентну і моляльну концентрації 16%-ного розчину Алюмінія хлориду густиною 1,149 г/см3. Відповідь: 1,38 М; 4,14 н.; 1,43 м. 106. Скільки і якої речовини залишиться в надлишку, якщо до 75 см3 0,3 н. розчину H2SO4 додати 125 см3 0,2 н. розчину КОН? Відповідь: 0,14 г КОН. 107. Щоб осадити у вигляді AgCl все срібло, що міститься в 100 см3 розчину AgNO3, треба було 50 см3 0,2 н. розчину HCl. Яка нормальність розчину AgNO3? Яка маса AgCl випала в осад? Відповідь: 0,1 н.; 1,433 г. 108. Який об'єм 20,01%-ного розчину HCl (густ. 1,100 г/см3) потрібно для приготування 1л 10,17%-ного розчину (густ. 1,050 г/см3)? Відповідь: 485,38 см3. 109. Змішали 10 см3 10%-ного розчину HNO3 (густ. 1,056 г/см3) і 100 см3 30%-ного розчину HNO3 (густ. 1,184 г/см3). Обчисліть відсоткову концентрацію отриманого розчину. Відповідь: 28,38%.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 141; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.183.117 (0.204 с.) |
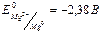 .
.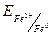 , користуючись рівнянням Нернсту (1):
, користуючись рівнянням Нернсту (1):
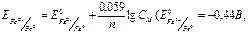
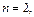 CM=10-2 M)
CM=10-2 M)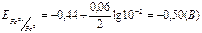
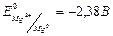 ,
, 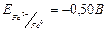 , тому магнієвий електрод буде анодом (А), а залізний – катодом (К).
, тому магнієвий електрод буде анодом (А), а залізний – катодом (К). -2,38 1 M 0,01 M -0,50
-2,38 1 M 0,01 M -0,50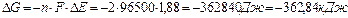
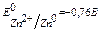 ), (К) – Fe (
), (К) – Fe (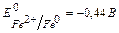 ).
). електронне напіврівнення анодного процесу: Zn0 - 2ē → Zn2+ 2 +
електронне напіврівнення анодного процесу: Zn0 - 2ē → Zn2+ 2 + ).
). електронне напіврівнення анодного процесу: Fe0 - 2ē → Fe2+ 1
електронне напіврівнення анодного процесу: Fe0 - 2ē → Fe2+ 1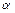 частинками ядер атомів заліза- 54. Складіть рівняння цієї ядерної реакції та напишіть його в скороченій формі.
частинками ядер атомів заліза- 54. Складіть рівняння цієї ядерної реакції та напишіть його в скороченій формі. ,
, 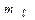 й S, що характеризують стан електронів в атомі? Які значення вони приймають для зовнішніх електронів атому Магнію?
й S, що характеризують стан електронів в атомі? Які значення вони приймають для зовнішніх електронів атому Магнію?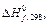 деяких речовин
деяких речовин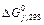 деяких речовин
деяких речовин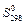 деяких речовин
деяких речовин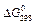 для наступних реакцій (
для наступних реакцій (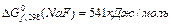 ): а) 2NaF(т) + С12 (г) = 2 NaCl (т) + F2 (г)
): а) 2NaF(т) + С12 (г) = 2 NaCl (т) + F2 (г) в цьому процесі?
в цьому процесі?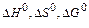 реакції, що проходить за рівнянням
реакції, що проходить за рівнянням


