Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молярні маси еквівалентів складних речовин можна визначати.
Для оксиду: 1-й засіб: МЕ(Al2O3) = де n – число атомів елемента в молекулі; В – його валентність. МЕ (Al2O3) = 102/2∙ 3 = 17 г/моль.
2-й засіб: МЕ(Al2O3)=МЕ(O
Для основи: 1-й засіб: МЕ (Са(ОН)2 ) = де кислотність основи – це число (ОН 2-й засіб: МЕ(Са(ОН)2)=МЕ(Са2+)+МЕ(ОН
Для кислоти: 1-й засіб: МЕ (H3PO4) = де основність кислоти – це число катіонів Н+ у молекулі кислоти, що вступили в реакцію. 2-й засіб: МЕ (Н3РО4) = МЕ (Н+) + МЕ (РО4
Для солі: 1 засіб: МЕ (Са3(РО4)2 ) = МЕ (Nа HCO3) = МЕ (A1 (OH)C12) = де В – валентність металу або заряд катіона для основної солі. n – число атомів металу в молекулі солі. 2-й засіб: МЕ (Са3(РО4)2 ) = МЕ (Са+2) + МЕ (РО4 МЕ(NaHCO3) = МЕ (Na+) + МЕ (HCO3 МЕ (А1ОНС12) = МЕ (А1ОН2+) + МЕ (С1 Визначення молярної маси еквівалентів складних речовин за рівняннями хімічних реакцій. Для кислот: а) H3PO4 + 2NaOH = Na2HPO4 + 2H2O; б) H3PO4 + 3NaOH = Na3PO4 + 3H2O. У реакції «а» заміщено два йони гідрогену кислоти, а в реакції «б» – три. Отже, основність кислоти в першому випадку дорівнює двом, а в другому випадку – трьом: а) МЕ (Н3РО4) = б) МЕ (Н3РО4) = Для основ: а) А1 (ОН)3 + НС1 → А1(ОН)2С1 + Н2О, кислотність основи дорівнює 1; б) А1(ОН)3 + 2НС1 → А1ОНС12 + 2Н2О, кислотність основи дорівнює 2; а ) МЕ (А1(ОН)3) = б) МЕ (А1(ОН)3) = Визначення молярної маси еквівалентів речовин за рівняннями окисно-відновних реакцій: 2KMnО4 + 5SnCl2 + 16HCl = 5SnCl4 + 2MnCl2 + 2KCl + 8H2O
10 окисник Mn+7 + 5ē → Mn+ 2 2 відновлюється. Молярна маса еквівалента окисника дорівнює співвідношенню молярної маси окисника (M(KMnО4)) до кількості прийнятих електронів. МЕ(KMnО4) = Молярна маса еквівалента відновника дорівнює співвідношенню молярної маси відновника (M(SnCl2)) до кількості відданих електронів. МЕ (SnCl2) = Закон еквівалентних співвідносин: маси реагуючих речовин: m(A) і m(B) співвідносяться між собою як молярні маси їх еквівалентів: МЕ (А) і МЕ (В).
Математичні вирази цього закону:
Розглянемо приклади розв’язання задач Задача 1. Враховуючи молярну масу еквівалента металу в оксиді, що містить 52% металу. Назвіть цей метал (Ме), якщо його валентність становить шість у даному оксиді. Складіть формулу оксиду. Розв ’язок: 100 – 52 = 48% Оксигену в оксиді, а молярна маса еквіваленту Оксигену дорівнює 8 г/моль. За законом еквівалентних відносин (за формулою (12)) записуємо вираз:
За формулою (1) М (Me) = MЕ (Ме)∙ В = 8,66∙ 6 = 52 г/моль. Шестивалентним металом з атомною масою 52 а.о.м. є Хром. Його оксид – CrО3. Задача 2. На відновлення 7,09 г оксиду металу потрібно 2,24 л водню (н.у.). Знайти молярну масу еквівалента металу і його оксиду. Розв ’язок: на підставі закону еквівалентних відносин записуємо вираз:
За формулою (3) MЕ (Ме xОy) = MЕ (Ме) +MЕ (О); (МЕ (О)=8 г/моль), тоді MЕ (Ме) = 35,45 – 8 = 27,45 г/моль. Задача 3. З 3,85 г нітрату металу Me(NO3)x отримано 1,60 г його гідроксиду Me(OH)x. Знайти еквівалентну масу металу. Розв ’язок: на підставі закону еквівалентних відносин (за формулою (12)) записуємо вираз.
Задача 4. При взаємодії 3,24 г тривалентного металу з кислотою виділяється 4,03 л Н2 (н.у.). Обчисліть молярну масу еквівалента і молярну масу металу. Назвіть метал. Розв ’язок: використовуючи закон еквівалентних відносин (за формулою (12)), запишемо вираз:
За формулою (1)
Метал – Aлюміній. Знання закону еквівалентних відносин необхідне для: 1. Хімічних розрахунків та ідентифікації речовин. 2. Визначення молярної концентрації еквівалентів речовини в розчині і використання отриманих розрахунків в об'ємному аналізі. Молярна концентрація еквівалентів речовини (нормальність) показує, скільки молярних мас еквівалентів речовини міститься в 1 л розчину. СН = N = Наприклад: 1 н розчин НС1 → у 1 л розчину містить 1 молярну масу еквівалента МЕ(HCl) = 36,5 г/моль, тобто 36,5 г. 0,1 н розчин НС1 → у 1 л розчину містить 0,1 молярної маси еквівалента HCl - 3,65 г/моль. 0,01 н розчин НС1 → у 1 л розчину містить 0,01 молярної маси еквівалента HCl - 0,365 г/моль. Задача 5. Визначити нормальність розчину NaOH, якщо на титрування 10 моль його витрачається 8,2 моль 0,1 н розчину НС1.
Розв’язок:Використовуючи математичний вираз закону еквівалентних відносин в об'ємному аналізі: N1∙V1 = N2∙V2, записуємо вираз: N(NaOH) ∙V(NaOH)= N(HCl)∙ V(HCl) N(NaOH)= Відповідь: розчин NaOH 0,082 – нормальний, тобто містить 0,082 молярної маси еквівалента NaOH на один літр розчину (моль/л). 3.Визначення твердості води. Твердість води Т(Н2О) показує кількість міліеквівалентів (ме) розчинних солей кальцію і магнію, що містяться в одному літрі води (ме/л).
Задача 6. Чому дорівнює твердість води, у 100 л якої міститься 14,63 г Mg (HCO3)2? Розв ’язок: для рішення задачі використовуємо формулу для визначення твердісті води:
4. Для розрахунків в електрохімії:
де m – маса речовини (г), V – об’єм речовини (л); I – сила струму, А; t – час, с. F = 96500 Кл/моль (F = 26,8 А∙ год./моль) (Кл = Кулон); Q – кількість електрики (А. с; А. год.).
Питання для самоконтролю
1.Що є сталим в хімічних реакціях та які закони це відображують? 2.Сформулюйте закон Авогадро. Які висновки із закону Авогадро? 3. Що таке еквівалент? 4.Які існують форми математичного виразу закону еквівалентних відносин? 5. Де застосовують закон еквівалентних відносин?
Р о з д і л 2 КВАНТОВОМЕХАНІЧНЕ УЯВЛЕННЯ ПРО БУДОВУ АТОМА. ПРАВИЛА І ПОРЯДОК ЗАПОВНЕННЯ АТОМНИХ ОРБІТАЛЕЙ § 2.1. ТЕОРІЇ З БУДОВИ АТОМА
Наукові основи атомно-молекулярного вчення були закладені в роботах російського вченого М.В.Ломоносова, французьких хіміків Лавуазьє і Пруста, англійського хіміка Дальтона і т.д. Однак до початку двадцятого століття атом вважався єдиним і неподільним. Лише тільки серія відкриттів 1896 – 1898 р. природної радіоактивності Анрі Беккерелем (1896 р. – радіоактивність урану), Марією Склодовською-Кюрі і Пьєром Кюрі дозволила змінити уявлення про неподільність атома. Атом – це електронейтральна мікросистема, що складається з позитивно зарядженого ядра і негативно заряджених електронів. Ядра атомів складаються з нуклонів: (протонів ( Маса ядра менша за суму мас протонів і нейтронів. Ця різниця називається дефектом маси. Він характеризує стійкість атомних ядер і енергію зв'язку нуклонів у ядрі (7.106 еВ), що у мільйони разів перевищує енергію зв'язку атомів у молекулі (5 еВ). Тому за хімічних реакцій ядра атомів не змінюються. Таблиця 1 Система СІ |
Система атомних одиниць | |||||||||
|
Найменування частинки | Абсолютна маса, кг | Електричний заряд, Кл | Відносна маса, а.о.м. | Відносний заряд, а.о.з. | |||||||
| Електрон | 9,109•10-31 | 1,602•10-19 | 0,0005486 | -1 | |||||||
| Нук- Лони | Протон 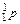
| 1,673•10-27 | 1,602•10-19 | 1,007277 | +1 | ||||||
Нейтрон 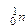
| 1,673•10-27 | 0 | 1,008695 | 0 | |||||||
Сукупність атомів з однаковим зарядом ядра, з певною атомною масою, називається хімічним елементом.
Кожен хімічний елемент має кілька ізотопів.
Атоми з однаковим зарядом ядра, але різними масовими числами називають ізотопами.
Крім ізотопів існують ізотони й ізобари.
Ізотони – це атоми з однаковим числом нейтронів 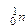 , але різною
, але різною
кількістю 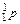 (тобто з різним зарядом ядра).
(тобто з різним зарядом ядра).
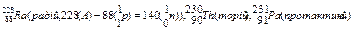 (
(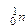 =140).
=140).
Таблиця 2
| Ізотопи гідрогену | Назва ізотопу | 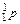
| 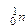
| Масове число (А) |
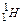 - протон - протон
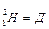 -дейтерій -дейтерій
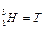 - тритій - тритій
| 1 1 1 | 0 1 2 | 1 2 3 | |
| Ізотопи карбону | 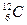 карбон-12 карбон-12
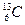 карбон -13 карбон -13
 карбон -14 карбон -14
| 6 6 6 | 6 7 8 | 12 13 14 |
|
|
Ізобари – це атоми з однаковими масовими числами, але різними атомними номерами, наприклад:
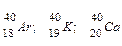 .
.
У період відкриття перших трьох фундаментальних частинок (е; 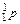 ;
; 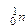 ) був висунутий цілий ряд моделей будови атома.
) був висунутий цілий ряд моделей будови атома.
 |
1. 1903 р. Модель Д.Томсона, В. Томсона (модель «пудінгу з родзинками»), відповідно до якої в позитивно заряджену сферу атома вкраплені електрони:
Рис. 1
2. 1911 р. Е. Резерфорд у результаті знаменитих експериментів з розсіювання золотою фольгою α - частинок установив, що атом:
- має досить масивне позитивно заряджене ядро з дуже малими розмірами, оточене електронами;
- атом електронейтральний, тобто позитивний заряд ядра чисельно дорівнює негативному сумарному заряду електронів, що оточують це ядро;
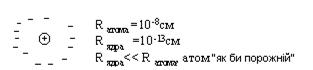
Рис. 2
Відповідно до законів класичної механіки і електродинаміки, імовірність знаходження електрона навколо ядра повинна супроводжуватися електромагнітним випромінюванням з безупинним спектром, що суперечило відомим з 1880 р. лінійчатим спектрам газів і пару елементів. Протиріччя розв’язав учень Резерфорда Нільс Бор.
3. У 1913 р. Н. Бор розробив планетарну модель атома Гідрогена, що використовується і у наш час. Подібно Резерфорду, Бор уявляв собі атом у вигляді позитивно зарядженого ядра, оточеного електронами. Він розрахував радіуси можливих орбіт для атома Гідрогена (R1=53пм, R2=212пм, R3=477пм, R4=848пм). Цим орбітам відповідають різні енергії. Переходячи з однієї орбіти на іншу, електрони можуть здобувати або втрачати енергію. Н. Бору вдалося пояснити і розрахувати теоретично лінійчаті спектри випромінювання атомів гідрогену, а також серії ліній у рентгенівських спектрах елементів.
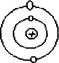
Рис. 3
4. У 1924 р. Луі де Бройль показав, що елементарна частинка, яка рухається з визначеною швидкістю, може розглядатися не тільки як частинка, що володіє масою спокою, але і як хвиля з визначеною частотою коливань (n), задовольняючи умові рівності енергій:
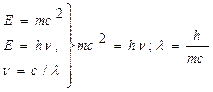 ,
,
де h =6,626 . 10 –34 Дж. с (постійна Планка);
с =3.10 8 м/с (швидкість світла);
λ=h/mc (взаємозв'язок довжини хвилі (λ) і маси частинки (m)).
Результатом робіт де Бройля, Дірака, Гейзенберга, Шредінгера та інших було створення нової фізичної теорії – КВАНТОВОЇ МЕХАНІКИ, яка заявила про корпускулярно-хвильовий дуалізм мікрочастинок (наприклад, електрон має масу спокою 9,109• 10-31 кг., виявляючи властивості частинки, а в досвідах по дифракції він виявляє властивості хвилі). У квантовій механіці класичне поняття «траєкторія» заміняється поняттям «хвильова функція ψ» чи «атомна орбіталь (АО)».
|
|
§ 2.2. КВАНТОВІ ЧИСЛА
АО – це область біля ядерного простору, де електрон може знаходитися з досить високим ступенем імовірності. Термін „орбіталь” співзвучний терміну „орбіта”, однак зміст їх різний. Орбіта - це траєкторія руху, атомна орбіталь – хвильова функція. Якщо хвильова функція (ψ) частинки відома, можна розрахувати імовірність (ψ2 ) перебування частинки в різних областях простору.
У 1925 р. Ервін Шредінгер запропонував рівняння, що дозволяє математично описувати хвильові функції часток.
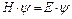 -
-
де Н – гамільтоніан 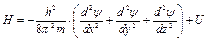
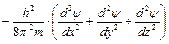 – оператор кінетичної енергії,
– оператор кінетичної енергії,
U - оператор потенційної енергії.
Це диференційне лінійне рівняння другого порядку в окремих похідних має нескінченну безліч рішень. З них інтерес представляють лише такі значення, для яких знайдені значення ψ2 (густина імовірності) не суперечать фізичним уявленням. Такими є квантові числа n,  ,
, 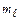 , S.
, S.
n –головне квантове число приймає позитивні цілі значення від 1 до ¥ (n =1...7...…), (дивись табл.3). Воно характеризує енергетичний стан електрона в атомі, тобто енергію електрона на певному енергетичному рівні.Номер періоду елемента в періодичній системі Д.І.Менделєєва співпадає з числом енергетичних рівнів у атомі. Зі збільшенням значення головного квантового числа n - енергія АО збільшується. При n =1 енергія мінімальна, електрон знаходиться в найбільш стійкому з усіх стаціонарному стані.
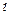 -орбітальне квантове число набуває всіх числових значень від 0 до
-орбітальне квантове число набуває всіх числових значень від 0 до
(n -1).
Воно характеризує:
- енергію електрона на енергетичному підрівні (підоболонці);
- вказує на кількість підрівнів на рівні.
Наприклад: для n =1 орбітальне квантове число-  має тільки одне значення «нуль» (
має тільки одне значення «нуль» ( =0). Це означає що на першому рівні (n =1) є тільки один підрівень (дивись табл.3).
=0). Це означає що на першому рівні (n =1) є тільки один підрівень (дивись табл.3).
- форму атомної орбиталі ( = 0, відповідає s - підрівень, сферична форма атомної орбіталі;
= 0, відповідає s - підрівень, сферична форма атомної орбіталі;  = 1, відповідає р - підрівень, форма атомної орбіталі нагадує гантель;
= 1, відповідає р - підрівень, форма атомної орбіталі нагадує гантель;  = 2, відповідає d- підрівень, форма атомної орбіталі являє собою «чотирипелюсткову» фігуру (дивись табл.4).
= 2, відповідає d- підрівень, форма атомної орбіталі являє собою «чотирипелюсткову» фігуру (дивись табл.4).
Таблиця 3
| Оболонка, енергетичний рівень | K | L | M | N | ||||||
| N | 1 | 2 | 3 | 4 | ||||||

| 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 |
| Підоболонка(підрівень) | s | s | p | s | p | d | s | p | d | f |
| Макс. кількість електронів на оболонці (2 n 2) | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 |
| 2 | 8 | 18 | 32 | |||||||
Буквені символи s; p; d; f були введені у 1890 р. при описуванні спектра лужних металів: 0-s (sharp-різкий); 1-p (principal-головний); 2-d (diffuse-дифузійний); 3-f (fundamental-фундаментальний). Кожна буква відповідає за певну геометрію АО.
Таблиця 4
Числові значення 
| Буквені позначення форми АО | форма АО | Геометрія АО |
| 0 | s | сферична |  
|
| 1 | p | гантелеподібна | 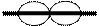
|
| 2 | d | чотирьохпелюсткова | 
|
| 3 | f | шестипелюсткова | 
|
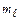 – магнітне квантове число набуває всіх послідовних цілочислових значень від [-
– магнітне квантове число набуває всіх послідовних цілочислових значень від [-  …0…+
…0…+  ].
].
|
|
Воно визначає орієнтацію атомної орбіталі в просторі.
У відсутності зовнішнього магнітного поля електрони на орбіталях з однаковим значенням орбітального квантового числа ( ) енергетично рівноцінні. Однак у постійному магнітному полі деякі спектральні лінії розщеплюються. Це означає, що електрони стають енергетично нерівноцінними. Наприклад, стану р - електронів у магнітному полі відповідають три значення
) енергетично рівноцінні. Однак у постійному магнітному полі деякі спектральні лінії розщеплюються. Це означає, що електрони стають енергетично нерівноцінними. Наприклад, стану р - електронів у магнітному полі відповідають три значення 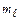 (рх, рy, pz), тобто існує три можливих розміщення електронної хмари цього типу в просторі. Стану d - електронів у магнітному полі відповідають 5 значень магнітного квантового числа, тобто існує 5 можливих розміщень електронної хмари цього типу в просторі (дивись табл.5) і т.д.
(рх, рy, pz), тобто існує три можливих розміщення електронної хмари цього типу в просторі. Стану d - електронів у магнітному полі відповідають 5 значень магнітного квантового числа, тобто існує 5 можливих розміщень електронної хмари цього типу в просторі (дивись табл.5) і т.д.
S - cпінове квантове число має тільки два значення: +1/2(рух електрона за годинниковою стрілкою); -1/2 (проти). Характеризує власний момент обертання електрона навколо своєї осі;
Таблиця 5

| Під-оболонка (АО) | 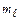
| Кількість орбіталей
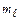 =
2 =
2  +1 +1
| Графічне зображення кількості вільних орбіталей | Максимальна кількість електронів на атомній орбіта лі |
| 0 | s | 0 | 1 | o | 2 |
| 1 | p | - 1 0 +1 | 3 | ooo | 6 |
| 2 | d | - 2 - 1 0 +1 +2 | 5 | ooooo | 10 |
| 3 | f | -3 -2 -1 0 +1 +2 +3 | 7 | ooooooo | 14 |
Голландські фізики Уленбек і Гоудсміт відкрили спін електрона в 1925 р. Спін – це не просте обертання електрона, як «вовчка», а складне фізичне явище. Дірак у 1928 р. показав наявність паралельних () і антипаралельних (¯) спінів.
§ 2.3. ПРИНЦИПИ ЗАПОВНЕННЯ АТОМНИХ ОРБІТАЛЕЙ
Для визначення стану електрона в атомі важливе значення мають: принцип мінімуму енергії, що визначає заповнення АО з найменшою енергією: (1s<2s<2p<3s<3р<4s»3d<4p<5s»4d<5p<6s»4f»5d<6p<7s); принцип Паулі, що диктує присутність на АО не більше 2-х електронів із протилежно спрямованими спинами, і правило Хунда, що показує заповнення АО електронами так, щоб їх сумарний спін був максимальним.
Принцип Паулі.
В атомі не може бути двох електронів, у яких усі чотири квантових числа були б однакові (1925 р).
Спробуємо «створити» електронні оболонки атомів, користуючись принципом Паулі. Мінімальне значення головного квантового числа n дорівнює 1. Йому відповідає тільки одне значення орбітального квантовогочисла  , що дорівнює нулю (s -орбіталь).Сферична симетрія s-орбіталей виражається у тому, що при
, що дорівнює нулю (s -орбіталь).Сферична симетрія s-орбіталей виражається у тому, що при  =0 у магнітному полі існує тільки одна орбіталь з
=0 у магнітному полі існує тільки одна орбіталь з 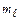 = 0. На цій орбіталі може знаходитися один електрон з будь-яким значенням спіна (наприклад, електронна формула Гідрогену: 1s1) чи два
= 0. На цій орбіталі може знаходитися один електрон з будь-яким значенням спіна (наприклад, електронна формула Гідрогену: 1s1) чи два 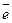 з протилежним значенням спінів (наприклад, електронна формула Гелію: 1s2). Таким чином, при значенні n =1 може існувати на першому енергетичному рівні не більше двох електронів.
з протилежним значенням спінів (наприклад, електронна формула Гелію: 1s2). Таким чином, при значенні n =1 може існувати на першому енергетичному рівні не більше двох електронів.
Тепер почнемо заповнювати орбіталі з n =2 (на першому рівні вже є два електрони). Величині n =2 відповідають два значення орбітального числа: 0 (s- орбіталь) і 1 (р - орбіталь). При  =0 існує одна орбіталь, при
=0 існує одна орбіталь, при  =1 – три орбіталі (зі значеннями
=1 – три орбіталі (зі значеннями 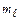 :-1, 0, +1). На кожній з орбіталей може знаходитися не більше двох електронів, так що значенню n =2 відповідає максимум 8 електронів. Загальне число електронів на рівні із заданим n можна обчислити, таким чином, за формулою 2 n ² (див. табл. 3,4).
:-1, 0, +1). На кожній з орбіталей може знаходитися не більше двох електронів, так що значенню n =2 відповідає максимум 8 електронів. Загальне число електронів на рівні із заданим n можна обчислити, таким чином, за формулою 2 n ² (див. табл. 3,4).
Правило Хунда.
Стійкому стану атома відповідає такий розподіл електронів у межах енергетичного підрівня, за якого абсолютне значення сумарного спіна атома | S | максимальне. Стійкий стан атома – це стан з максимальним числом неспарених електронів. Наприклад: електронна будова атома карбону 6 С 1s²2s²2p² може бути описана різними варіантами електронно-графічних формул.
Заборонено:
| а)2р | ↑↓ | | S |=0 | б)2р | ↑ | ↓ | | S |=0 |
Дозволено:
| в)2р | ↑ | ↑ | | S |=1 |
Стан в) – більш стійкий, тому що абсолютне значення його сумарного спіна | S | максимальне.
Конкретна реалізація принципу мінімуму енергії відображується правилами Клечковського. Послідовність заповнення атомних орбіталей у залежності від значень n і  була сформульована радянським вченим Клечковським.
була сформульована радянським вченим Клечковським.
Перше правило Клечковського.
При збільшенні заряду ядра атома послідовне заповнення електронних орбіталей походить від орбіталей з меншим значенням суми (n +  ) до орбіталей з більшим значенням цієї суми.
) до орбіталей з більшим значенням цієї суми.
Наприклад, атом калію, електронна формула якого 1s2 2s2 p6 3s2p6d04s1, на третьому енергетичному рівні має тільки вісім електронів з 18-ти можливих. Чому електрон заповнює 4s, а не 3d – підрівень? Розрахувавшидля атома калію за правилом Клечковського суму (n +  ) для 3d(3+2=5) і 4s(4+0=4) підрівней, робимо висновок, що, у першу чергу, повинен заповнюватися 4s, а потім 3d-підрівень.
) для 3d(3+2=5) і 4s(4+0=4) підрівней, робимо висновок, що, у першу чергу, повинен заповнюватися 4s, а потім 3d-підрівень.
Друге правило Клечковського.
Якщо в орбіталях сума головного квантового числа та орбітального квантового числа (n+  ) однакова, то заповнюється в першу чергу орбіталь з меншим значенням головного квантового числа n.
) однакова, то заповнюється в першу чергу орбіталь з меншим значенням головного квантового числа n.
При заповненні електронних орбіталей атома Скандію електронна формула якого 1s22s2p63s2p6d14s2, електрон заповнює 3d(3+2=5), а не 4р(4+1=5)- підрівень у відповідності з другим правилом Клечковського.
У деяких атомів спостерігається явище «електронного проскакування», як, наприклад, в атому хрому: Cr 3d44s2→3d54s1 чи в атому міді: Cu 3d94s2→3d104s1. Це обумовлено підвищеною енергетичною стійкістю електронних конфігурацій з цілком (атом Сu) чи наполовину заповненим підрівнем (атом Cr).
Питання для самоконтролю
1. Наведіть теорії з будови атома.
2. Які квантові числа ви знаєте, їх фізичний зміст?
3. За якими правилами відбувається заповнення електронами атомних
орбіталей?
4. Які значення магнітного квантового числа відповідають
орбітальному квантовому числу  = 1?
= 1?
5. Яке максимальне число електронів відповідає підрівню з  = 1?
= 1?
Чому?
6. Чому на 3-му енергетичному рівні не може бути більше 18
електронів? Покажіть це, виходячи з комбінації квантових чисел.
7. Який енергетичний підрівень буде першим заповнюватись
електронами: 3d або 4s?
8. Який енергетичний підрівень буде першим заповнюватись
електронами: 3d або 4р?
9. Розрахуйте сумарний спін для Mn +2.
10. Який стан більш стійкий Fe +2 або Fe +3?
11. Напишіть електронні формули (розподіл електронів за рівнями та
підрівнями) для: 25 Mn 0, Mn +4, Mn +6.
Р о з д і л 3
ПЕРІОДИЧНИЙ ЗАКОН Д.І. МЕНДЕЛЄЄВА. ЗАКОНОМІРНОСТІ ПЕРІОДИЧНОЇ СИСТЕМИ
§ 3.1. ПЕРІОДИЧНИЙ ЗАКОН Д.І.МЕНДЕЛЄЄВА
Періодичний закон був сформульований 1 березня 1869 року великим російським вченим Дмитром Івановичем Менделєєвим.
Періодичний закон у інтерпретації Д.І.Менделєєва:
властивості простих тіл, а також форми і властивості їх сполук перебувають у періодичній залежності від величини атомної ваги елементів.
Сучасне формулювання періодичного закону:
властивості простих тіл, а також форми і властивості їх сполук перебувають у періодичній залежності від величини зарядів їх атомних ядер.
Періодична система елементів є графічним відображенням періодичного закону. Відомо кілька сотень форм періодичної системи, однак в Україні частіше використовується короткоперіодний варіант періодичної системи. Періодична система складається з періодів і груп.
Період – це горизонтальний ряд елементів, розташованих у порядку зростання їх порядкового номера (у порядку зростання зарядів ядер їх атомів).
Кожен період (окрім першого) починається активним лужним металом і закінчується інертним газом, перед яким стоїть активний неметал (галоген), тобто в періодах зліва направо металеві властивості елементів зменшуються, а неметалеві зростають. Це пов’язано з поступовим збільшенням числа електронів на валентному енергетичному рівні та зменшенням радіусів їхніх атомів. Розрізняють: малі (1;2;3) і великі (4;5;6;7) періоди. У періодах відбувається заповнення електронами зовнішньої (n) електронної оболонки атомів, а також незаповнених передзовнішних (n -1) і (n -2) оболонок. Номер періоду в періодичній системі Д.І.Менделєєва співпадає з числом енергетичних рівнів у атомі і збігається зі значенням головного квантового числа (n) зовнішнього енергетичного рівня.
Групи – це вертикальний ряд елементів, що володіють однотиповою електронною будовою. Відповідно до максимального числа електронів на зовнішньому електронному шарі незбуджених атомів елементи періодичної системи підрозділяються на вісім груп. У групі виділяють головну (А) (до неї входять s- і р - елементи малих і великих періодів) і побічну (В) підгрупи (до неї входять d-, f- елементи тільки великих періодів).
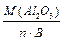 , (2)
, (2)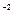 ) + МЕ(Al+3)=16/2 + 27/3 =17г/моль (3)
) + МЕ(Al+3)=16/2 + 27/3 =17г/моль (3)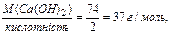 (4)
(4) )-груп у молекулі основи, що вступили в реакцію.
)-груп у молекулі основи, що вступили в реакцію. )=40/2+17= 37г/моль (5)
)=40/2+17= 37г/моль (5)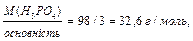 (6)
(6)
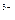 ) = 1+ 95/3 = 1+ 31,6 = 32,6 г/моль. (7)
) = 1+ 95/3 = 1+ 31,6 = 32,6 г/моль. (7)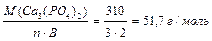 (8)
(8)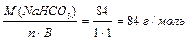
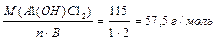 ,
,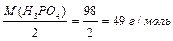 ;
;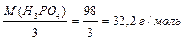 .
. 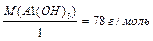 ;
;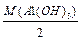 = 78/2 = 39 г/моль.
= 78/2 = 39 г/моль.
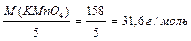 . (10)
. (10)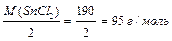 . (11)
. (11)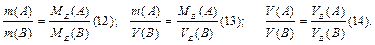
 ;
;
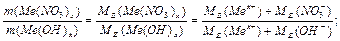
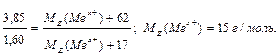
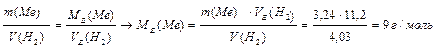 .
.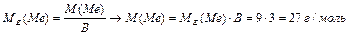 .
.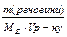 моль /л (н).
моль /л (н). .
.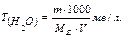
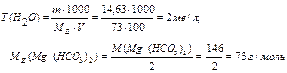
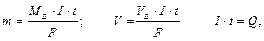
 ) і нейтронів (
) і нейтронів (