
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изучить предложенный лекционный материал по новым темам.Стр 1 из 12Следующая ⇒
Изучить предложенный лекционный материал по новым темам. 2 Выполнить задания в темах ОВР, Гидролиз,Растворы, Металлы и неметаллы.(5 заданий) Фото ответов выложить в Вк на странице преподавателя. Срок сдачи работ: к следующему по расписанию занятию. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Введение
Окислительно-восстановительные реакции играют большую роль в жизни нашей планеты. Большинство химических реакций и процессов, протекающих в природе и осуществляемых человеком в его практической деятельности, представляют собой окислительно-восстановительные реакции. В качестве примера можно привести следующие процессы: дыхание, горение, выброс вулкана, фотосинтез растений, круговорот веществ в природе, электролиз, получение металлов из руд, гниение, брожение, обмен веществ в живом организме, синтез аммиака и многие другие. Окислительно-восстановительные реакции имеют очень большое промышленное значение. Вся металлургическая промышленность основана на окислительно-восстановительных процессах, в ходе которых металлы выделяются из природных соединений. Поэтому, при подготовке и проведении открытого урока, большое внимание было уделено практическому значению окислительно-восстановительных реакций. Целью представленной работы является дать общие сведения о ОВР, об их практическом значении, научить грамотному использованию металлических изделий.
Цели занятия · дидактическая: формирование у обучающихся знаний о процессах ОВР, об их практическом значении; умений составлять уравнения окислительно-восстановительных реакций. Задачи: 1.Обучить студентов определять значение степени окисления химических элементов, показывать электронные переходы в ОВР; 2.Расширить и закрепить навыки составления электронного баланса и расстановки коэффициентов в уравнениях окислительно-восстановительных реакциях 3. Научить грамотному использованию металлических изделий. · развивающая: формирование информационно-технологической компетенции Задачи: 1. Развивать учебно-информационные способности: умение извлекать информацию из устного сообщения, справочных таблиц, наблюдаемых процессов; 2. Развивать учебно-логические способности: умение анализировать, выявлять сущность наблюдаемых процессов, обобщать и делать выводы, формулировать определения понятий;
3. Развивать навыки самооценки знаний и умений. · воспитательная: формирование компетенции социального взаимодействия и готовности к решению проблем Задачи: 1. Воспитывать способность формулировать и аргументировать собственное мнение. 2. Продолжить формирование убеждения обучающихся в необходимости изучения химии для понимания и описания процессов, происходящих в окружающем мире.
Вид занятия комбинированный Методы обучения Репродуктивный, частично-поисковый Приемы обучения рассказ, объяснение, проблемная ситуация, пример, упражнение, обобщение, самостоятельная работа. Форма обучения индивидуальная Средства обучения Учебно-наглядные: справочные таблицы «Периодическая система химических элементов Д.И.Менделеева», «Растворимость оснований, кислот, солей в воде», электрохимический ряд напряжения металлов, карточки-задания, текст химической сказки. ТСО: компьютер. Методы контроля: выполнение заданий Инновационные педагогические технологии, применяемые на занятии: · элементы технологии критического мышления; · элементы технологии проблемного обучения; · элементы технологии коллективной мыслительной деятельности (КМД); · элементы игр (химическое «Ассорти», химическая сказка, рассказ-загадка) Структура занятия Ι Организационный момент 1. Рефлексия (Задание 1 рабочего листа) II Подготовка к усвоению нового материала 2.1 Мотивационно - ориентировочный этап «Враг номер один…» (Создание проблемной ситуации в ходе просмотра презентации). Сообщение темы урока 2.2 Постановка целей урока в ходе фронтального опроса и беседы.
Основные показатели оценки Студент: 1. Объясняет: -сущность ОВР; процессов, протекающих при окислении-восстановлении; - практическое значение окислительно-восстановительных реакций; 2. Составляет электронные уравнения процессов восстановления и окисления.Расставляет коэффициенты методом электронного баланса.
Межпредметные связи биология, география, физика, история,
Содержание занятия Вводное слово учителя. Мотивационно - ориентировочный этап. Ребята, вокруг нас протекает множество химических реакций, некоторые из них приносят вред, а без некоторых наша жизнь невозможна. Сегодня я предлагаю вам разобраться в следующих ситуациях. Проблемные ситуации: Колосс Родосский Перед вами одно из семи чудес света. Кто скажет, что это? Колосс Родосский - гигантская статуя, стоявшая в портовом городе Родоса - острова возле берегов современной Турции в Эгейском море. Колос Родосский является шестым и самым недолговечным из семи чудес света Древнего мира. В III в. до нашей эры на острове Родос был построен маяк в виде огромной статуи Гелиоса. Бронзовая оболочка его была смонтирована на железном каркасе. Сверкающий бог был виден за много километров от Родоса, и вскоре молва о нём распространилась по всему античному миру. Но уже через полвека (а точнее, через 66 лет) сильное землетрясение, разрушившее Родос, повалило колосса на землю, самым уязвимым местом статуи оказались колени. Отсюда и пошло выражение "колосс на глиняных ногах". Родосцы пытались поднять колосса. Известны благородные попытки соседей помочь им в этом деле. Египетский царь прислал несколько сот мастеров. Но ничего не вышло. Тысячу лет лежал расколотый колосс у Родоса, пока в 977 году нуждавшийся в деньгах арабский наместник не продал его одному купцу. Купец, чтобы отвезти колосса на переплавку, разрезал его на части и нагрузил бронзой 900 верблюдов. Символ Парижа Символом Парижа – Эйфелева башня. Стальной каркас 300 метровой конструкции выполнен из сталей с различными добавками. Она неизлечимо больна, и только постоянная химиотерапия помогает бороться со смертельным недугом: её красили 18 раз, отчего её масса 9000 т каждый раз увеличивается на 70 т. Яхта миллионера. Послушайте еще одну историю о том. Как однажды жестко просчитался один американский миллионер. В 20-е годы ХХ в. по заказу одного американского миллионера была построена роскошная яхта “Зов моря”. Для обшивки корпуса яхты использовался сплав никеля с медью (сплав 70% никеля и 30% меди), известный под названием монель-металл, а киль и раму руля изготовили из стали. Сплав монель-металл отличается чрезвычайно высокой стойкостью во многих агрессивных средах, в том числе и в морской воде. Другие детали корпуса судна были изготовлены из специальных нержавеющих сталей, т.е. материалов, содержащих железо. Когда яхта была спущена на воду, судно затонуло, не сделав ни одного рейса. Как вы думаете, что связывает эти примеры? (Коррозия) Враг номер один... Этот враг попросту именуется ржавлением. Наука называет его коррозией металлов. Ответ: ученые считают, что причиной произошедших событий были окислительно-восстановительные процессы. Сегодня уроке мы будем говорить о явлениях, с которыми вы часто сталкиваетесь в своей жизни, не догадываясь, что в их основе лежат …(окислительно-восстановительные) реакции.
Итак, тема нашего урока: Окислительно – восстановительные реакции А) Уменьшаются Б) Усиливаются В) Изменяются периодически Г) Не изменяются 5.Окислительные свойства простых веществ, образованных элементами седьмой группы, главной подгруппы с увеличением заряда ядра:
А) Уменьшаются Б) Усиливаются В) Изменяются периодически Г) Не изменяются Приложение 4 Технология коллективной мыслительной деятельности (КМД)
Сущность технологии коллективной мыслительной деятельности заключается в том, чтобы развивать обучающегося, его потребности, и тем самым учить жить в окружающем мире свободно и самостоятельно. Основная идея, положенная в организацию рабочего процесса в режиме КМД, состоит в том, что обучение ведется в активном взаимодействии обучаемых с педагогом и между собой с того уровня (развитие потребностей - способностей), на котором находятся обучаемые. Технология КМД состоит из системы проблемных ситуаций, каждая из которых разделяется на четыре основных такта: • Первый такт – ввод в проблемную ситуацию: постановка проблемы, коллективное обсуждение целей, способов их достижения. Функция: актуализация противоречий, определение внутренних целей, реальных способов деятельности; • Второй такт – работа по творческим микрогруппам. Функция: разрешение противоречий, выращивание внутренних целей, формирование способов деятельности, выработка индивидуальной, коллективной позиции по изучаемой проблеме; • Третий такт – окончание рабочего процесса, общее обсуждение разрешаемой проблемы, защита позиций. Функция: формирование коллективных и личных позиций на основе сравнения их с научной (окончание выращивания внутренних целей), выработка общего мнения о работе творческих групп, отдельных личностей, коллектива в целом; • Четвертый такт – определение новой проблемы, направления процесса дальнейшего познания. Системообразующим моментом технологии КМД является рефлексия.
Мультимедийные технологии
Одним из примеров новых педагогических технологий являются мультимедийные технологии. С развитием новой техники, проникновением средств массовой информации (СМИ), кино, радио, телевидения, видео во все сферы жизни человека в мировой педагогике возникло направление, получившее название «медиаобразование». Данное направление обусловлено: бурно развивающейся информатизацией общества и потребностью подготовки подрастающего поколения к различным формам коммуникаций, формированию умения обучающихся ориентироваться в увеличивающихся информационных потоках.
Термин «медиаобразование» в отечественной педагогике был впервые предложен А.В. Шариковым. Согласно Российской педагогической энциклопедии, «медиаобразование» (англ. Media education от лат. mediaа — средства) - направление в педагогике, выступающее за изучение закономерностей массовой коммуникации (пресса, ТВ, радио, кино, видео и др.). Основные задачи медиаобразования: подготовить новое поколение к жизни в современных информационных условиях, к восприятию различной информации. Научить человека понимать ее, осознавать последствия ее воздействия на психику, овладевать способами общения на основе невербальных форм коммуникации с помощью технических средств, быть толерантным по отношению к другому мнению, другому народу, принимать отличные традиции и взгляды и, как следствие этого, воспринимать и уважать человека как такового и признавать его как ценность, независимо от его национальной принадлежности и социального положения. Одно из перспективных направлений развития современной компьютерной техники - усиление наглядности представления информации на дисплее. Широкое распространение получают в настоящее время средства мультимедиа, комплекс электронных и программных средств, обеспечивающих запись и воспроизведение на компьютере аудио- и видеоинформации вплоть до воспроизведения фильмов, по качеству не уступающих бытовому телевидению. Таким образом, можно уже считать, что достигнута техническая база для реализации интерактивного видео — демонстрации видеосюжетов, допускающей диалог со зрителем под управлением ЭВМ. Педагогические последствия такого технического достижения обширны: отсроченная обратная связь для учебных видеосюжетов заменяется оперативной, обучаемый получает возможность ставить эксперименты, вмешиваться в ход видеосюжетов. Опыт применения телекоммуникаций в различных сферах образования, хотя пока и не очень значительный, показал, что этот вид информационных технологий позволяет: • организовать различного рода совместные исследовательские работы преподавателей, студентов, научных работников из училищ, колледжей, научных и учебных центров одного или разных регионов или даже разных стран. Метод проектов позволяет при этом организовать подлинно исследовательскую творческую либо чисто прикладную практическую самостоятельную деятельность партнеров, используя при этом многообразие методов и форм такой работы; • наладить оперативную консультационную помощь широкому кругу обучаемых из научно-методических центров; • создать сеть дистанционного обучения и повышения квалификации педагогических кадров; • оперативно обмениваться информацией, идеями, планами по интересующим участников совместных проектов вопросам, темам, расширяя, таким образом, свой кругозор, повышая культурный уровень; • формировать у партнеров - студентов, преподавателей — коммуникативные навыки, культуру общения, что предполагает умение кратко и четко формулировать собственные мысли, терпимо относиться к чужому мнению, вести дискуссию, аргументировано доказывать свою точку зрения; также слушать и уважать позицию партнера;
• формировать навыки подлинно исследовательской деятельности, моделируя работу научной лаборатории, творческой мастерской; • научиться добывать информацию из разнообразных источников (начиная с партнера по совместному проекту и кончая удаленными базам данных), обрабатывать ее с помощью самых ее временных компьютерных технологий, хранить передавать на любые расстояния, в разные точки планеты; • создавать подлинную языковую среду в условии совместных международных телекоммуникационных проектов, телеконференций (обычных, а также аудио- и видеоконференций), способствующую возникновению естественной потребности в общении на иностранном языке, и отсюда потребности в его изучении; • способствовать культурному, гуманитарному развитию учащихся на основе приобщения к самой широкой информации культурного, этнического, гуманистического плана. Таковы в кратком изложении дидактические функции телекоммуникаций, обусловленные их дидактическими свойствами. Все они в полной мере отвечают гуманистически направленному обучению и воспитанию студентов, что в итоге формирует учащихся как гуманистически развитых личностей. 5. Игровые технологии (образовательные, ролевые, деловые игры)
Рассказы-загадки Рассказы-загадки — это задачи и, если хотите, беллетристика. В сюжет рассказа вплетены определенные вопросы, проблемы, ситуации или задания, которые должен выполнить или решить герой, а вместе с ним и ученик. Разгадывая рассказ-загадку, следует внимательно читать текст, так как в нем обычно имеются подсказки, облегчающие выполнение задания.
ВЫВОДЫ:
Каждый день мы встречаемся с тысячами окислительно- восстановительных реакций и даже не задумываемся какую роль они играют в нашей жизни. Без этих реакций невозможно наше существование.
Если мы замерли, или хотим приготовить еду, то зажигаем огонь. Реакция горения это тоже окислительно – восстановительная реакция. А знаете, что можно согреться и без огня, с помощью химических грелок. Например такой:совершенно сухую смесь железной (Fe) или алюминиевой (Al) стружки с солями меди (например, CuCl2) можно хранить довольно долго, а при добавлении воды температура сразу же повышается почти до 100оС за счет реакции:
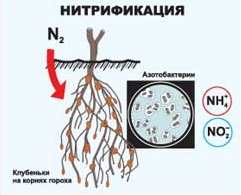
Растениям очень необходим азот. Несмотря на то, что его в воздухе 78% по объёму, он практически недоступен. На помощь приходят опять же окислительно-восстановительные реакции, протекающие при помощи бактерий и некоторых клубеньковых растений.
Окислительно – восстановительные реакции повсюду. Значит, их нужно изучать. Виды коррозии металлов Наиболее часто встречаются следующие виды коррозии металлов:
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую. Металлические покрытия. Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом ( более активный ), чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием. Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным. Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл. Неметаллические покрытия. Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум). Химические покрытия. В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся: оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.); фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2, Mn3(PO4)2); азотирование – поверхность металла (стали) насыщают азотом; воронение стали – поверхность металла взаимодействует с органическими веществами; цементация – получение на поверхности металла его соединения с углеродом. Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость. Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии. Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии. Протекторная защита – один из видов электрохимической защиты – заключается в следующем. К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора. Подведение итога урока В ходе урока мы рассмотрели теорию электролитической диссоциации и познакомились с определением электролитов. Узнали о физической и химической теории растворов. Рассмотрели в свете теории электролитической диссоциации определение оснований, кислот и солей, а также научились составлять уравнения реакций ионного обмена и узнали об условиях необратимости.
Гидролиз солей
Практическое применение. На практике с гидролизом учителю приходится сталкиваться, например при приготовлении растворов гидролизующихся солей (ацетат свинца, например). Обычная “методика”: в колбу наливается вода, засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды, взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше… А причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия, разбавление, нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов, и поскольку главным образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей, то есть уксусной. В других случаях степень гидролиза желательно увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает. Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа(III). На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси. ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Запишите уравнения гидролиза солей и определите среду водных растворов (рН) и тип гидролиза: №2. Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора: №3. Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора соли для следующих веществ: |
Классификация солей
Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля ( 1703 – 1770 ). Именно он в 1754 г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
Средние соли
Растворы.
Растворители
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул и ионов.
Обычно растворителем считают тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор. Например, в случае водного раствора соли растворителем является вода.
Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Процесс растворения
Растворение кристалла в жидкости протекает следующим образом.
Когда вносят кристалл в жидкость, в которой он может растворяться, от поверхности его отрываются отдельные молекулы. Последние благодаря диффузии равномерно распределяются по всему объёму растворителя.
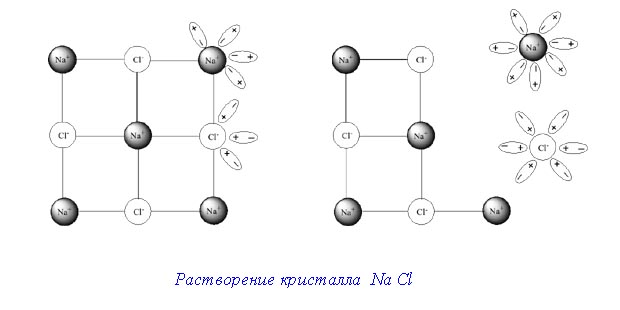
Отделение молекул от поверхности твёрдого тела вызывается, с одной стороны, их собственным колебательным движением, а сдругой – притяжением со стороны молекул растворителя.
Этот процесс должен был бы продолжаться до полного до полного растворения любого количества кристаллов, если бы не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность ещё не растворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов.
Понятно, что выделение молекул из раствора будет идти тем быстрее, чем больше концентрация раствора. А так как последняя по мере растворения вещества увеличивается, то, наконец наступает такой момент, когда скорость растворения становится равной скорости кристаллизации. Тогда устанавливается динамическое равновесие, при котором в единицу времени растворяется и кристаллизуется одинаковое число молекул.

Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
Концентрация растворов
Насыщенными растворами приходится пользоваться сравнительно редко. В большинстве случаев употребляются растворы ненасыщенные, т.е. с меньшей концентрацией растворённого вещества, чем в насыщенном растворе.
Концентрацией раствора называется количество растворённого вещества, содержащееся в определённом количестве раствора или растворителя.
Растворы с большой концентрацией растворённого вещества называются концентрированными, с малой – разбавленными.
Концентрацию раствора можно выражать по разному:
1. В процентах растворённого вещества по отношению ко всему количеству раствора.
2. Числом грам-молекул растворённого вещества, содержащегося в 1 литре раствора.
3. Числом грамм-молекул растворённого вещества, содержащегося в 1000 г растворителя
и т.д.
Растворимость
Растворимостью называется способность вещества растворяться в том или ином растворителе.
Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора.
Растворимость различных веществ колеблется в широких пределах.
· Если в 100 граммах воды растворяется более 10 г вещества, то такое вещество
принято называть хорошо растворимым.
· Если растворяется менее 1 г вещества – малорастворимым.
· Если в раствор переходит менее 0,01 г вещества, то такое вещество называют
практически нерастворимым.
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако, обычно вещества, состоящие из полярных молекул, и вещества с ионным типам связи лучше растворяются в полярных растворителях (вода, спиры, жидкий амиак), а неполярные вещества – в неполярных растворителях (бензол, сероуглерод).
Растворение большинства твёрдых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решётки твёрдого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов).
Как правило, повышение температуры должно приводить к увеличению растворимости твёрдых тел.
Дисперсные системы
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы — дисперсные системы и растворы.
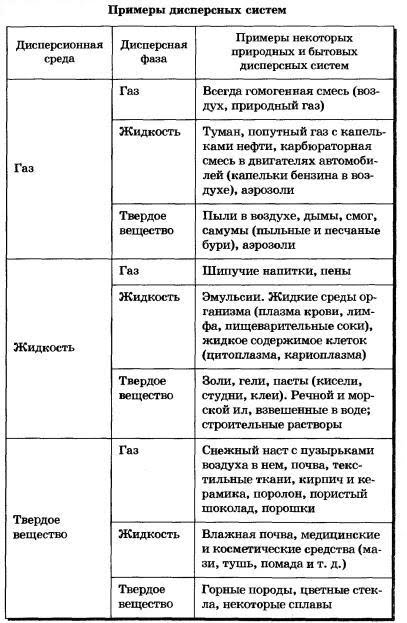
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой. Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называют гетерогенными (неоднородными).
И дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях — твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 9 видов таких систем.
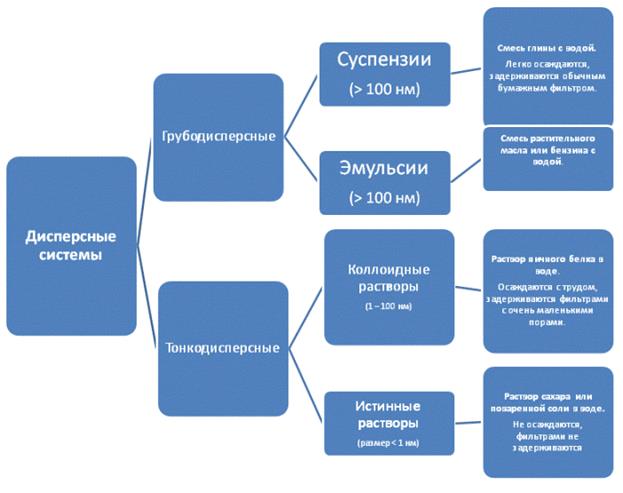
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные (взвеси) с размерами частиц более 100 нм и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система — раствор. Она однородна (гомогенна), поверхности раздела между частицами и средой нет.
Уже беглое знакомство с дисперсными системами и растворами показывает, насколько они важны в повседневной жизни и в природе.
Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета — наш общий дом — Земля; без клеток не было бы живых о
 Окислительно – восстановительные реакции - уже само название наводит тоску, что уж говорить про уравнения. А если отвлечься от уроков и посмотреть вокруг?
Окислительно – восстановительные реакции - уже само название наводит тоску, что уж говорить про уравнения. А если отвлечься от уроков и посмотреть вокруг?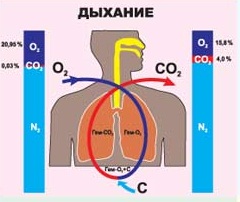 Что нужно человеку для жизни? Воздух и еда. Мы поглощаем пищу и вдыхаем кислород и в нашем организме идут бесконечные процессы окисления, дающие нам энергию. Помните выражение: «Ты что, каши мало ел?»
Что нужно человеку для жизни? Воздух и еда. Мы поглощаем пищу и вдыхаем кислород и в нашем организме идут бесконечные процессы окисления, дающие нам энергию. Помните выражение: «Ты что, каши мало ел?»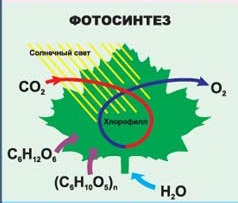 Как приятно летом прогуляться по лесу или парку. Вокруг так много зелени. Но откуда все это берется? Проведите опыт. Возьмите горшок с землей, взвесьте и посадите семечко. Через несколько лет оно превратится в большое растение. Взвесьте это растение и отдельно землю, в которой оно росло, и вы увидите, что масса земли не изменилась, в то время как масса растения увеличилась. Откуда она взялась? Не удивляйтесь. Это тоже благодаря окислительно – восстановительной реакции -фотосинтезу. В процессе фотосинтеза образуется так необходимый нам кислород и углеводы - строительный материал растений.
Как приятно летом прогуляться по лесу или парку. Вокруг так много зелени. Но откуда все это берется? Проведите опыт. Возьмите горшок с землей, взвесьте и посадите семечко. Через несколько лет оно превратится в большое растение. Взвесьте это растение и отдельно землю, в которой оно росло, и вы увидите, что масса земли не изменилась, в то время как масса растения увеличилась. Откуда она взялась? Не удивляйтесь. Это тоже благодаря окислительно – восстановительной реакции -фотосинтезу. В процессе фотосинтеза образуется так необходимый нам кислород и углеводы - строительный материал растений. Любите кефир, сметану, сыр, йогурт? Это тоже продукты окислительно – восстановительных реакций, протекающих в молоке. Молочно - кислое брожение.
Любите кефир, сметану, сыр, йогурт? Это тоже продукты окислительно – восстановительных реакций, протекающих в молоке. Молочно - кислое брожение.
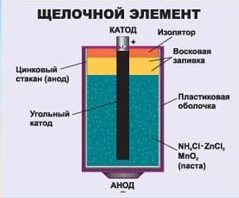 А это узнали? Гальванический элемент, или проще – батарейка. С помощью реакций можно получить не только тепловую энергию, но и электрическую. Окислительно – восстановительные реакции - это один из важнейших источников энергии. Если постараться, то можно сделать батарейку в домашних условиях.
А это узнали? Гальванический элемент, или проще – батарейка. С помощью реакций можно получить не только тепловую энергию, но и электрическую. Окислительно – восстановительные реакции - это один из важнейших источников энергии. Если постараться, то можно сделать батарейку в домашних условиях.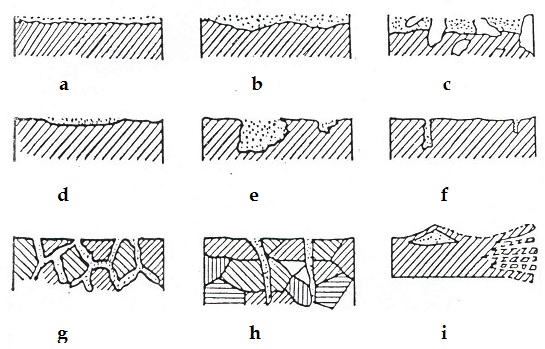 Основные виды коррозии
Основные виды коррозии


