Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Установление химических формул
До сих пор мы находили различные соотношение по известным химическим формулам. Рассмотрим теперь способы решения задачи, прямо противоположной – установления формул веществ по различным экспериментальным данным. Эта задача всегда была особенно актуальной для химии. Обычно для этой цели используют следующие данные: физические свойства (плотность паров, температура замерзания и кипения растворов), элементный состав (массовые доли элементов), анализ продуктов реакций, в частности продуктов сгорания. Рассмотрим все эти способы по очереди. Анализ физических свойств позволяет определить молярную массу вещества, и если известно, к какому классу оно принадлежит, установить его формулу.
Пример 6. Плотность газообразного углеводорода равна 1,96 г/л при нормальных условиях. Определите формулу углеводорода. Решение. Воспользуемся определением плотности из физики: r = m / V. Плотность – интенсивная величина, она не зависит от количества вещества. Возьмём один моль газа, тогда формула для плотности примет вид:
При нормальных условиях V m = 22,4 л/моль. Молярная масса газа равна: M = r V m = 1,96×22,4 = 44,0 г/моль. Обозначим формулу углеводорода C x H y. Уравнение для молярной массы имеет вид: 12 x + y = 44. Это уравнение имеет несколько решений в целых числах и решается подбором по x сверху: x = 4 – невозможно, так как тогда получится отрицательный y; x = 3, y = 44 – 12×3 = 8, формула углеводорода C3H8; x = 2, y = 44 – 12×2 = 20 – углеводородов с таким высоким содержанием водорода не бывает. Таким образом, только одно решение данного уравнения имеет химический смысл. Ответ. C3H8.
Самый стандартный и хорошо известный способ определения формул – по элементному составу, то есть по массовым долям элементов.
Пример 7. а) Определите простейшую формулу химического соединения, если массовые доли составляющих его элементов равны: C – 40,0%, H – 6,7%, O – 53,3%. Решение. Простейшая формула отражает относительные числа атомов в молекуле, или, что то же, мольные соотношения атомов. Поскольку простейшая формула не зависит от массы вещества, возьмём образец вещества массой 100 г и найдём отношение количеств элементов (в молях) в этом образце. Для этого следует разделить массу каждого элемента на его относительную атомную массу:
n(C): n(H): n(O) = (40,0/12): (6,7/1): (53,3/16) = 3,3: 6,7: 3,3. Наименьшее из чисел (3,3) принимаем за единицу и находим отношение: n(C): n(H): n(O) = 1: 2: 1. Оно означает, что в молекуле химического соединения на один атом углерода приходится 2 атома водорода и один атом кислорода, следовательно, простейшая формула - СH2O. Без дополнительной информации, например, о молярной массе, определить молекулярную формулу мы не можем. б) Определите молекулярную формулу органического вещества из п. а), если его молярная масса равна 60 г/моль. Решение. I способ. Простейшая формула вещества – CH2O. Простейшей формуле соответствует молярная масса: M (CH2O) = 12 + 2´1 + 16 = 30 г/моль. Молярная масса вещества равна 60 г/моль, следовательно, истинная формула оксида равна простейшей формуле, умноженной на 2, т.е. C2H4O2. II способ. Возьмем один моль вещества, масса которого равна 60 г, и найдём с помощью массовых долей количества элементов (в молях) в этом образце вещества: m (С) = m ×w = 60×0,4 = 24 г, n(С) = m / M = 24 /12 = 2 моль; m (H) = m ×w = 60×0,067 = 4 г, n(H) = m / M = 4 /1 = 4 моль; m (O) = m ×w = 60×0,533 = 32 г, n(O) = m / M = 32 /16 = 2 моль. В одном моле вещества содержится 2 моля углерода, 4 моля водорода и 2 моля кислорода. Это означает, что молекулярная формула вещества – C2H4O2. Ответ. а) CH2O; б) C2H4O2.
Молекулярную формулу по массовым долям можно также определить в том случае, когда известна принадлежность вещества определённому классу соединений, что позволяет использовать общую молекулярную формулу данного класса.
Пример 8. Определите молекулярную формулу и структуру ацетиленового углеводорода, в молекуле которого имеется только одна метильная группа, а массовая доля углерода равна 88,2%. Решение. Общая формула ацетиленовых углеводородов C n H2 n -2. Возьмём один моль углеводорода, его масса равна молярной массе: m (C n H2 n -2) = w(C) = 12 n / (14 n – 2) = 0,882. Решая уравнение, находим: n = 5. Молекулярная формула углеводорода – C5H8.
Существуют три алкина такого состава, из них два содержат по две метильные группы CH3 (пентин-2 и 3-метилбутин-1), а один (пентин-1) – одну группу CH3. Искомый углеводород – пентин-1: HCºC-CH2-CH2-CH3. Ответ. C5H8, пентин-1.
Примеры 7 и 8 демонстрируют стандартные подходы к определению формулы по массовым долям всех элементов. Теперь мы рассмотрим задачу с ограниченным числом данных, например о массовой доле только одного элемента. Здесь мы встретимся с приёмами решения олимпиадных задач.
Пример 9. Определите возможную формулу органического вещества, содержащего 50% углерода по массе. Решение. I способ. Самый простой вариант решения – «сконструировать» формулу такого вещества методом подбора по числу атомов углерода. В веществе – 50% углерода и 50% остальных элементов по массе. а) Допустим, в молекуле вещества – один атом углерода, тогда на моль вещества приходится 12 г углерода и 12 г остальных элементов. Это возможно только с тяжёлыми изотопами, например с четырьмя атомами трития, T (3H). Формула вещества – CT4, это – сверхтяжёлый метан. Решение получилось довольно экзотическое. Попробуем найти решение, используя только распространённые изотопы. б) Если атомов углерода в молекуле два, то на 24 г углерода приходится 24 г других элементов. Возможные комбинации – NH10 или OH8 – не удовлетворяют ограничениям на валентность элементов и поэтому химически бессмысленны. в) Пусть в молекуле – 3 атома углерода, тогда в одном моле вещества будет 36 г других элементов. Здесь уже имеется несколько решений: 2 моля O (32 г) и 4 моля H (4 г), 2 моля N (28 г) и 8 молей H (8 г) и другие. Возможные формулы вещества: C3H4O2 (это может быть акриловая кислота II способ имеет формально-математический характер. Рассмотрим сначала самый простой класс органических соединений – углеводороды, C x H y. Уравнение для массовой доли углерода
имеет решение y = 12 x, которому не соответствует ни одна химическая формула. Значит, углеводороды не подходят. Попробуем найти вещество среди кислородсодержащих соединений. Возьмём один моль C x H y O z. Уравнение для массовой доли углерода
легко преобразуется в уравнение 12 x = y + 16 z, решение которого (x = 3, y = 4, z = 2) находится простым подбором. Ответ. C3H4O2.
Другой широко распространённый способ определения формул – анализ продуктов сгорания. Этот способ применялся в органической химии до тех пор, пока не появились физические методы установления строения веществ (ЯМР, ИК, УФ – спектроскопия). Измерив массы продуктов сгорания, можно найти количество основных элементов – углерода, водорода и азота – в органическом веществе. Кислород определяется по массе исходной навески.
Пример 10. При сгорании 2,28 г органического вещества образовалось 3,96 г углекислого газа, 0,42 г азота и 0,54 г воды. Установите молекулярную формулу вещества, если известно, что его молярная масса меньше 200 г/моль. Решение. Судя по продуктам сгорания, вещество состоит из элементов C, H, N и, возможно, O. Пусть формула вещества C x H y N z O a. Уравнение сгорания в данном случае не нужно, можно ограничиться схемой (не указан коэффициент при O2):
C x H y N z O a + O2 = x CO2 + y /2 H2O + z /2 N2 Определив количество вещества продуктов, найдём количество элементов C, H и N и их массу в исходном веществе: n(CO2) = m / M = 3,96 / 44 = 0,09 моль; n(C) = n(CO2) = 0,09 моль; m (C) = n× M = 0,09×12 = 1,08 г; n(N2) = m / M = 0,42 / 28 = 0,015 моль; n(N) = 2n(N2) = 0,03 моль; m (N) = n× M = 0,03×14 = 0,42 г; n(H2O) = m / M = 0,54 / 18 = 0,03 моль; n(H) = 2n(H2O) = 0,06 моль; m (H) = n× M = 0,06×1 = 0,06 г; Общая масса трёх элементов составляет: 1,08 + 0,42 + 0,06 = 1,56 г, что меньше массы исходной навески. Следовательно, в состав веществ входили атомы кислорода массой 2,28 – 1,56 = 0,72 г. n(O) = m / M = 0,72 / 16 = 0,045 моль. Выразим отношение количества элементов через простейшие целые числа: n(C): n(H): n(N): n(O) = 0,09: 0,06: 0,03: 0,045 = 6: 4: 2: 3, что соответствует эмпирической формуле C6H4N2O3 (M = 152 г/моль). Условие на молярную массу показывает, что простейшая формула совпадает с молекулярной. Ответ. C6H4N2O3.
В данном случае мы обошлись без уравнения реакции. Если число элементов в исследуемом веществе невелико, уравнение сгорания будет простым и можно определить состав вещества с помощью расчёта по уравнению реакции.
Пример 11. Определите все возможные формулы углеводорода, если для полного сжигания 3 л этого вещества потребовалось 15 л кислорода. Объёмы веществ измерены при одинаковых условиях. Решение. Последняя фраза в условии намекает на использование закона Авогадро, из которого следует, что отношение объёмов газообразных участников реакции равно отношению соответствующих коэффициентов в уравнении реакции. Запишем в общем виде уравнение полного сгорания углеводородов C x H y:
Применим к этому уравнению указанное выше следствие из закона Авогадро: V (C x H y): V (O2) = 1: (x + y /4) 3: 15 = 1: (x + y /4) x + y /4 = 5. Перебор по x даёт два химически разумных решения: x = 3, y = 8; x = 4, y = 4. Первый вариант C3H8 соответствует пропану, второй – C4H4, например, винилацетилену: CH2=CH–CºCH. Ответ. C3H8, C4H4.
Рассмотрим более сложную, но все ещё стандартную задачу, включающую расчёт по двум уравнениям реакций.
Пример 12. При длительном нагревании 62,1 г кристаллогидрата карбоната двухвалентного металла происходит полное обезвоживание и образуется 37,8 г безводной соли, которая при дальнейшем прокаливании превращается в 18,0 г твёрдого остатка, представляющего собой оксид металла. Определите состав исходного кристаллогидрата. Решение. Обозначим неизвестный металл буквой M, а число молекул на одну формульную единицу кристаллогидрата x, тогда уравнения описанных реакций разложения будут иметь вид:
MCO3× x H2O ® MCO3 + x H2O. MCO3 ® MO + CO2. Первое уравнение содержит два неизвестных (M и x), а второе – одно, поэтому начнём расчёт со второго уравнения. Здесь можно использовать два подхода – красивый и стандартный. Стандартный способ состоит в следующем: согласно уравнению реакции, количества вещества карбоната и оксида равны: n(MCO3) = n(MO). Запишем это равенство через массы и молярные массы карбоната и оксида:
откуда найдём молярную массу металла: M (M) = 24 г/моль – это магний. Более изящный способ основан на том, что уменьшение массы в последней реакции равно массе выделившегося углекислого газа: m (CO2) = Определив неизвестный металл, вернёмся к первому уравнению. Там можно применить те же два приёма. Ограничимся более изящным. Масса карбоната магния известна, по потере массы найдём массу второго продукта реакции: m (H2O) = 62,1 – 37,8 = 24,3 г. Далее определим количества продуктов, а их отношение, согласно основному закону стехиометрии (подробно – см. следующую лекцию) равно отношению соответствующих коэффициентов. n(MgCO3) = m / M = 37,8 / 84 = 0,45 моль, n(H2O) = m / M = 24,3 / 18 = x: 1 = n(H2O): n(MgCO3) = 1,35: 0,45 = 3. Искомое вещество – тригидрат карбоната магния. Ответ. MgCO3×3H2O.
В заключение этого раздела предлагаем простую задачу со стандартным решением, но очень нестандартным ответом с Международной химической олимпиады 2008 года.
Пример 13. Определите брутто-формулу ионного соединения, содержащего два неметалла, один из которых – азот. Массовая доля азота в этом соединении равна 91,22%, а мольная доля – 95,83%. Предложите возможное строение этого соединения. Решение. Обозначим формулу неизвестного вещества R x N y. В одном моле вещества – x молей элемента R и y молей N. Запишем выражение для мольной доли азота:
откуда y = 23 x. Можно принять x = 1, y = 23, тогда брутто-формула соединения RN23. Чтобы найти неизвестный элемент, используем условие для массовой доли азота:
Решая уравнение, находим M (R) = 31 г/моль, R – фосфор P. Таким образом, ионное соединение имеет необычную формулу PN23. Строение этого соединения можно установить, если вспомнить, что азот кроме простого вещества N2 может образовывать полиядерные катионы и анионы, например, N5+ и N3–. Неизвестное вещество состоит из катиона N5+ и комплексного аниона гексаазидофосфата [P(N3)6]–. Ответ. PN23, N5+[P(N3)6]–.
Мы рассмотрели на примерах практически все основные приёмы, используемые для установления химических формул. Глобально их можно разделить на два класса: 1) определение стехиометрического мольного соотношения элементов по массовым долям или различным уравнениям реакций; 2) использование молярной массы с учётом химических ограничений на валентность или общую формулу класса соединения. Все остальные методы являются комбинацией этих двух базовых подходов.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 143; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.41.53 (0.057 с.) |
 .
.

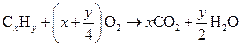 .
.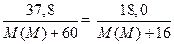 ,
,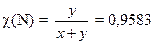 ,
, .
.