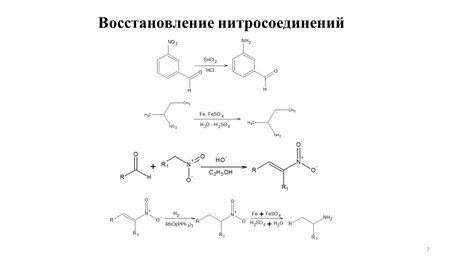
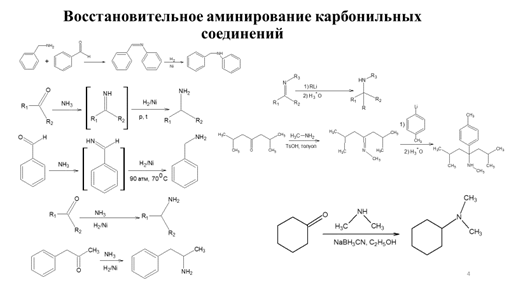
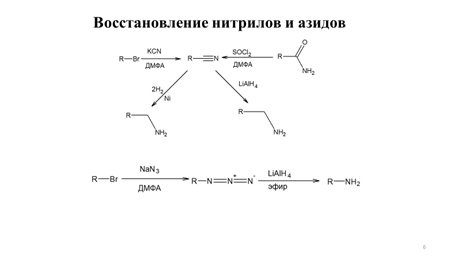
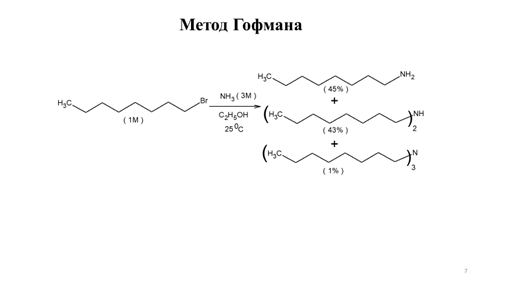
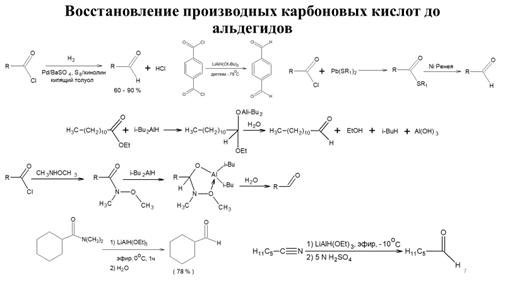
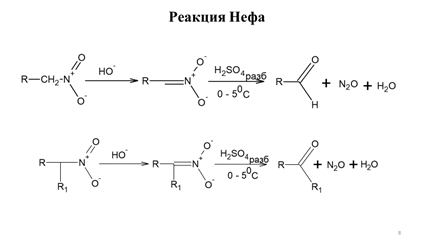
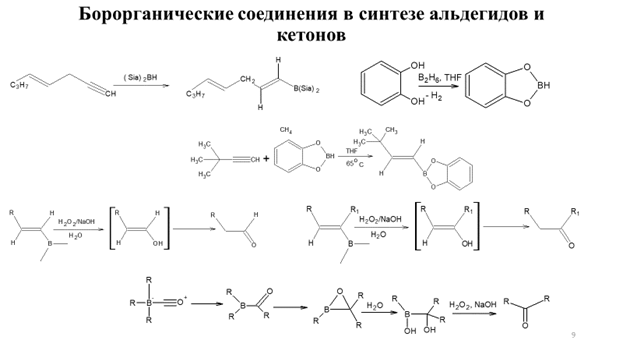
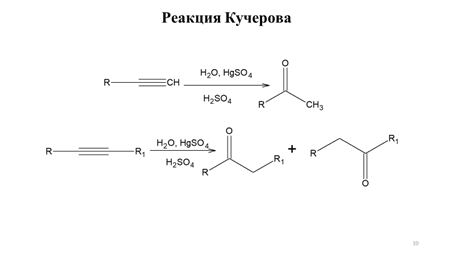
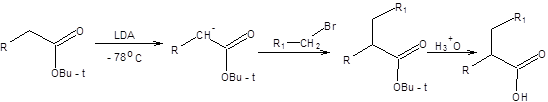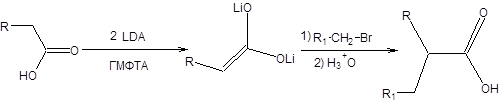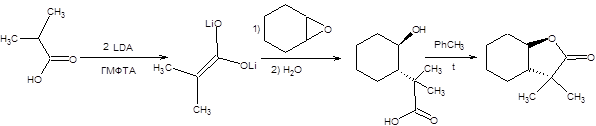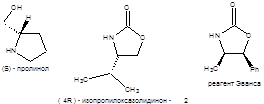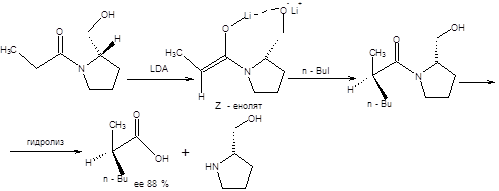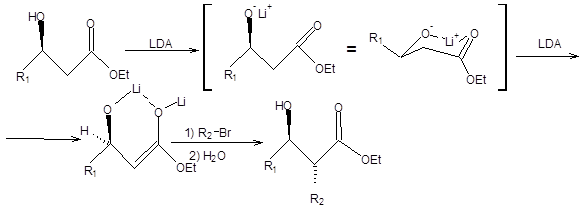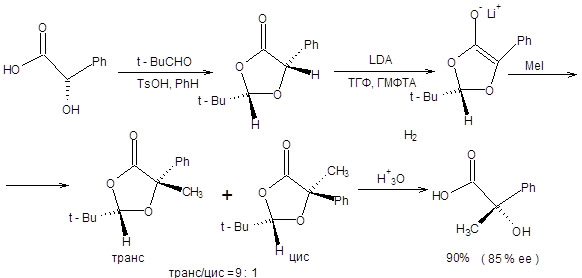Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
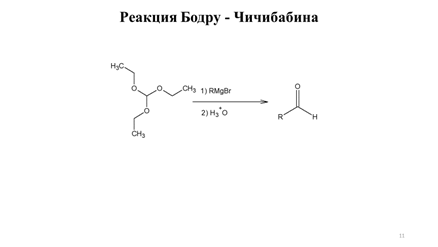
Еноляты сложных эфиров в синтезе карбоновых кислот⇐ ПредыдущаяСтр 27 из 27
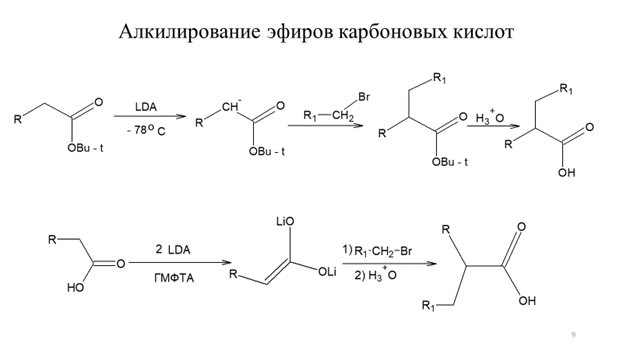
Часто в синтезе карбоновых кислот в качестве исходных соединений используют сложные эфиры. Сложные эфиры, как и другие карбонильные соединения, енолизуются под действием оснований. При действии оснований средней силы происходит сложноэфирная конденсация, однако использование сильных малонуклеофильных оснований, таких как LDA позволяет количественно переводить сложные эфиры в соответствующие еноляты. Еноляты сложных эфиров легко алкилируются первичными алкилгалогенидами и сульфонатами с образованием новой углерод-углеродной связи (схема 9.9). Карбоновые кислоты также могут быть превращены в еноляты действием двух эквивалентов LDА и далее подвергнуты алкилированию (схема 9.9).
Схема 9.9
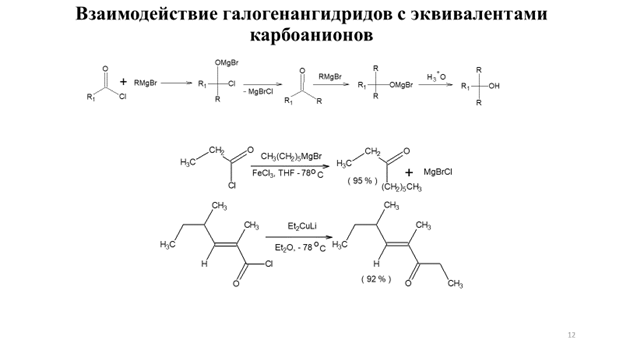
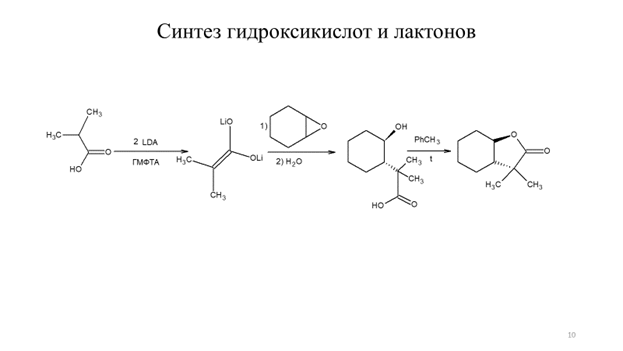
Алкилирование енолятов солей карбоновых кислот эпоксидами может эффективно использоваться для синтеза лактонов, как представлено на схеме9.10.
Схема 9.10
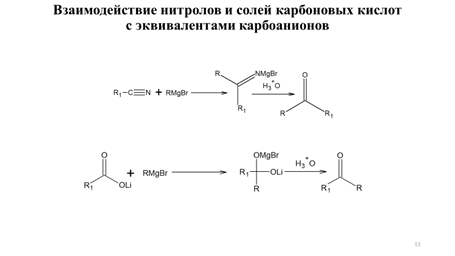
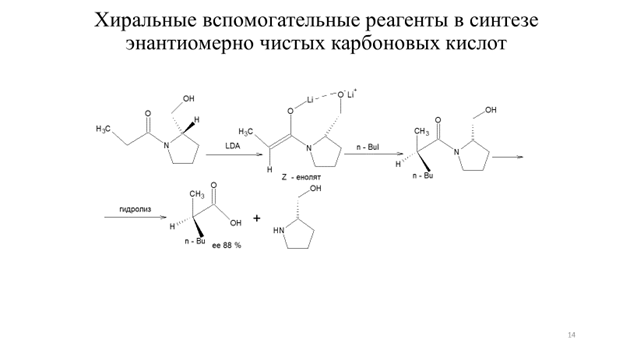
Важным достоинством алкилирования енолятов производных карбоновых кислот является не только возможность синтеза карбоновых кислот заданного строения, но и возможность стереоконтроля алкилирования. Для асимметрического синтеза α-замещенных карбоновых кислот эффективно применение энантиомерно чистых (R)-валинола, (S)-пролинола и (1S,2R)-норэфедрина (метод Эванса) в качестве хиральных вспомогательных соединений (схема 9.11).
Схема 9.11 Представленные на схеме9.11 ХВС легко взаимодействуют с ангидридами карбоновых кислот с образованием соответствующих хиральных амидов. Например, хиральный N-ацилизопропилоксазолидинон подвергается депротонированию под действием LDA при пониженной температуре (-78 0С) с образованием литиевого (Z)-енолята почти с количественным выходом. Изопропильная группа хирального (Z)-енолята блокирует подход электрофильного реагента из-за плоскости чертежа, что и приводит к формированию нового хирального центра заданной конфигурации. Гидролиз приводит к образованию избытка одного из энантиомеров карбоновой кислоты (схема 9.12) [3,4].
Схема 9.12 Подобным образом осуществляется стереодифференциация возможных направлений электрофильной атаки с использованием (S)-пролинола в качестве хирального вспомогательного соединения, как показано на схеме 9.13 [4].
Схема 9.13
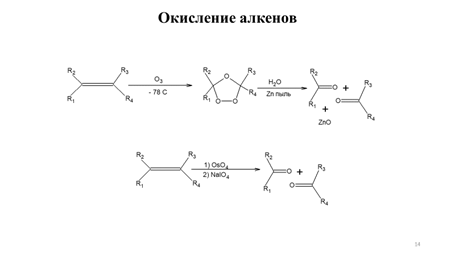
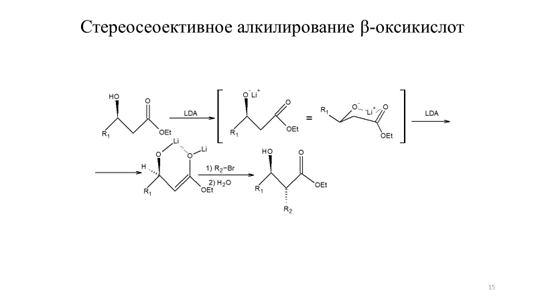
Другим вариантом осуществления стереоконтроля алкилирования енолятов сложных эфиров является использование энантиомерно чистых сложных эфиров α-оксикислот в качестве исходных реагентов. В этом случае сложный эфир β-оксикислоты превращают в литиевый енолят обработкой двумя эквивалентами LDА. Литиевые еноляты эфиров β-оксикислот представляют собой хелаты и обладают значительной конформационной жесткостью. Диастереоселективность реакциисвязана с относительной выгодностью подхода электрофильного реагента со стороны противоположной алкоксидному фрагменту, как показано на схеме 9.14 [5]:
Схема 9.14
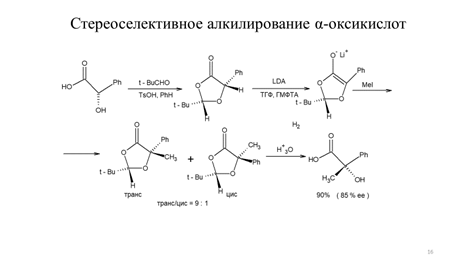
Особенно привлекательной в синтетическом отношении является возможность асимметрического алкилирования α-оксикислот, что связанно с их доступностью из природных источников. Так энантиомерно чистые молочная и миндальная кислоты представляют дешевые хиральные реагенты. Асимметрическое алкилирование миндальной кислоты основано на ее кислотно-катализируемом превращении в циклический ацеталь-ацилаль при взаимодействии с пивалиновым альдегидом. Депротонирование циклического ацеталя-ацилаля под действием LDA приводит к образованию хирального енолята, причем роль хирального индуктора выполняет объемная трет-бутилная группа. Последовательность стадий асимметрического алкилирования миндальной кислоты показана на схеме 9.15 [6].
Схема 9.15
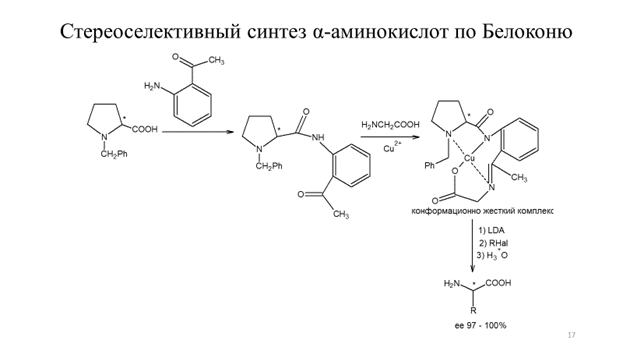
Формально результат алкилирования миндальной кислоты соответствует замещению атома водорода на алкильную группу с сохранением конфигурации. Также показано, что не только миндальная кислота, но и молочная кислота асимметрически алкилируется в указанных условиях, однако в последнем случае достигается несколько меньшая оптическая чистота продукта алкилирования. Другой подход к асимметрическому алкилированию, предложенный Ю.Н. Белоконем в 1982 г., позволяет синтезировать ряд α-аминокислот с высокой степенью оптической чистоты, исходя из глицина. Первоначально, исходя из глицина, получают хиральный конформационно жесткий медный комплекс (схема 9.16).
Схема 9.16
Депротонирование конформационно жесткого комплекса пространственно затрудненными амидами щелочных металлов и последующее алкилирование позволяет получать α-аминокислоты высокой оптической чистоты (схема 9.16). Список литературы 1. Arndt F., Eistert B. // Ber. Dtsch. Chem. Ges. 1935.V. 68. P. 200. 2. Katritzky A. R., Zhand S., Fang Y. // Org. Lett. 2000.V. 2. P. 3789. 3. Evans D. A., Ennis M. D., Mathre D. J. // J. Am. Chem. Soc. 1982. V. 104. P. 1737. 4. Бакстон Ш., Робертс С. Введение в стереохимию органическихсоединений. М.: Мир. 2005. 311 С. 5. Frater G. // Helv. Chim. Acta. 1979.V. 62. P. 2825. 6. Seebach D., Sting A. R., Hoffmann M. // Angew. Chem. Int. Ed. 1996. V. 35. P. 2708.
4. Презентации материалов лекций по курсу «Избранные главы химии: Органическая химия»
Заключение Разработано учебно-методическое обеспечение дисциплины «Избранные главы химии: Органическая химия» для направления подготовки 05.04.06 – Экология и природопользование в рамках магистерской программы «Зеленая химия для устойчивого развития» строго в соответсвии с требованиями технического задания. Отчетные материалы пригодны для размещения в ЕИОС РХТУ им. Д.И. Менделеева и будут способствовать большей доступности даваемого в курсе «Избранные главы химии: Органическая химия» материала для обучающихся.
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 144; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.69.172 (0.015 с.) |