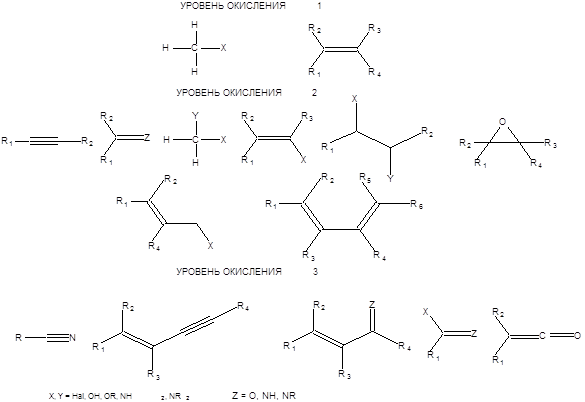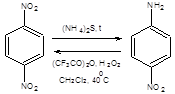Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Третья рубежная контрольная работа
Вариант № 1 1.Окисление спиртов. Реагенты Саррета – Коллинза и Кори. Примеры применения реагентов Саррета – Коллинза и Кори в органическом синтезе. 2.Реагент Десс – Мартина: получение и применение в органическом синтезе.
Вариант № 2 1.Реагент Пфитцнера – Моффата: механизм действия и область синтетического применения. 2.Реагент Сверна: механизм действия и область синтетического применения.
Вариант № 3 1. Реакции Корнблюма и Кори-Кима: механизм и область синтетического применения.
Вариант № 4 1. Восстановление амидов и нитрилов до альдегидов. Амид Вайнреба.
Вариант № 5 1. Гидроборирование алкинов в синтезе карбонильных соединений.
Вариант № 6
1. Реакция Бодру – Чичибабина.
Вариант № 7
1. Взаимодействие реактивов Гриньяра с нитрилами и солями карбоновых кислот.
Вариант № 8 1. Енолизация карбонильных соединений. Термодинамический и кинетический контроль енолизации.
Вариант № 9 1. Ковалентные и ионные еноляты: синтез, строение, реакционная способность.
Вариант № 10
1. Ацилирование ионных енолятов.
Вариант № 11 1. Синтезы кетонов из ацетоуксусного эфира: примеры и синтетические возможности.
Вариант № 12 1. Реакция Михаэля с участием купратов.
Вариант № 13 1. Хиральные гидразины в асимметрическом алкилировании кетонов.
Вариант № 14 1. Карбоксилирование реактивов Гриньяра.
Вариант № 15 1. Синтезы карбоновых кислот из малонового эфира.
Вариант № 16 1. Окисление спиртов. Реагенты Саррета – Коллинза и Кори. Примеры применения реагентов Саррета – Коллинза и Кори в органическом синтезе. 2. Реагент Сверна: механизм действия и область синтетического применения.
Вариант № 17 1. Реагент Пфитцнера – Моффата: механизм действия и область синтетического применения. 2. Реагент Десс – Мартина: получение и применение в органическом синтезе.
Вариант № 18 1. Реакции Корнблюма и Кори-Кима: механизм и область синтетического применения. 2. Реакция Нефа: механизм и синтетические возможности.
Вариант № 19 1. Восстановление амидов и нитрилов до альдегидов. Амид Вайнреба. 2. Методы селективного восстановления хлорангидридов до альдегидов.
Вариант № 20 1. Гидроборирование алкинов в синтезе карбонильных соединений. 2. Взаимодействие галогенангидридов карбоновых кислот с эквивалентами карбанионов.
Вариант № 21
1. Реакция Бодру – Чичибабина. 2. Реакция Кучерова
Вариант № 22
3. Взаимодействие реактивов Гриньяра с нитрилами и солями карбоновых кислот.
Вариант № 23 4. Енолизация карбонильных соединений. Термодинамический и кинетический контроль енолизации. 5. Окисление двойных связей. Окисление диолов.
Вариант № 24 1. Ковалентные и ионные еноляты: синтез, строение, реакционная способность. 2. Алкилирование ковалентных енолятов.
Вариант № 25 1. Ацилирование ионных енолятов. 2. Алкилирование ионных енолятов.
Вариант № 26 1. Синтезы кетонов из ацетоуксусного эфира: примеры и синтетические возможности. 2. Синтез карбонильных соединений с участием енаминов.
Вариант № 27 1. Реакция Михаэля с участием купратов. 2. Метод обращения полярности Кори – Зеебаха.
Вариант № 28 1. Хиральные гидразины в асимметрическом алкилировании кетонов. 2. Гомологизация карбоновых кислот по Арндту – Эйстерту.
Вариант № 29 1. Карбоксилирование реактивов Гриньяра. 2. Окисление первичных спиртов. Окисление альдегидов. Окисление алкилбензолов. Окисление алкенов.
Вариант № 30 1. Синтезы кетонов из ацетоуксусного эфира: примеры и синтетические возможности. 2. Еноляты сложных эфиров в синтезе карбоновых кислот.
3. Конспект лекций по курсу «Избранные главы химии: органическая химия» Лекция 1. Введение 1.1. Общие вопросы трансформации функциональных групп Перед синтетической органической химией неизменно стоит задача разработки новых методов получения веществ, структура которых или заключает в себе какие - то полезные свойства, или отвечает высочайшим требованиям химической эстетики. Как было отмечено в предыдущем разделе, органический синтез представляет рациональное сочетание тактических и стратегических аспектов применительно к получению конкретного вещества. Изложению методов органического синтеза посвящено грандиозное количество литературы. Поэтому настоящая книга не может претендовать на сколько-нибудь полное изложение методов органической химии, а останавливается лишь на некоторых наиболее значимых и интересных, по мнению автора, трансформациях. При планировании синтеза органических соединений в общем случае возникают задачи четырех типов: 1. Создание углерод – углеродных связей. 2. Создание требуемой совокупности функциональных групп. 3. Создание циклических систем по средствам образования углерод – углеродных связей или соответствующих трансформаций функциональных групп. 4. Создание необходимых стереохимических отношений между группами в целевой молекуле. Решение первой задачи позволяет построить углеродный скелет молекулы, что собственно и составляет основную задачу органического синтеза. Решение второй задачи, как правило, менее затруднительно, так как число методов трансформаций функциональных групп значительно больше, чем методов создания углерод – углеродной связи. Именно по этой причине следует в первую очередь сконцентрировать внимание на построение углеродного скелета молекулы и лишь во вторую очередь, проводить необходимые превращения функциональных групп.
Настоящий раздел посвящен рассмотрению общей методологии взаимопревращений функциональных групп. Наличие значительного объема фактической информации по проблеме взаимопревращения функциональных групп, а также ее широкое обсуждение в литературе позволяют лишь кратко остановиться на некоторых из методов, преимущественно рассмотрев общие подходы к решению этой проблемы. Все имеющиеся функциональные группы удобно классифицировать по уровню окисления входящего в них атома углерода [1]. Несмотря на более высокую электроотрицательность атома углерода по сравнению с атомом водорода, уровень окисления углерода в алканах можно условно принять равным нулю. Окисление, происходящее с переносом двух электронов от молекулы алканов, приводит к их производным с уровнем окисления 1. Аналогичным образом, можно представить формирование других степеней окисления атома углерода. Следует заметить, что спиртовая группа является прототипом степени окисления 1, альдегидная группа степени окисления 2, а карбоксильная группа, соответствует степени окисления углерода 3 (Схема 1.1).
Схема. 1.1
Используя этот подход можно формально поставить в соответствие каждой функциональной группе уровень ее окисления, как показано на схеме.1.2.
Схема 1.2 Все трансформации, с участием функциональных групп в соответствии с их классификацией по уровням окисления можно разделить на изогипсические и неизогипсические. Изогипсические трансформации определяются как взаимопревращения функциональных групп, протекающие без изменения уровня окисления углеродного атома. Неизогипсические трансформации, напротив, сопровождаются изменением уровня окисления углеродного атома. Практически любые изогипсические трансформации легко осуществимы. Взаимопревращения функциональных групп одного уровня окисления широко известны и не представляют особой трудности, поэтому группы одного уровня окисления можно считать синтетически эквивалентными друг другу. Напротив неизогипсические трансформации возможны лишь для некоторых функциональных групп, т.е. не всякая группа одного уровня окисления может быть превращена в одну стадию в определенную группу другого уровня окисления. Так, например непосредственное превращение простых эфиров в ацетали затруднено. Также определенные трудности представляет региоселективное превращение дигалогенопроизводных в моногалогенопроизводные. Однако трудности ограничиваются лишь попытками непосредственного превращения некоторых функциональных групп одного уровня окисления в определенные группы другого уровня окисления. Если прямая неизогипсическая трансформация затруднена, то необходимо предварительно провести несколько изогипсических трансформаций и лишь затем неизогипсическую с целью осуществления заданного превращения. На схеме 1.3. приведен пример реализации неизогипсической трансформации спиртовой группы в ацетальную, которая трудноосуществима в одну стадию.
Схема 1.3
Вместе с тем необходимо учитывать, что каждой функциональной группе свойственен совершенно определенный круг неизогипсических трансформаций. Так первичные спирты могут быть легко окислены в соответствующие альдегиды, а альдегиды в карбоновые кислоты. Карбоновые кислоты в свою очередь могут быть восстановлены в соответствующие альдегиды, последние без труда могут быть превращены в спирты, т.е. часто неизогипсические трансформации обратимы. Однако подобная обратимость свойственна далеко не всем неизогипсическим трансформациям. Например, нитросоединения почти всегда возможно восстановить в соответствующие амины, тогда как окисление аминов в нитросоединения имеет ограниченное синтетическое значение. Удовлетворительные результаты прямого окисления аминов до нитросоединений достигаются для первичных аминов с аминогруппой у третичного атома углерода и ароматических аминов, содержащих электроноакцепторные заместители в орто- и пара- положениях, под действием смеси трифторуксусного ангидрида и перекиси водорода, как показано на схеме 1.4.
Схема 1.4 При планировании синтеза соединений сложной структуры решение отмеченных выше четырех типов задач, как правило, проводится одновременно, поэтому трудно дать однозначные рекомендации по последовательности их разрешения, однако представляется рациональным путем малых изменений целевой структуры создать ретрон, соответствующий мощному упрощающему трансформу, и далее осуществить этот трансформ. При синтезе хиральных соединений в энантиомерно чистом виде следует в первую очередь провести необходимые трансформы, направленные на расчленение целевой молекулы по хиральным центрам (стратегия трансформов) или, напротив, сохранить хиральные центры, с тем чтобы прийти к доступному хиральному соединению (стратегия хиральных темплатов).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 128; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.222.89 (0.033 с.) |