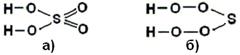Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обеспеченность стационарных химических связей тепловыми квантами.
При образовании молекулы из свободных атомов, ни у кого из них не должно остаться валентных электронов, незанятых в химических связях. При этом, работает феномен «направленных валентностей» у атомов: валентные электроны, будучи самыми внешними электронами в атоме, располагаются на его периферии не произвольным образом, а вполне определённым – при их количестве, большем единицы, они образуют т.н. валентные углы [П2]. Размеры атомов и наличие у них валентных углов задают некоторые геометрические ограничения на допустимые конфигурации молекул, которые могут образоваться из того или иного набора атомов. Но считается, что если физические условия благоприятны для образования химических связей, то любой незанятый валентный электрон одного атома может беспроблемно образовать химическую связь с любым незанятым валентным электроном другого атома – если это допустимо геометрически. Такой подход породил множество недоразумений, поскольку образование многих молекул, разрешённых геометрически и вполне допустимых по принципу простых комбинаций незанятых валентных электронов у пар атомов, оказывается чрезвычайно затруднено. Между тем, разгадка этих странностей прямо следует из нашей модели химической связи (8.3) – причём, ключевым фактором здесь является участие, в химической связи, кванта теплового возбуждения, который циклически перебрасывают друг другу связанные атомы. Чтобы образовалась химическая связь, она должна быть обеспечена тепловым квантом. Отсюда проистекает принцип: беспроблемно образуются те молекулы, в которых все химические связи обеспечены тепловыми квантами, бывшими у исходных атомов; образование же молекул с дефицитом обеспеченности химических связей тепловыми квантами – весьма маловероятно. Энергии тепловых квантов, которые имеются в атомах при тепловом равновесии, образуют сплошной планковский спектр. Обладателем теплового кванта может быть любая валентная связка «протон-электрон» (7.2). Если атом имеет несколько валентных электронов, то, в принципе, он может иметь столько же тепловых квантов – по одному на каждый валентный электрон. Но опыт показывает, что, в условиях теплового равновесия, независимо от количества валентных электронов, свободный атом имеет только один тепловой квант – приходящийся на самый внешний и, соответственно, самый слабо связанный валентный электрон. Об этом свидетельствует тот хорошо известный из спектроскопии факт, что у неионизированного атома именно самый слабо связанный электрон принимает на себя энергию теплового и светового возбуждения атома. С полной очевидностью на это указывает система квантовых уровней неионизированного атома – с верхним пределом, соответствующим энергии ионизации самого слабо связанного электрона. Если атом теряет этот электрон, то роль восприёмника энергии возбуждения переходит к следующему электрону, у которого энергия связи в образовавшемся ионе, опять же, минимальна. При этом система квантовых уровней радикально изменяется, и её верхний предел увеличивается – в соответствии с увеличившейся энергией ионизации.
Из того, что, в условиях теплового равновесия, атом даже с несколькими валентными электронами имеет только один тепловой квант, вытекают важные следствия. Можно сформулировать следующие правила обеспечения химических связей в молекуле. При вхождении в состав молекулы со стационарными химическими связями, атом обязан образовать столько связей, сколько валентных электронов он имеет. Но, в условиях теплового равновесия, лишь одну из этих связей он может обеспечить своим тепловым квантом. Остальные связи этого атома должны быть обеспечены тепловыми квантами других атомов, соединяющихся в молекулу. Ясно, что эти правила применимы, в равной степени, к каждому из атомов, соединяющихся в молекулу. Поэтому молекула беспроблемно получается тогда, когда эти правила выполняются сразу для всех атомов, из которых она образуется. Отношение числа тепловых квантов в исходных атомах (или, то же самое, числа самих исходных атомов) к числу химических связей в молекуле мы называем обеспеченностью связей h в этой молекуле. Приведём значения h для молекул некоторых веществ. Для насыщенных углеводородов, алканов, получаем h (СН4)=1.25, h (С2Н6)=1.14, и так далее – обеспеченность связей их молекул приближается сверху к единице по мере роста углеводородной цепочки. У молекул всех алкенов (С2Н4, С3Н6, и т.д.) обеспеченность связей тождественно равна единице. Для алкинов получаем h (С2Н2)=0.8, h (С3Н4)=0.88, и так далее – обеспеченность связей их молекул приближается снизу к единице по мере роста углеводородной цепочки. Для спиртов получаем h (СН3ОН)=1.2, h (С2Н5ОН)=1.13, и так далее – обеспеченность связей их молекул приближается сверху к единице по мере роста углеводородной цепочки. Для кислот получаем: h (H2SO4)=1.17, h (HNO3)=1.0, h (H3PO4)=1.14, h (H2CO3)=1.0, h (CH3COOH)=1.0, h (HCOOH)=1.0. У бензола h (С6Н6)=0.8, а у аммиака – h (NH3)=1.33.
Нет нужды ещё приводить примеры, список которых огромен – для стабильных химических соединений на стационарных связях, которые легко образуются без экстремально высоких температур и давлений, обеспеченность связей h равна или приблизительно равна единице. При этом, правила обеспечения связей в молекуле, сформулированные выше, выполняются автоматически – независимо от того, образуется ли молекула из отдельных атомов или из радикалов [Г9]. Знание об обеспеченности химических связей в молекулах позволяет, прежде всего, отбрасывать невероятные молекулярные конфигурации. Так, в учебниках [П2,Г10] утверждается, что молекула серной кислоты H2SO4 имеет структуру, изображённую на Рис.8.4.1 а). Такая структура больше соответствует щёлочи, а не кислоте, поскольку
Рис.8.4.1
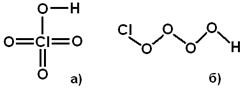
содержит два щёлочных радикала – две гидроксильные группы ОН. Но, главное, связи в такой молекуле не полностью обеспечены. Нам представляется более правдоподобной структура, изображённая на Рис.8.4.1 б). Здесь, во-первых, налицо два кислотных радикала, т.е. две гидропероксидные группы ООН, во-вторых, сера двухвалентна – как и во всех простых соединениях, где о её валентности можно судить однозначно – и, в-третьих, связи с избытком обеспечены: при шести связях на семь атомов, один тепловой квант оказывается даже «лишним». Ещё более показательными являются случаи молекул, в которых хлор, якобы, демонстрирует валентность, равную 7. Вот какую структуру, по мнению Полинга [П2], имеет молекула хлорной кислоты HClO4 (Рис.8.4.2 а)):
Рис.8.4.2
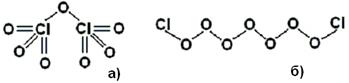
Учитывая, что во всех простых соединениях, где о валентности хлора можно судить однозначно, он демонстрирует валентность, равную единице, мы представляем молекулу хлорной кислоты так, как изображено на Рис.8.4.2 б). Такая структура, по сравнению с полинговской, выигрывает, опять же, и по свойству кислотности, и по стандартной валентности хлора, и по обеспеченности связей. Приведём ещё один пример – семиокиси хлора Cl2O7. Эта молекула, по мнению Полинга [П2], имеет монструозную структуру, изображённую на Рис.8.4.3 а).
Рис.8.4.3
Но гораздо проще и правдоподобнее выглядит структура, изображённая на Рис.8.4.3 б), которая, опять же, выигрывает по обеспеченности связей и по стандартной валентности хлора – особенно если учесть, что существуют и более низкие окислы хлора, Cl2O6 и Cl2O5 [П2], структуры молекул которых, на наш взгляд, отличаются от вышеприведённой нами структуры для Cl2O7 лишь укороченной кислородной цепочкой. Наш подход проще и прозрачнее по сравнению с тем, в котором различные мультиокислы хлора выдают за свидетельства о его различных «степенях окисления» - не давая никаких объяснений того, чем обусловлены эти различные «степени окисления».
А что говорит концепция обеспеченности химических связей о возможностях образования макромолекул из атомов с одинаковыми количествами валентных электронов? Одновалентные атомы, очевидно, могут образовывать, на стационарных связях, лишь двухатомные молекулы. Макромолекулы из двухвалентных атомов могут представлять собой лишь одномерные цепочки – которые могут быть замкнуты (как это бывает, например, у серы). Соединение пары трёхвалентных атомов (тройной связью) происходит уже с дефицитом обеспеченности связей. Чем больше трёхвалентных атомов, тем больше дефицит обеспеченности связей в молекуле из них – т.е. тем проблематичнее «замкнуть» свободные валентности в такой молекуле. На практике это означает, что макромолекулы на стационарных связях из трёхвалентных атомов самопроизвольно не образуются. Для макромолекул из четырёхвалентных атомов – ситуация с обеспеченностью связей ещё более катастрофическая. И, учитывая, что для образования трёхмерной атомной решётки, которая держалась бы исключительно на стационарных химических связях, требуется, как минимум, по три связи на атом, мы приходим к интересному выводу: невозможно самопроизвольное образование монокристалла, решётка которого поддерживалась бы только стационарными химическими связями, если эти связи формировались бы в условиях теплового равновесия, без обогащения атомов тепловыми квантами. Этот вывод, казалось бы, опровергается фактом существования алмазов – монокристаллов, в которых четырёхвалентные атомы углерода связаны только стационарными химическими связями. Но в том-то и дело, что в «обычных» условиях атомы углерода отнюдь не соединяются в кристаллы, они образуют неупорядоченные конгломераты – сажу, на свободные валентности которой быстро «садятся» активные радикалы из окружающей среды. Сажа – это именно та агрегация с участием атомов углерода, которая может получиться, когда формирование всех связей «углерод-углерод» невозможно из-за сильного дефицита тепловых квантов: в условиях теплового равновесия, лишь половина (!) этих связей оказывается обеспечена. О том, как образуются природные алмазы, в науке есть лишь гипотезы. Зато известно несколько способов получения синтетических алмазов. Казалось бы, эти способы настолько различаются, что не имеют какого-то общего для всех принципа. Но, на наш взгляд, общий принцип имеется: так или иначе, производится обогащение атомов углерода тепловыми квантами – отчего увеличивается, до необходимых значений, обеспеченность химических связей, которые должны формироваться при росте кристалла алмаза [Г9].
|
|||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 84; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.101.60 (0.011 с.) |