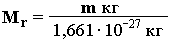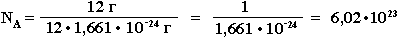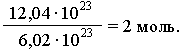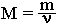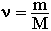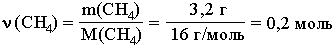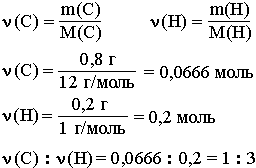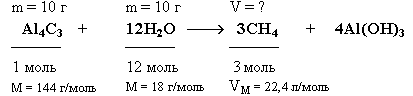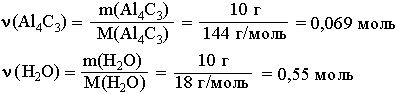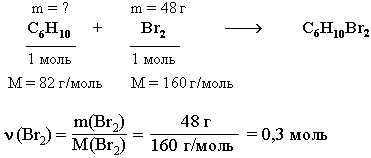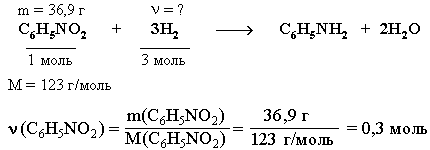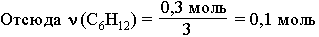Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Используемые при решении задачСтр 1 из 3Следующая ⇒
ВВЕДЕНИЕ
Химия является основой промышленных производств, требующих расчетов материального баланса: расхода сырья и энергии, количества продукции, потерь в процессе производства и т.д. Владение приемами расчетов химических процессов является важным для планирования и проведения их как в лабораторных, так и в заводских условиях. Поэтому при изучении химии большое внимание уделяется методам решения расчетных задач. Решение задач способствует также лучшему усвоению теории химических процессов. В данном методическом руководстве рассмотрены химические законы, необходимые для решения задач, разобраны основные типы задач, методика и примеры их решения. Приведены контрольные задачи для самостоятельной учебной работы. hotlog_js="1.0";hotlog_d=document; hotlog_n=navigator;hotlog_rn=Math.random(); hotlog_n_n=(hotlog_n.appName.substring(0,3)=="Mic")?0:1; hotlog_r=""+hotlog_rn+"&s=40106&im=102&r="+escape(hotlog_d.referrer)+"&pg="+ escape(window.location.href); hotlog_d.cookie="hotlog=1"; hotlog_r+="&c="+(hotlog_d.cookie?"Y":"N"); hotlog_d.cookie="hotlog=1; expires=Thu, 01-Jan-70 00:00:01 GMT" hotlog_js="1.1";hotlog_r+="&j="+(navigator.javaEnabled()?"Y":"N") hotlog_js="1.2";hotlog_s=screen; hotlog_r+="&wh="+hotlog_s.width+'x'+hotlog_s.height+"&px="+((hotlog_n_n==0)? hotlog_s.colorDepth:hotlog_s.pixelDepth) hotlog_js="1.3" hotlog_r+="&js="+hotlog_js; hotlog_d.write(" ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ, ИСПОЛЬЗУЕМЫЕ ПРИ РЕШЕНИИ ЗАДАЧ
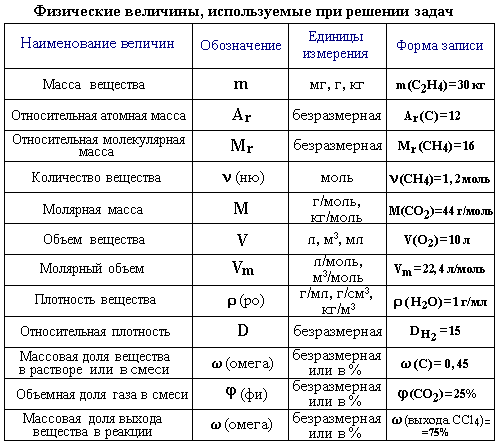
Для решения задач необходимо знание основных физических характеристик веществ (масса, объем, плотность) и параметров состояния реагирующей системы (температура, давление, концентрация веществ), а также единиц измерения этих величин. Выполнение расчетов основано на умении использовать взаимосвязи между физическими характеристиками и параметрами состояния, которые отражены в основных законах химии:
Для успешного решения задач необходимо владение навыками математических операций: составление и решение уравнений, неравенств, действия с числами и т.п.
Масса атомов и молекул
Для измерения масс атомов и молекул в физике и химии принята единая система измерения. Массы атомов и молекул измеряются в относительных единицах – атомных единицах массы.
Атомная единица массы (а.е.м.) равна 1/12 массы m атома углерода 12С (m одного атома 12С равна 1,993*10-26 кг).
Относительная атомная масса элемента (Ar) – это безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12С. При расчете относительной атомной массы учитывается изотопный состав элемента. Величины Ar определяют по таблице Менделеева.
Абсолютная масса атома (m) равна относительной атомной массе, умноженной на 1 а.е.м. Например, для атома водорода абсолютная масса определяется следующим образом: m (H) = 1,008*1,661*10-27 кг = 1,674*10-27 кг Относительная молекулярная масса соединения (Mr) – это безразмерная величина, равная отношению массы m молекулы вещества к 1/12 массы атома 12С:
Относительная молекулярная масса равна сумме относительных масс атомов, входящих в состав молекулы. Например: М r (C2H6) = 2* A r (C) + 6* A r (H) = 2*12 + 6 = 30. Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на 1 а.е.м. m (C2H6) = Mr (C2H6)*1,661*10-27 кг = 49,82*10-27 кг. Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное числу Авогадро (NA= 6,02*1023 моль-1).
Число Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
Таким образом, 1 моль вещества содержит 6,02 * 1023 частиц этого вещества. Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04*1023 молекул. Следовательно, количество вещества в этом образце составляет:
В общем виде:
где N - число частиц данного вещества; NA - число частиц в одном моле вещества (постоянная Авогадро). Молярная масса вещества (M) – масса одного моля этого вещества. По величине она равна относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar). Молярная масса имеет размерность г/моль. Например, молярная масса метана CH4 определяется следующим образом:
Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16 M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02*1023 молекул. Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе: m = ν* M.
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m. Пример
Вычислить массы метана CH4 и этана С2H6, взятых в количестве ν = 2 моль каждого. Решение
Молярная масса метана равна 16 г/моль, а этана С2Н6 – 30 г/моль. Отсюда: m (CH4) = 2 моль * 16 г/моль = 32 г; m (С2Н6) = 2 моль * 30 г/моль = 60 г.
Таким образом, моль - это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
ν(CH4) = ν(С2Н6), но m (CH4) < m (С2Н6)
Вычисление ν используется практически в каждой расчетной задаче. Концентрация вещества Концентрация – величина, характеризующая содержание вещества в единице массы или объема смеси.
Содержание вещества может быть выражено в единицах массы, количества вещества и объема. Наиболее распространенными способами выражения концентрации вещества являются массовая доля (ω), мольная и объемная доли (φ) и молярная концентрация (Сm).
2.4. Закон постоянства состава (Ж. Пруст, 1808) Состав соединений молекулярного строения, то есть состоящих из молекул, является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения. 2.5. Закон сохранения массы (М.В. Ломоносов, 1748) Алгоритм решения задач
Чтобы решить химическую задачу рекомендуется следующий порядок действий.
Таблица 3.1.
Решение
2. Количество углекислого газа согласно уравнению реакции равно количеству метана:
ν(CO2) = ν (CH4) = 0,2 моль
3. Определяем массу CO2:
m(CO2) = ν (CO2) * M(CO2) = 0,2 моль * 44 г/моль = 8,8 г Ответ: m(CO2) = 8,8 г Вывод формул соединений
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу. Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Целые числа (1 и 3) получены делением числа 0,2 на число 0,0666. Число 0,0666 примем за 1. Число 0,2 в 3 раза больше, чем число 0,0666. Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1:3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15. Тогда M(CxHy) = 15 M(H2) = 15*2 г/моль = 30 г/моль. Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6. Определение формулы вещества зависит от точности математических вычислений. При нахождении значения ν элемента следует учитывать хотя бы два – а лучше три! - знака после запятой и аккуратно производить округление чисел. Например, 0,8878 ~ 0,89 но не 1. Соотношение атомов в молекуле не всегда определяется простым делением полученных чисел на меньшее число. Рассмотрим этот случай на следующем примере. Задача 1. Установите формулу вещества, которое состоит из углерода (ω=25%) и алюминия (ω=75%).
Разделим 2,08 на 2. Полученное число 1,04 не укладывается целое число раз в числе 2,78 (2,78:1,04 = 2,67:1). Теперь разделим 2,08 на 3. При этом получается число 0,69, которое укладывается ровно 4 раза в числе 2,78 и 3 раза в числе 2,08. Следовательно, индексы x и y в формуле вещества AlxCy равны 4 и 3, соответственно.
Ответ: Al4C3 (карбид алюминия).
Более сложным вариантом задач на вывод формул соединений является случай, когда состав вещества задается через продукты сгорания этих соединений. Задача 2. При сжигании углеводорода массой 8,316 г образовалось 26,4 г CO2. Плотность вещества при нормальных условиях равна 1,875 г/мл. Найдите его молекулярную формулу.
3.6.2. Расчет массы (объема, количества) продуктов реакции при условии, что одно из реагирующих веществ взято в избытке Задача. Какой объем метана (н.у.) выделится при взаимодействии 10 г карбида алюминия (Al4C3) с 10 г воды?
Краткие условия:
Решение
1. Находим количества вступивших в реакцию веществ: 2.
Так как на 1 моль Al4C3 требуется в 12 раз большее количество вещества воды, то на 0,069 моль Al4C3 необходимо 0,828 моль воды. Следовательно, 0,55 моль воды недостаточно для реакции с 0,069 моль Al4C3, который взят в избытке и прореагирует не полностью. 2. Определим ν (CH4) по веществу, взятому в недостатке:
3. Рассчитаем объем метана, образовавшегося в реакции:
V(CH4) = ν (CH4)* Vm = 0,137 моль * 22,4 л/моль = 3,07 л Ответ: V(CH4) = 3,07 л
Задачи повышенной трудности
На олимпиадах предлагаются более сложные задачи, чем рассмотренные ранее. Обычно в них сочетаются различные типы расчетов – как по формулам веществ, так и по уравнениям реакций. Решение таких задач требует не только глубоких знаний химии, но и развитого логического мышления, владения алгебраическим аппаратом (системы уравнений с несколькими неизвестными, неравенства, степенные и логарифмические функции и т.п.). Рассмотрим решение одной из олимпиадных задач. Задача. При дегидрировании смеси циклогексана и циклогексена в бензол выделился водород массой, достаточной для полного восстановления 36,9 г нитробензола в анилин. Найти %-ный (по массе) состав исходной смеси, если известно, что такая же масса этой смеси может обесцветить 480 г 10%-ного раствора брома в CCl4.
1. Определим m(Br2) в растворе СCl4:
m(Br2) = m(раствора) *ω(Br2) = 480 г * 0,1 = 48 г
2. Из углеводородов исходной смеси с Br2 реагирует только циклогексен С6Н10, являющийся ненасыщенным соединением. По уравнению этой реакции рассчитаем массу С6Н10.
ν (С6Н10) = ν (Br2) = 0,3 моль m(C6Н10) = ν (С6 Н10) * M(С6 Н10) = 0,3 моль * 82 г/ моль = 24,6 г
ν (Н2) = 3*ν (С6Н5NO2) = 0,9 моль
Из уравнения (2) следует, что x = ν (H2) = 0,6 моль. Тогда количество водорода, выделившегося в реакции (1) равно:
ν (Н2) = 0,9 моль – 0,6 моль = 0,3 моль.
m(C6H12) = ν (C6H12) * M(C6H12) = 0,1 моль * 84 г/моль = 8,4 г
5. Определим массу исходной смеси углеводоров:
m(смеси) = m(C6H12) + m(C6H10) = 8,4 г + 24,6 г = 33,0 г
Ответ: ω (С6Н10) = 0,745 (74,5%) ω (С6Н12) = 0,255 (25,5%)
Примечание: знаком * отмечены задачи повышенной трудности
1. Какое количество вещества составляет 92 г этанола С2Н5ОН? 2. Определите массу глюкозы, содержащей 0,6 моль атомного углерода. 3. Определите массовую долю кислорода (в %) в метиловом спирте, состав которого выражен формулой СН3ОН. 4. Какой объем водорода (н.у.) может присоединить смесь газов массой 15,4 г, которая содержит этилен (ω = 54,5%), пропилен (ω = 27,3%) и бутилен (ω = 18,2%). 5. Природный газ одного из месторождений содержит метан (ω = 92%), этан (ω = 3%), пропан (ω = 1,6%), бутан (ω = 0,4%), азот (ω = 2%), другие газы (ω = 1%). Определите массу органических веществ, входящих в состав 20 л (н.у.) природного газа. 6. При сгорании алкана массой 3,6 г образуется оксид углерода (IV) объемом 5,6 л (н.у). Плотность алкана по водороду равна 36. Установите молекулярную формулу алкана. 7. Вывести молекулярную формулу вещества, если оно содержит С (ω = 39,97%), Н (ω = 6,73%) и О (ω = 53,3%) и 300 мл паров этого вещества (н.у.) имеют массу, равную 2,41 г. 8. Сколько г хлора потребуется для превращения 19 г бензола С6Н6 в гексахлоран С6Н6Сl6? 9. При нагревании иодметана СH3I массой 2,84 г с металлическим натрием массой 0,69 г получили этан С2Н6 объемом 179,2 мл при н.у. Определите объемную долю выхода продукта реакции. 10. Сколько граммов 80% - го технического карбида кальция CaC2 потребуется для получения 2,8 л ацетилена при н.у.? 11. Сколько граммов толуола С7Н8 потребуется для получения 113,5 г тринитротолуола С7Н5(NO2)3, если массовая доля выхода продукта составляет 80% от теоретически возможного? 12. Какую массу бромной воды с массовой доле брома 1,6% может обесцветить пропилен объемом 1,12 л (н.у.)? 13. Какой объем воздуха потребуется для сжигания 30 л ацетилена С2Н2 (н.у.), содержащего 5% негорючих примесей? Содержание кислорода в воздухе считать равным 20% по объему. 14. Сколько л водорода (н.у.) выделится при каталитическом дегидрировании 49 г метилциклогексана в толуол, если объемная доля выхода продукта равна 75% от теоретически возможного? 15*. При сгорании 13,44 л (н.у.) смеси монооксида углерода, метана и ацетилена образовалось 17,99 л СО2 (н.у.) и 9 г Н2О. Сколько литров каждого газа содержится в смеси? 16*. При взаимодействии 11,2 г алкена с бромоводородом получено 27,4 г вещества. Напишите формулы всех возможных изомеров алкена. 17*. Анализ смеси метана и ацетилена показал, что общее содержание углерода в смеси по массе равно 88, 46%. Определите состав смеси в % по массе. 18*. При сгорании 14,6 г хлорсодержащего органического вещества было получено 13,44 л СО2 и 3,6 г Н2О. Весь хлор, содержавшийся в навеске, вдвое меньшей, чем исходная, переведен в AgCl массой 14,3 г. Плотность по водороду исследуемого хлорорганического вещества равна 74. Определите молекулярную формулу этого вещества. 19*. Какой объем хлороводорода может прореагировать с 15 г смеси, состоящей из равных массовых долей триметиламина, пропиламина и метилэтиламина? 20*. При окислении одноатомного спирта массой 11,2 г кислородом воздуха в присутствии катализатора при 500°С образовалась кислота, на нейтрализацию которой потребовалось 59,4 мл 20% раствора КОН (d=1,18 г/мл). Какова формула исходного спирта?
ВВЕДЕНИЕ
Химия является основой промышленных производств, требующих расчетов материального баланса: расхода сырья и энергии, количества продукции, потерь в процессе производства и т.д. Владение приемами расчетов химических процессов является важным для планирования и проведения их как в лабораторных, так и в заводских условиях. Поэтому при изучении химии большое внимание уделяется методам решения расчетных задач. Решение задач способствует также лучшему усвоению теории химических процессов. В данном методическом руководстве рассмотрены химические законы, необходимые для решения задач, разобраны основные типы задач, методика и примеры их решения. Приведены контрольные задачи для самостоятельной учебной работы. hotlog_js="1.0";hotlog_d=document; hotlog_n=navigator;hotlog_rn=Math.random(); hotlog_n_n=(hotlog_n.appName.substring(0,3)=="Mic")?0:1; hotlog_r=""+hotlog_rn+"&s=40106&im=102&r="+escape(hotlog_d.referrer)+"&pg="+ escape(window.location.href); hotlog_d.cookie="hotlog=1"; hotlog_r+="&c="+(hotlog_d.cookie?"Y":"N"); hotlog_d.cookie="hotlog=1; expires=Thu, 01-Jan-70 00:00:01 GMT" hotlog_js="1.1";hotlog_r+="&j="+(navigator.javaEnabled()?"Y":"N") hotlog_js="1.2";hotlog_s=screen; hotlog_r+="&wh="+hotlog_s.width+'x'+hotlog_s.height+"&px="+((hotlog_n_n==0)? hotlog_s.colorDepth:hotlog_s.pixelDepth) hotlog_js="1.3" hotlog_r+="&js="+hotlog_js; hotlog_d.write(" ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ, ИСПОЛЬЗУЕМЫЕ ПРИ РЕШЕНИИ ЗАДАЧ
Для решения задач необходимо знание основных физических характеристик веществ (масса, объем, плотность) и параметров состояния реагирующей системы (температура, давление, концентрация веществ), а также единиц измерения этих величин. Выполнение расчетов основано на умении использовать взаимосвязи между физическими характеристиками и параметрами состояния, которые отражены в основных законах химии:
Для успешного решения задач необходимо владение навыками математических операций: составление и решение уравнений, неравенств, действия с числами и т.п.
Масса атомов и молекул
Для измерения масс атомов и молекул в физике и химии принята единая система измерения. Массы атомов и молекул измеряются в относительных единицах – атомных единицах массы.
Атомная единица массы (а.е.м.) равна 1/12 массы m атома углерода 12С (m одного атома 12С равна 1,993*10-26 кг).
Относительная атомная масса элемента (Ar) – это безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12С. При расчете относительной атомной массы учитывается изотопный состав элемента. Величины Ar определяют по таблице Менделеева.
Абсолютная масса атома (m) равна относительной атомной массе, умноженной на 1 а.е.м. Например, для атома водорода абсолютная масса определяется следующим образом: m (H) = 1,008*1,661*10-27 кг = 1,674*10-27 кг Относительная молекулярная масса соединения (Mr) – это безразмерная величина, равная отношению массы m молекулы вещества к 1/12 массы атома 12С:
Относительная молекулярная масса равна сумме относительных масс атомов, входящих в состав молекулы. Например: М r (C2H6) = 2* A r (C) + 6* A r (H) = 2*12 + 6 = 30. Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на 1 а.е.м. m (C2H6) = Mr (C2H6)*1,661*10-27 кг = 49,82*10-27 кг. Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное числу Авогадро (NA= 6,02*1023 моль-1).
Число Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
Таким образом, 1 моль вещества содержит 6,02 * 1023 частиц этого вещества. Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04*1023 молекул. Следовательно, количество вещества в этом образце составляет:
В общем виде:
где N - число частиц данного вещества; NA - число частиц в одном моле вещества (постоянная Авогадро). Молярная масса вещества (M) – масса одного моля этого вещества. По величине она равна относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar). Молярная масса имеет размерность г/моль. Например, молярная масса метана CH4 определяется следующим образом:
Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16 M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02*1023 молекул. Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе: m = ν* M.
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m. Пример
Вычислить массы метана CH4 и этана С2H6, взятых в количестве ν = 2 моль каждого. Решение
Молярная масса метана равна 16 г/моль, а этана С2Н6 – 30 г/моль. Отсюда: m (CH4) = 2 моль * 16 г/моль = 32 г; m (С2Н6) = 2 моль * 30 г/моль = 60 г.
Таким образом, моль - это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
ν(CH4) = ν(С2Н6), но m (CH4) < m (С2Н6)
Вычисление ν используется практически в каждой расчетной задаче. Концентрация вещества Концентрация – величина, характеризующая содержание вещества в единице массы или объема смеси.
Содержание вещества может быть выражено в единицах массы, количества вещества и объема. Наиболее распространенными способами выражения концентрации вещества являются массовая доля (ω), мольная и объемная доли (φ) и молярная концентрация (Сm).
2.4. Закон постоянства состава (Ж. Пруст, 1808)
|
|||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 121; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.176.81 (0.219 с.) |