Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос 2.Физические и химические свойства фенола. ⇐ ПредыдущаяСтр 3 из 3
Строение Фенола. Функциональная гидроксильная группа присуща не только спиртам, но и другому классу органических соединений, которые называют фенолами. У веществ этого класса гидроксил связан не с алкильным радикалом, а с фенилом, т.е. ароматическим радикалом. (Правило записать). Фенолы – это органические соединения, в молекулах которых радикал фенил связан с одной или несколькими гидроксильными группами. Простейший представитель этого класса органических соединений является фенол – С6 Н5ОН. Классификация и изомерия классификация и изомерия фенолов в зависимости от числа ОН-групп различают одноатомные фенолы (например, вышеприведенные фенол и крезолы) и многоатомные. Фенолам свойственна структурная изомерия (изомерия положения гидроксигруппы).
Физические свойства фенола Фенол представляет собой белые игольчатые кристаллы с характерным запахом, быстро розовеющие на воздухе в результате окисления. Он малорастворим в холодной воде, но неограниченно – в горячей. В медицине до сих пор используют исторически сложившееся название этого вещества – карболовая кислота.
Вопрос 3.Взаимное влияние атомов в молекуле фенола: взаимодействие с гидроксидом натрия и азотной кислотой. Рассмотрим как фенильная группа C6H5– и гидроксогруппа –ОН взаимно влияют друг на друга. Неподеленная электронная пара атома кислорода притягивается р-электронным облаком бензольного кольца, из-за чего связь в гидроксиле О–Н сильно поляризуется, поэтому фенол проявляется кислотные свойства сильнее, чем вода и спирты. Кислотные свойства у фенолов выражены ярче, чем у предельных спиртов. По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2,4,6. Это делает более реакционноспособными связи С-Н в положениях 2,4,6 или орто– и пара– положениях бензольного кольца.
1.Свойства фенола, обусловленные наличием гидроксогруппы (влияние бензольного кольца): ● С активными металлами (просмотр видеофрагмента) 2C6H5- OH + 2Na → 2C6H5- ONa + H2↑ фенолят натрия
● Со щелочами (просмотр видеофрагмента) C6H5- OH + NaOH (водн. р-р) ↔ C6H5- ONa + H2O ! Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой: C6H5-ONa + H2O + СO2 → C6H5-OH + NaHCO3 2.Свойства фенола, обусловленные наличием бензольного кольца (влияние гидроксогруппы). Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто - и пара- положениях (+ М -эффект ОН-группы):
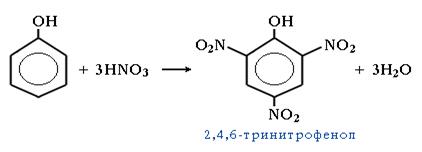
● Нитрование. При использовании концентрированной азотной кислоты образуется 2,4,6-тринитрофенол (пикриновая кислота): ● Гидрирование фенола
циклогексиловый спирт (циклогексанол)
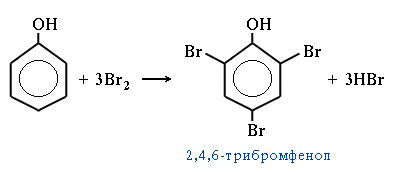
3.Качественные реакции на фенол: ● Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (просмотр видеофрагмента)
● Взаимодействие с хлоридом железа (III) – фиолетовое окрашивание (просмотр видеофрагмента) 6C6H5-OH + FeCl3 → [Fe(C6H5-OH)3](C6H5O)3 + 3HCl
FeCl3 - светло-жёлтый раствор [Fe(C6H5-OH)3](C6H5O)3 - фиолетовый раствор Вопрос 4.Применение фенола на основе его свойств.
|
|||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 156; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.247.5 (0.005 с.) |