Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Занятие № 1. Что такое химияСтр 1 из 23Следующая ⇒
Занятие № 1. Что такое химия Кейс
Попробуйте ответить на все эти вопросы.
Знаете ли вы, из чего сделан автомобиль? Нет, речь не о моторе, колесах и других деталях, а именно о том, из чего эти детали сделаны. О материале - что это и откуда взялось. Что общего между льдом и молоком, железным гвоздем, стальными ножницами и вашей кровью. Из чего состоят духи и как можно сделать краски? Почему листья растений летом зеленые, а осенью становятся желтыми и красными? На эти, и многие другие вопросы может ответить наука, которая называется химия. Химия относится к естественным наукам – это значит, что вы сталкиваетесь с тем, что изучает химия, даже не изучая ее. В самом деле – гвоздь, молоко, краски, пластмассы, вообще все вокруг, включая нас с вами – это именно то, что изучают ученые-химики. Они знают, как из черной густой нефти сделать бензин для наших автомобилей, из глины они могут сделать самолет. Из газа, который горит в газовой плитке, химики могут сделать пластмассу. Химики могут превратить сладкий сахар в кислый уксус. Но для того, чтобы разобраться, как они все это делают, cначала надо научиться говорить на их языке, иначе мы их просто не поймем. Как вы, наверное, уже догадались, химия изучает вещества, их свойства и превращения веществ из одних в другие. Но для начала нам надо выяснить – что же такое вещество. Вещество – то, из чего состоят физические тела. Бумага, из которой сделана книга, есть вещество, которое химик назовет целлюлозой. Из смеси различных веществ сделана краска, которой напечатаны буквы. Вода, налитая в стакан – тоже вещество, как и стекло, из которого сделан сам стакан. Какие вещества вы знаете? Напишите их названия: _______________________________________________________________________________________________________________________________ ______________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________ Давайте проверим, не путаете ли вы предметы и вещества. Что из перечисленного – предмет, а что - вещество? 1) стекло 2) стул 3) бутылка 4) древесина 5) гвоздь 6) книга 7) резина 8) железо 9) шина автомобиля 10) бумага Распределите по парам предмет и вещество, из которого он состоит:
Подсказка: про предмет можно сказать, что он из чего-то сделан, а про вещество - нет. Например – нож сделан из железа. А сказать, что железо сделано из ножа – нельзя. Практическая работа № 1 Наблюдение различных физических тел. 1. Перечислите и положите перед собой различные физические тела, которые находятся сейчас рядом с вами. 2. Из каких веществ изготовлены эти тела? 3. Какие тела находятся у вашего соседа? Из каких веществ они изготовлены? 4. Вспомните и назовите как можно больше физических тел, которые состоят из тех же веществ, что и тела, лежащие сейчас на столе. ________________________________________________________________________________________________________________________________________________________________________________________________
Демонстрационные опыты № 1 «Вулкан Беттгера» В 1843 году Рудольф Беттгер получил дихромат аммония – оранжево – красное кристаллическое вещество. Он решил испытать это вещество на способность взрываться от удара и воспламеняться от горящей лучины. Удар молотком на чугунной плите всего лишь превратил кристаллы дихромата аммония в порошок. Затем, насыпав на тарелку горку кристаллов, Беттгер поднес к ней горящую лучинку. Кристаллы не вспыхнули, но вокруг конца горящей лучинки что – то закипело, начали стремительно вылетать раскаленные частицы. Позднее было установлено, что дихромат аммония самопроизвольно разлагается не только от зажженной лучинки или спички, но и от нагретой стеклянной палочки.
Вулкан Беттгера (NH4)2Cr2O7 = Сr2O3 + N2↑ + 4H2O № 2 «Несгораемый платок» Вспомните волшебные предметы из сказок (ответы детей). Улетел наш ковер-самолет,
Опыт: смочить платок в смеси клея и воды (силикатный клей + вода = 1:1,5), слегка подсушить, затем смочить спиртом и поджечь. № 3 «Заживление раны» На столе три пузырька: «йод» (раствор FeCl3), «спирт» (KCNS), «живая вода» (NaF). Вот вам еще одно развлечение Кто дает руку на отсечение? Жаль руку на отсечение, Тогда нужен больной для лечения! (приглашается 1 обучающийся) Спиртом смажем мы обильно. («скальпель» - палочка, смоченная в FeCl3) Посмотрите, прямо струйкой Кейс
Правила выживания в химической лаборатории: · Если в руках у вас жидкое - не разлейте, порошкообразное - не рассыпьте, газообразное - не выпустите наружу. · Если включили - выключите. · Если открыли - закройте. · Если разобрали - соберите. · Если вы не можете собрать - позовите на помощь умельца. · Если вы не разбирали - не вздумайте собирать. · Если вы одолжили что-нибудь - верните. · Если вы пользуетесь чем-либо, держите в чистоте и порядке. · Если вы привели что-либо в беспорядок - восстановите статус кво. · Если вы сдвинули что-нибудь - верните на место. · Если вы хотите воспользоваться чем-либо, принадлежащим другому, попросите разрешения. · Если вы не знаете, как это действует, ради бога, не трогайте. · Если вас это не касается - не вмешивайтесь. · Если вы не знаете, как это делается - сразу спросите. · Если вы не можете что-либо понять - почешите в затылке. · Если вы горите на работе, постарайтесь, чтобы у вас ничего не загорелось. · Если не усвоили этих правил, не входите в лабораторию. Мальчики попросили листок и ручку, сформулировали основные правила техники безопасности и получили доступ в «мир чудес и превращений» - химический кабинет. Ход работы 1. Инструктаж по технике безопасности при работе с нагревательными приборами и со стеклянной посудой. 2. Выполните опыты. 3. Оформите таблицу
4. Приведите в порядок своё рабочее место.
II. Устройство и работа спиртовки Оборудование: спиртовка, спички. Ход работы: 1. Изучите строение и использование спиртовки; 2. Нарисуйте в тетради спиртовку, обозначив её составные части; 3. Изучите правила работы со спиртовкой;
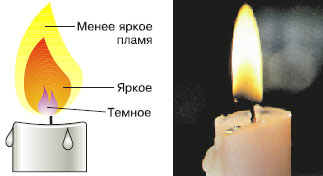
III. Строение пламени 1. Изучите строение пламени; 2. Рассмотрите пламя спиртовки, выделите три зоны: нижняя часть пламени – тёмная и самая холодная, средняя часть пламени – яркая, верхняя часть пламени – менее яркая, но с наиболее высокой температурой. 3. Внесите на короткое время в пламя лучинку так, чтобы она проходила через нижнюю часть пламени и по характеру обугливания определите, какая часть пламени имеет наибольшую температуру. 4. Сделайте выводы.
Кейс
Вскоре животным пришлось переходить речку. Осёл, навьюченный солью, остановился в воде и стал купаться: он то ложился в воду, то снова становился на ноги. Когда осёл вышел из воды, ноша его стала гораздо легче. Другой осёл, глядя на первого, тоже стал купаться. Но чем дольше он купался, тем тяжелее становилась навьюченная на него вата. Почему же ноша первого осла после купания стала легче, а второго тяжелее? Что произошло бы, если бы второй осёл нёс не вату, а сахар?
А чем похожи и чем отличаются предметы, состоящие из одних и тех же веществ? Что общего и в чем различие у ложки, металлических палочек и гвоздя, у стакана и стеклянной банки, у книги и салфетки? То, чем они схожи – не зависит от предмета, его формы, размера. И даже если мы разобьем стеклянную банку, то ее осколок будет иметь с ней общие свойства – хрупкость, блеск, прозрачность. Это – свойства вещества. А форма, размер – это свойства предмета. У веществ существует огромное количество самых разных свойств – какие-то из них вы легко можете увидеть сами, а какие-то будут понятны только химикам. Вещества могут быть похожи по своим свойствам, например по цвету или вкусу. Возьмем зеленый фломастер. Зеленый цвет его чернилам придает вещество зеленого цвета – краситель. Пластмасса, из которой он сделан, тоже окрашена веществом зеленого цвета, но уже другим. А зеленый цвет листьям придает третье зеленое вещество.
Сладким тоже бывает не только сахар. Сладкий вкус жевательной резинке дает ксилит. А больные диабетом вместо сахара используют фруктозу или другие подсластители. А еще сладкий вкус имеет так называемый свинцовый сахар. Но пробовать его не стоит – он ядовит. Вообще говоря, химики в своей лаборатории никогда не пробуют вещества на вкус, потому что не всегда точно известно – ядовито вещество или нет. Но раньше, больше ста лет назад, все было наоборот – химики должны были попробовать вещество на вкус и записать. Поэтому мы сейчас знаем вкус многих ядовитых веществ. И поэтому работа химика тогда считалась очень вредной и опасной. Ядовитость – это тоже свойство вещества. Но есть и более привычные для нас – запах, способность проводить электричество и тепло – электропроводность и теплопроводность, прозрачность, хрупкость, твердость… Еще одно важное свойство вещества – способность находиться в нескольких агрегатных состояниях – твердом, жидком и газообразном. Вода может быть твердой (лед), жидкой (вода) и газообразной – пар. Но для химика все это – одна и та же вода.
Хотя твердый лед и водяной пар совершенно непохожи друг на друга, тем не менее, с точки зрения химика – это одно вещество. Химические свойства в таких превращениях не меняются. Это физические превращения. Но химикам гораздо интересней, когда одно вещество превращается в одно или даже несколько других. Парафин свечи при нагревании плавится, и затем испаряется. Но если он остынет – то снова станет парафином. А когда свеча горит – парафин превращается в другие вещества – углекислый газ и воду. Такое превращение называется химической реакцией. С помощью химических реакций ученые-химики научились из темно-коричневого порошка – железной руды, делать железо, создали множество новых полезных веществ – пластики, лекарства, красители, синтетические ткани и многое другое.
Практическая работа № 4 «Изучение свойств веществ». 1. Насыпьте в стакан с водой чайную ложку сахарного песка и размешай его. Что происходит с крупинками песка? Куда они девались? Можно ли сказать, что сахарный песок исчез (попробуй воду на вкус). Изменился ли цвет воды, в которой ты размешал песок? Потеряла ли она прозрачность? 2. Проделайте с питьевой содой такой же опыт, какой ты ставил с сахаром. Растворяется ли в воде сода? 3. Аккуратно понюхайте предложенные учителем предметы, сделайте вывод. 4. Возьмите парафиновую свечу и подожгите ее. Понаблюдайте за тем, что происходит. (Парафин свечи при нагревании плавится, и затем испаряется. Но если он остынет – то снова станет парафином. А когда свеча горит – парафин превращается в другие вещества – углекислый газ и воду). 5. Сделайте выводы о веществах и их свойствах. Заполните таблицу – для каждого свойства отметьте – это свойство предмета или вещества
Вводное слово учителя
Иногда те вещества, которые составляют смесь, можно увидеть, как можно разглядеть в дыме твердые частички, или песок в воде с песком. А иногда частицы веществ, составляющих смесь, настолько сильно перемешаны, что сразу и не скажешь, что это не одно вещество – например, смесь уксуса с водой или морская вода. Такие смеси называются растворами. Но, независимо от того, можно увидеть вещества, составляющие смесь или нет, они всегда сохраняют свои свойства. И если эти свойства хотя бы в чем-то отличаются, то смесь можно разделить и получить чистые вещества. Кейс
Различные племена, предпочитают использовать для приготовления соли разные виды растений, например, папирус, некоторые травы, листья и кожуру бананов. Некоторые племена получают соль из золы сухих листьев, сжигаемых на земле, а точнее из смеси черной золы и частично обуглившихся листьев. Для экстрагирования солей в золу добавляют воду, которая растворяет соли, а затем подвергается фильтрованию. Для получения соли используется глиняный котел с отверстиями в нижней части. Эти отверстия изнутри покрывают полосками банановых листьев. В листьях прорезают щели, которые действуют как примитивный фильтр. Котел загружают золой, которую заливают холодной водой. Вода медленно просачивается через прорези в банановых листьях и стекает в поставленный снизу кувшин. Время от времени в котел добавляют воду и приминают золу. Полученный в результате соляной раствор сразу же используется для варки овощей. Задания: 1. Попробуйте придумать и нарисовать прибор, с помощью которого можно получить раствор соли из смеси в лабораторных условиях.
2. Составьте план разделения смеси двух твердых веществ: морского песка и поваренной соли. Мы знаем, что они отличаются по отношению к воде: соль растворяется, а песок – нет. 1. ______________________________________________________________________________________________________________________________________________________________________________________________ 2. _____________________________________________________________________________________________________________________________________________________________________________________________ ____________________________________________________________ Раствор - смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия.
Информационный материал: Воду с песком можно разделить с помощью фильтрования. Для этого нужно пропустить смесь через специальную бумагу или ткань – фильтр. Вода через него легко пройдет, а твердые частицы песка останутся на фильтре.
Кейс В XIX веке чрезвычайное интеллектуальное удовлетворение ученым доставило обнаружение смысла зеленой окраски растений. Оказывается, растения поглощают свет и поглощенную энергию используют для синтеза питательных веществ! Нужно было выделить и очистить пигменты зеленого листа – хлорофиллы. А они так близки по свойствам, что разделить их не удавалось. Михаил Семёнович Цвет является творцом этого метода анализа, открывшего широчайшие возможности для тонкого химического исследования.
(Трудно удержаться от улыбки: Цвет – хромос, хроматограмма – цветограмма.) Метод был так странно прост, что большая часть современников или не восприняла это удивительное открытие, или, что еще печальнее, резко восстала против его автора. Молчание длилось почти 30 лет... В 1944 году английские химики предложили подобный метод, который сейчас лежит в основе большинства достижений в науке и технике. Вопросы 1. Как называется данный метод? 2. Какие виды разделения данным методом известны? 3. В чем на ваш взгляд преимущества разделения таким методом веществ?
Представьте себе забег по пляжу. Длинная песчаная дорожка, в начале которой стоят бегуны. Вот только на некоторых из них кроссовки, на некоторых туфли с каблуками. Кто-то пришел на ходулях, а несколько человек надели ласты. Когда они побегут, то постепенно разделятся на группы, в первой будут люди в кроссовках, во второй – в туфлях, за ними прибегут те, кто надел ласты, а последними окажется группа людей на ходулях. В реальной жизни вы такое вряд ли увидите. Но представьте вместо людей молекулы. И получится новый способ разделения смесей веществ. Раньше мы говорили о таких способах, как перекристаллизация, фильтрование и других. Они известны человеку уже тысячи лет. Этому же методу чуть более ста лет. В 1900 году русский химик Михаил Цвет обнаружил, что если взять спиртовый раствор хлорофилла, который придает цвет зеленым листьям и отвечает в них за фотосинтез, и пропустить через трубку, набитую тонкоизмельченным порошком мела, то в трубке появятся цветные кольца разного цвета – желтого, зеленого, желто-зеленого, одно над другим. Оказалось, что хлорофилл – не одно вещество, а смесь, и ее можно разделить. Так придумали новый метод разделения веществ – хроматографию (с греческого хромос – цвет, а графос – писать, буквально – цветопись). Метод получился очень хороший и универсальный. С его помощью возможно разделять смеси самых разнообразных веществ, очищать вещества от примесей, причем в количествах самых разных – от десятков килограмм, до таких, что без лупы не разглядишь. Причем часто это смеси такие, что другими методами разделить их просто невозможно. Этот метод позволяет не только разделять смеси, но и узнавать – чистое вещество или смесь. И если это смесь – то, из каких веществ она состоит. И когда химики научились использовать этот метод, то стали исследовать те вещества, которые получили сами, и которые раньше получили другие химики. Оказалось, что чуть ли не половина из них вовсе не чистые вещества, как считали раньше, а содержат много примесей. А часть и вовсе оказались смесью разных веществ. Понятно, что свойства у таких грязных веществ сильно отличались от тех, которые должны были быть у чистых. Пришлось химикам переделывать свою работу.
А еще мы можем выяснить, из каких веществ состоит сложная смесь, например ароматическое масло, которое используется при изготовлении духов. И когда мы это выясним, то можем изготовить душистое вещество искусственно. А почему хроматография работает? Помните, о чем мы говорили в начале? О забеге по песку. С молекулами очень похожая ситуация, они по - разному взаимодействуют с «песком», который в хроматографии называется неподвижной фазой. Одни цепляются за нее сильнее, и поэтому движутся медленно, а другие, наоборот, почти не цепляются и проходят быстро. Как люди в кроссовках и на ходулях. И если сначала все молекулы стояли на старте вместе, то когда они начали «бежать» - над неподвижной фазой стал течь растворитель – молекулы одного вещества стали бежать быстрее, молекулы другого – медленней и к финишу они пришли в разное время. Так вещества разделились. Сейчас мы с вами попробуем провести хроматографию нескольких смесей. Хроматографа у нас нет, но это не беда, часто для хроматографии достаточно простой фильтровальной бумаги. Возьмем обычные фломастеры. Они бывают красные, синие, зеленые. Бывают и розовые, фиолетовые, салатные. В наборах по 8, 12, 18, 24 и даже 36 цветов. Делать для каждого цвета отдельный краситель не всегда удобно, поэтому иногда красители смешивают. Вы знаете, что если смешать синюю и желтую краску, то получится зеленый цвет. А если красную и синюю, то фиолетовый. А какие цвета надо смешать, чтобы получить розовый? Или, может быть, ничего не надо смешивать, а во фломастере краска розового цвета? Вот это мы сейчас и выясним. Кейс
Вопросы 1. Подумайте, что произошло в бочонках с белой краской? 2. Знаете ли вы другие способы получения пигментов для красок? 3. Назовите вещества, которые на ваш взгляд, могут быть пигментами красок? Представьте, что вы уронили на белоснежную скатерть клубнику. Неприятно, но теперь у вас есть, что ответить рассерженным родителям – вы не просто испачкали скатерть соком, вы произвели крашение ткани. Краски были с человеком все время его цивилизованной жизни. 40 000 лет назад люди были еще очень непохожи на нас, но они уже хотели рисовать. Даже пещерные люди умели рисовать картины, не уступающие современному искусству.
Но согласитесь – чем цветов больше, тем лучше. И постепенно человечество научилось делать краски самых разных цветов и оттенков, от красного до синего и фиолетового. Сложнее всего оказалось сделать синий цвет. Минералы такого цвета в природе встречаются нечасто. А хорошую краску – ультрамарин - можно приготовить только из азурита, причем подходит только такой, который добывают в Афганистане. Поэтому очень долго синяя краска стоила невероятно дорого, настолько, что все художники всей Европы в год тратили не больше трех килограмм ультрамарина. А небольшая банка такой краски считалась весьма ценным подарком. Неудивительно, что когда придумали как сделать искусственный ультрамарин, способ его приготовления долго держали в строжайшем секрете. Впрочем, химики уже давно раскрыли эти тайны и сейчас вы можете пойти в магазин и купить такой набор красок, на который в Средние века вы бы не заработали и за несколько жизней. Сегодня без красок сложно представить себе жизнь. Человек красит ткани, красит пластмассы, камень, металл и многое другое. Даже стекло оказалось возможным красить – красный цвет ему придают добавки золота, коричневый и зеленый – солей железа, а синее стекло можно получить, добавив при его изготовлении соли кобальта. Без красок наша жизнь станет невероятно серой и унылой. Краски, которые вы покупаете в магазине, имеют очень сложный состав. Но главная составляющая краски – это красящее вещество, иначе говоря, то, что придает ей цвет. Красящие вещества бывают разные. Они могут быть растворимыми, и тогда их зовут красителями. Красители чаще всего используются, чтобы окрасить ткань. Они могут быть природными или искусственными. В соке ягоды, которым вы окрасили скатерть, содержатся природные красители, поэтому она и красная. Если клубнику долго варить, то вода станет красной, а ягода практически бесцветной – весь краситель перейдет в воду. Природные красители обычно очень нестойки и изменяют цвет под действием воздуха – пятно от клубники на скатерти через несколько дней из красного станет бурым. А стойкие красители очень дорогие и редкие. В пурпурный цвет мантии римских императоров красили с помощью очень дорогого красителя, пурпура, который получали из моллюсков. А химики проанализировали его состав и придумали, как его сделать в лаборатории. Химия оказалась куда более могущественна, чем природа. Впрочем, сравнивать тут не совсем правильно, у природы не было задачи сделать красители для человека. Если же красящее вещество не растворяется, то его называют пигментом. Пигменты тоже бывают разные – природные, которые использовал еще пещерный человек – сажа, глина, цветные минералы и искусственные. Искусственных, или синтетических, гораздо больше. Это обычно нерастворимые неорганические или органические вещества. Проще всего получить желтый и зеленый цвета. Синий уже сложнее, и до сих пор в синих красках часто используют природные минералы. Наиболее сложным оказался, как ни странно, красный цвет. Чаще всего в красках используются оксиды железа, те самые, что впервые применил еще пещерный человек. Но у них тусклые цвета. Ярко-красная киноварь, которая используется профессиональными художниками – это сульфид ядовитой ртути. Поэтому современные красные пигменты часто имеют очень сложный химический состав. Один из зеленых пигментов, вошедших в историю – Швейнфуртский зеленый, названный так по имени немецкого города Швейнфурта, где его делали. Это очень красивое ярко-зеленое вещество, содержащее мышьяк и поэтому очень ядовитое. Но в XIX веке эта краска была очень модна и ее использовали, чтобы красить стены в доме. В то время не было обоев в том виде, какой сегодня для нас привычен и стены дома изнутри обивали тканью и эту ткань раскрашивали. Обои с такой краской были в доме, в котором жил Наполеон на Эльбе. И скорее всего из-за этой краски он и умер. Как вы догадываетесь, пигментов недостаточно, чтобы получить краску. Пигмент – это просто красивый порошок, к бумаге он не прилипнет. Чтобы получить то, чем можно рисовать, к пигменту надо добавить основу, которая приклеит его к бумаге. Найти такую основу было очень непросто. Она должна быть достаточно густой, чтобы краской можно было рисовать, бесцветной. Она должна легко растекаться на бумаге, но в то же время не промочить ее насквозь. Подбором основы для красок художники занимались сотни лет и у каждого мастера были свои, секретные рецепты. Ведь недостаточно подобрать хорошие пигменты. Если основа для краски плохая – хорошую картину не нарисуешь никогда. И когда сегодня ученые-реставраторы восстанавливают картины старых художников, пострадавшие от времени, им приходится иногда годами разгадывать секреты красок, даже имея в распоряжении современные лаборатории. А если не угадать рецепт – правильно восстановить картину не получится – цвета будут не похожи. Но у нас нет задачи восстановить рецепты старых мастеров, поэтому мы посмотрим из чего состоят обычные гуашевые краски. В качестве клея в рецепте используется гуммиарабик или декстрин. Гуммиарабик – это смола акации. Впрочем, акация далеко и вам проще всего найти похожую смолу на сливе или вишне, а декстрин – это особым образом обработанный крахмал. Для того чтобы краска лучше растекалась по бумаге мы добавим в ее состав сахар и глицерин. А бычья желчь не позволит краске расслаиваться.
Кейс
то взрывались, то пылали, то шипели, то сверкали, то в покое пребывали Алюминий, Натрий, Калий, Фтор, Бериллий, Водород… Перепутались все свойства, недалеко от беды. Вдруг команда: - Стройся, войско! – Стали строиться в ряды. Во втором ряду волненье: все боятся окисленья. – Поглядите! – злится Литий. – Фтор ужасный окислитель! Я не встану в этот ряд! Пусть другие здесь горят! – И Бериллий мрачно мыслит: - Кислород нас всех окислит! И, п
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 143; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.81.166 (0.098 с.) |
 Из чего сделаны мальчишки и девчонки, а также их родители? Из чего сделано все, что они носят в карманах, рюкзаках и сумочках, да и сами рюкзаки и сумочки? А папина машина в гараже, чайник на кухне, мамина косметика, бабушкины очки, сковородки шкатулки с пуговицами? А еще – диваны табуретки, ролики и туфельки, мобильники и бутылки из – под пепси? Кстати, а из чего состоит сама газировка и вообще все, что мы пьем и едим?
Из чего сделаны мальчишки и девчонки, а также их родители? Из чего сделано все, что они носят в карманах, рюкзаках и сумочках, да и сами рюкзаки и сумочки? А папина машина в гараже, чайник на кухне, мамина косметика, бабушкины очки, сковородки шкатулки с пуговицами? А еще – диваны табуретки, ролики и туфельки, мобильники и бутылки из – под пепси? Кстати, а из чего состоит сама газировка и вообще все, что мы пьем и едим?


 Два друга - пятиклассники Никита и Степан по дороге в школу нашли большой камень. Он был необычного сине – серого цвета и переливался на свету. Мальчишкам тут же захотелось узнать, из чего он состоит. Но учитель химии Елена Петровна сказала, что прежде чем приступать к исследованию веществ, неплохо было бы ознакомиться с правилами выживания в химической лаборатории, и дала листок со следующим текстом:
Два друга - пятиклассники Никита и Степан по дороге в школу нашли большой камень. Он был необычного сине – серого цвета и переливался на свету. Мальчишкам тут же захотелось узнать, из чего он состоит. Но учитель химии Елена Петровна сказала, что прежде чем приступать к исследованию веществ, неплохо было бы ознакомиться с правилами выживания в химической лаборатории, и дала листок со следующим текстом: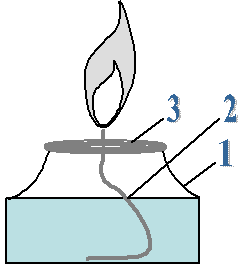
 Есть такая сказка. Два осла шли по дороге с кладью. Один был навьючен солью, а другой — ватой. Первый осёл едва передвигал ноги: так тяжела была его ноша. Второй — шёл весело и легко.
Есть такая сказка. Два осла шли по дороге с кладью. Один был навьючен солью, а другой — ватой. Первый осёл едва передвигал ноги: так тяжела была его ноша. Второй — шёл весело и легко. На этой фотографии вода есть и в твердом виде, и жидкая и газообразная. Большинство веществ могут находиться в этих трех состояниях, даже если мы и предположить этого не можем. Каждое вещество переходит из твердого в жидкое состояние (плавится) и из жидкого в газообразное (кипит) при строго определенных температурах. Вода плавится при 0°С и кипит при 100°С. А может ли расплавиться соль? Закипеть железо? Может ли воздух затвердеть? Оказывается, да. Чтобы расплавить обычную пищевую соль, ее нужно нагреть до 800°С, железо закипит при почти 3000 °С. Обычной газовой горелки, которую вы встретите на кухне, для этого не хватит – ей можно нагреть до 600 °С, не выше. А чтобы воздух затвердел, его нужно очень сильно охладить. При -196°С воздух станет жидким, а если он остынет еще на 14 градусов, до -210°С – то он будет твердым.
На этой фотографии вода есть и в твердом виде, и жидкая и газообразная. Большинство веществ могут находиться в этих трех состояниях, даже если мы и предположить этого не можем. Каждое вещество переходит из твердого в жидкое состояние (плавится) и из жидкого в газообразное (кипит) при строго определенных температурах. Вода плавится при 0°С и кипит при 100°С. А может ли расплавиться соль? Закипеть железо? Может ли воздух затвердеть? Оказывается, да. Чтобы расплавить обычную пищевую соль, ее нужно нагреть до 800°С, железо закипит при почти 3000 °С. Обычной газовой горелки, которую вы встретите на кухне, для этого не хватит – ей можно нагреть до 600 °С, не выше. А чтобы воздух затвердел, его нужно очень сильно охладить. При -196°С воздух станет жидким, а если он остынет еще на 14 градусов, до -210°С – то он будет твердым. На Земле таких температур не бывает, самая низкая температура, которую видели на Земле -89,2°C, так что у нас воздух не замерзнет. А вот на дальних от Солнца планетах – Сатурне, Нептуне – мы встретим океаны и моря из тех веществ, что у нас на Земле всегда существуют в виде газов.
На Земле таких температур не бывает, самая низкая температура, которую видели на Земле -89,2°C, так что у нас воздух не замерзнет. А вот на дальних от Солнца планетах – Сатурне, Нептуне – мы встретим океаны и моря из тех веществ, что у нас на Земле всегда существуют в виде газов. Давайте посмотрим вокруг. Мы увидим множество веществ, самых разнообразных. Вот только с точки зрения химика чистых веществ среди них очень мало. В обычной жизни вы можете встретить три чистых вещества – это вода, соль и сахар. А что же остальное? А остальное – это смеси веществ – молоко, соевый соус, морская вода, суп, дым из трубы, кофе – это все смеси нескольких, или даже многих веществ.
Давайте посмотрим вокруг. Мы увидим множество веществ, самых разнообразных. Вот только с точки зрения химика чистых веществ среди них очень мало. В обычной жизни вы можете встретить три чистых вещества – это вода, соль и сахар. А что же остальное? А остальное – это смеси веществ – молоко, соевый соус, морская вода, суп, дым из трубы, кофе – это все смеси нескольких, или даже многих веществ.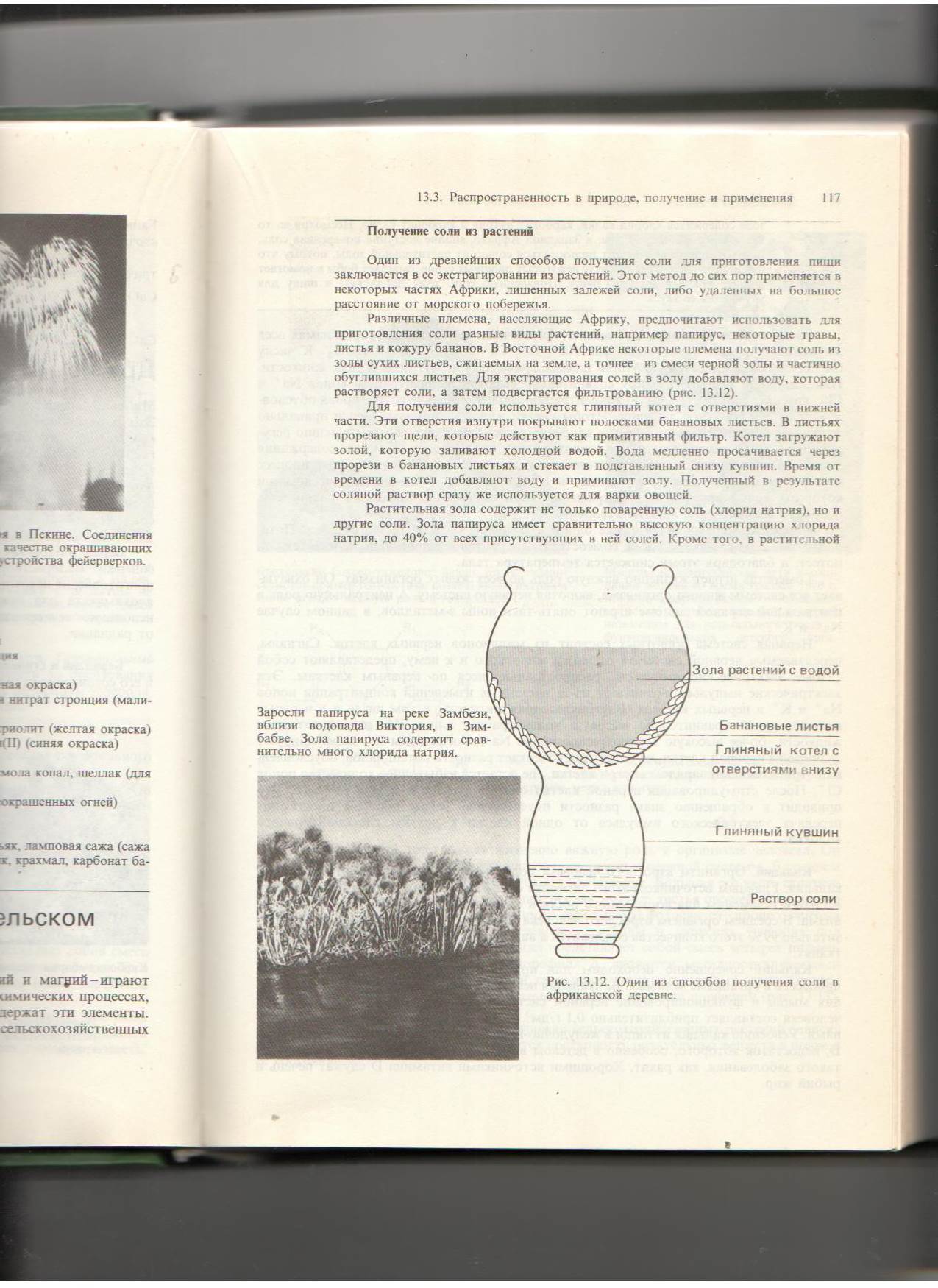 Один из древнейших способов получения соли для приготовления пищи заключается в ее экстрагировании из растений. Этот метод до сих пор применяется в некоторых частях Африки, лишенных залежей соли, либо удаленных на большое расстояние от морского побережья.
Один из древнейших способов получения соли для приготовления пищи заключается в ее экстрагировании из растений. Этот метод до сих пор применяется в некоторых частях Африки, лишенных залежей соли, либо удаленных на большое расстояние от морского побережья. Фильтрование - процесс разделения смесей при помощи фильтровальных перегородок, пропускающих жидкость или газ, но задерживающих твёрдые частицы.
Фильтрование - процесс разделения смесей при помощи фильтровальных перегородок, пропускающих жидкость или газ, но задерживающих твёрдые частицы.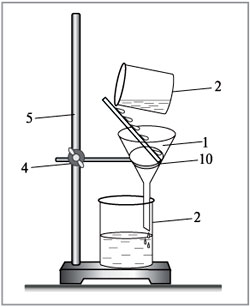 Точно так же можно отделить твердые частицы от газа в дыме, именно так очищает воздух от пыли пылесос. Но фильтрованием можно разделить не все смеси. Если мы возьмем морскую воду и пропустим через фильтр, то на фильтре ничего не останется, а вода так и будет горько-соленой. Значит, мы смесь не разделили. На море вы, скорее всего, видели налет соли на камнях. Дело в том, что вода испаряется гораздо легче соли и улетает. А соль остается. Значит, если мы нагреем морскую воду, то вода улетит, а соль останется. Так мы можем отделить соль от воды. Но в жизни часто возникает обратная задача – нужно очистить воду от соли. Такая вода нужна, например, для того, чтобы сделать процессор для компьютера и телефона. А нужна ли такая вода нам? Да. Пресной воды, или воды без солей, в природе не так много, большая часть доступной нам воды – соленая, которая не подходит ни для питья, ни для стирки, ни для мытья посуды. Значит, нам надо придумать, как от этой соли избавиться. Помните, чуть выше мы говорили, что если соленую воду нагреть, то вода улетит, а соль останется. Значит, мы уже можем отделить воду от соли. Но вода получится в виде пара, который нужно собрать и охладить, чтобы получить чистую воду.
Точно так же можно отделить твердые частицы от газа в дыме, именно так очищает воздух от пыли пылесос. Но фильтрованием можно разделить не все смеси. Если мы возьмем морскую воду и пропустим через фильтр, то на фильтре ничего не останется, а вода так и будет горько-соленой. Значит, мы смесь не разделили. На море вы, скорее всего, видели налет соли на камнях. Дело в том, что вода испаряется гораздо легче соли и улетает. А соль остается. Значит, если мы нагреем морскую воду, то вода улетит, а соль останется. Так мы можем отделить соль от воды. Но в жизни часто возникает обратная задача – нужно очистить воду от соли. Такая вода нужна, например, для того, чтобы сделать процессор для компьютера и телефона. А нужна ли такая вода нам? Да. Пресной воды, или воды без солей, в природе не так много, большая часть доступной нам воды – соленая, которая не подходит ни для питья, ни для стирки, ни для мытья посуды. Значит, нам надо придумать, как от этой соли избавиться. Помните, чуть выше мы говорили, что если соленую воду нагреть, то вода улетит, а соль останется. Значит, мы уже можем отделить воду от соли. Но вода получится в виде пара, который нужно собрать и охладить, чтобы получить чистую воду.  Но за стаканом идти еще рано, пить эту воду не стоит, мы ее слишком хорошо очистили. Мы убрали из воды все соли, а человеку, оказывается, немного солей в воде для питья нужно. Так что перед тем, как ее пить, в такой очищенной воде надо растворить немного солей. Установки для такой очистки воды называются опреснителями и часто ставятся на кораблях, чтобы им не нужно было часто заходить в порт за пресной водой. А большие опреснители способны снабжать водой целый город.
Но за стаканом идти еще рано, пить эту воду не стоит, мы ее слишком хорошо очистили. Мы убрали из воды все соли, а человеку, оказывается, немного солей в воде для питья нужно. Так что перед тем, как ее пить, в такой очищенной воде надо растворить немного солей. Установки для такой очистки воды называются опреснителями и часто ставятся на кораблях, чтобы им не нужно было часто заходить в порт за пресной водой. А большие опреснители способны снабжать водой целый город. Михаил Семенович Цвет бился над задачей разделения пигментов зеленого листа. Он взял стеклянную трубку, наполнил ее порошком мела и на верхний слой налил немного спиртового экстракта листьев. Экстракт был буро-зеленого цвета, и такого же цвета стал верхний слой меловой колонки. А затем Михаил Семенович начал по каплям лить сверху в трубку с мелом чистый спирт. Капля за каплей очередная его порция растворяла пигменты с крупинок мела, передвигаясь вниз по трубке. В результате в столбике мела получались однородные окрашенные полосы чистых веществ. Это было прекрасно. Ярко-зеленая полоса, полоса чуть желтее зеленого – это два вида хлорофиллов и яркая желто-оранжевая полоса каротиноидов. Цвет назвал эту картину хроматограммой.
Михаил Семенович Цвет бился над задачей разделения пигментов зеленого листа. Он взял стеклянную трубку, наполнил ее порошком мела и на верхний слой налил немного спиртового экстракта листьев. Экстракт был буро-зеленого цвета, и такого же цвета стал верхний слой меловой колонки. А затем Михаил Семенович начал по каплям лить сверху в трубку с мелом чистый спирт. Капля за каплей очередная его порция растворяла пигменты с крупинок мела, передвигаясь вниз по трубке. В результате в столбике мела получались однородные окрашенные полосы чистых веществ. Это было прекрасно. Ярко-зеленая полоса, полоса чуть желтее зеленого – это два вида хлорофиллов и яркая желто-оранжевая полоса каротиноидов. Цвет назвал эту картину хроматограммой. Сейчас ученые создали приборы – хроматографы, которые используются для анализа самых разных веществ и смесей, например при производстве лекарств. Лекарства – это химические вещества, которые обычно очень сложно синтезировать. И эти вещества должны быть очень чистыми, чтобы примеси не навредили нашему организму. И вот тут на помощь приходит хроматография. С помощью хроматографа химик может проконтролировать – правильно ли идет реакция, прошла ли полностью, или надо еще подождать.
Сейчас ученые создали приборы – хроматографы, которые используются для анализа самых разных веществ и смесей, например при производстве лекарств. Лекарства – это химические вещества, которые обычно очень сложно синтезировать. И эти вещества должны быть очень чистыми, чтобы примеси не навредили нашему организму. И вот тут на помощь приходит хроматография. С помощью хроматографа химик может проконтролировать – правильно ли идет реакция, прошла ли полностью, или надо еще подождать.  Однажды в Афинском порту Пирее, где стоял корабль с грузом свинцовых белил, вспыхнул пожар. Поблизости в этот момент находился художник Никий. Зная, что на горящем корабле имеются краски, он поднялся на него в надежде спасти хотя бы один бочонок. Краски тогда стоили дорого, да и достать их было порой нелегко. К удивлению Никия, в обуглившихся бочонках он увидел не белила, а какую – то густую массу ярко – красного цвета. Схватив один из бочонков, художник покинул корабль и поспешил в свою мастерскую. Содержимое бочонка оказалось отличной краской. Впоследствии ее называли суриком (Pb 3 O 4) и стали получать пережигая свинцовые белила.
Однажды в Афинском порту Пирее, где стоял корабль с грузом свинцовых белил, вспыхнул пожар. Поблизости в этот момент находился художник Никий. Зная, что на горящем корабле имеются краски, он поднялся на него в надежде спасти хотя бы один бочонок. Краски тогда стоили дорого, да и достать их было порой нелегко. К удивлению Никия, в обуглившихся бочонках он увидел не белила, а какую – то густую массу ярко – красного цвета. Схватив один из бочонков, художник покинул корабль и поспешил в свою мастерскую. Содержимое бочонка оказалось отличной краской. Впоследствии ее называли суриком (Pb 3 O 4) и стали получать пережигая свинцовые белила. Но для того, чтобы рисовать, нужны краски. А тогда купить их в магазине было невозможно, поскольку магазинов не было. И пещерному человеку пришлось обходиться тем, что есть под рукой. Горит костер, сажа садится на стены пещеры – вот и черная краска. А в обрыве у ближайшей речки обнаружилась глина белого или оранжевого цвета. В общем, оказалось, что если хорошенько посмотреть вокруг, то обязательно найдется, чем порисовать. Разнообразие цветов, конечно, невелико – черный, красный, желтый, оранжевый, да оттенки коричневого, но хорошему художнику и этого хватит. А хорошим художник бывает независимо от того – в шкуре он или в брюках.
Но для того, чтобы рисовать, нужны краски. А тогда купить их в магазине было невозможно, поскольку магазинов не было. И пещерному человеку пришлось обходиться тем, что есть под рукой. Горит костер, сажа садится на стены пещеры – вот и черная краска. А в обрыве у ближайшей речки обнаружилась глина белого или оранжевого цвета. В общем, оказалось, что если хорошенько посмотреть вокруг, то обязательно найдется, чем порисовать. Разнообразие цветов, конечно, невелико – черный, красный, желтый, оранжевый, да оттенки коричневого, но хорошему художнику и этого хватит. А хорошим художник бывает независимо от того – в шкуре он или в брюках. То кружились, то мелькали, то водили хоровод,
То кружились, то мелькали, то водили хоровод,