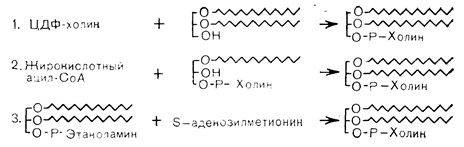Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фосфолипиды: структура, метаболизм и функция
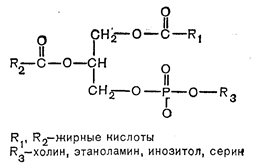
Рис. 4—20. Общая структура фосфолипидов.
Природные фосфолипиды являются производными глицерофосфата или сфингозинфосфата, содержащими две жирные кислоты и гидрофильный заместитель, такой, как холин, этаноламин, инозитол или серин. Они служат главными составными частями липопротеинов и клеточных мембран и в большом количестве присутствуют в периферической нервной ткани и головном мозге. Фосфоглицериды обладают общей структурой (рис. 4—20), образующейся путем эстерификации глицерофосфата с двумя длинноцепочечными жирными кислотами и гидрофильным компонентом. Важной особенностью фосфолипидов является их способность взаимодействовать как с гидрофобными, так и с гидрофильными доменами и занимать поверхность раздела между органическими и водными средами. Так, в липопротеинах они выступают в роли связующего звена между белковой частью и транспортируемым нейтральным липидом, а в клеточной мембране они образуют характерный липидный бислой, который ограничивает внутриклеточное пространство. В плазматической мембране около 60% фосфолипидов приходится на долю фосфатидилхолина, который частично синтезируется в самой мембране путем метилирования фосфатидилинозитола. Фосдатидилинозитол и фосфатидилсерин присутствуют в меньших количествах, причем жирокислотные заместители в разных тканях варьируют по длине и степени насыщенности. Фосдатидилхолины, или лецитины, синтезируются в животных тканях тремя путями. В ходе основного пути, аналогичного таковому для синтеза фосфатидилинозитола, холин фосфорилируется АТФ, образуя фосфохолин. Последний соединяется с ЦТФ, превращаясь в ЦДФ-холин, который реагирует с диацилглицерином в присутствии фосфохолинтрансферазы, образуя фосфатидилхолин. Второй путь синтеза фосфатидилхолина заключается в ацилировании лизофосфатидилхолина (образующегося при гидролизе лецитина фосфолипазой А). Наконец, 3-й путь, имеющий особенное отношение к современным исследованиям гормональных влияний на фосфолипиды мембраны, сводится к последовательному метилированию фосфатидилэтаноламина в клеточной мембране. Эти реакции в схематическом виде представлены на рис. 4—21.
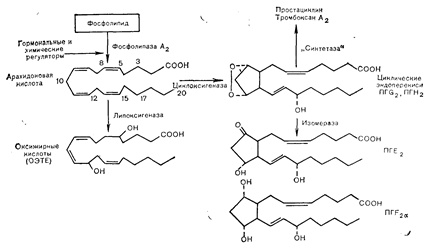
Гормональные влияния на метаболизм фосфолипидов. Стимуляция образования арахидоновой кислоты и синтеза простагландинов.
Многие пептидные гормоны повышают продукцию простагландинов тканью-мишенью, что иногда сопровождается вторичными реакциями сосудов и клеток. Хотя простагландины, по-видимому, не играют роли медиаторов действия пептидных гормонов, но стимуляция этих местно образующихся тканевых гормонов при активации клеток-мишеней составляет важный компонент клеточной реакции на взаимодействие пептидных гормонов с их рецепторами [57]. Простагландины и родственные им простациклины и тромбоксаны быстро синтезируются из полиненасыщенных жирных кислот—предшественников, особенно из арахидоновой кислоты, при стимуляции клеток-мишеней. Ненасыщенные жирные кислоты присутствуют в клетке в виде фосфоглицеридов, которые для того, чтобы превратиться в субстрат для метаболизма в простагландины и другие активные интермедиаты, должны деацилироваться под действием фосфолипаз. На долю арахидоновой кислоты приходится наибольшее количество ненасыщенных жирных кислот в тканевых фосфолипидах; эта кислота подвергается метаболизму в двух основных направлениях, называемых циклооксигеназным и липооксигеназным. Ближайшими продуктами циклооксигеназного пути являются эндоперекиси (ПГG2 и ПГН2), которые превращаются в простагландины (ПГЕ2, ПГF2a и ПГD2) под действием ферментов, носящих общее название простагландинсинтетазы, а также в тромбоксаны (ТКА2 и ТКВ2) и простациклины (ПГI2) под действием соответствующих синтетаз (рис. 4—22). Классификация этих метаболитов эндоперекисей связана со степенью ненасыщенности их жирокислотных предшественников; эйкозатетраеновая кислота превращается в продукты 1-го класса (ПГЕ1, ПГF1a, TKA1 и др.), а арахидоновая кислота—в продукты 2-го класса (ПГЕ2, ПГF2a, ТКА2, ТКВ2 и ПГI2) [58].
Рис. 4— 21. Пути биосинтеза фосфатидилхолина.
Тромбоксаны и простациклины также образуются при дальнейшем метаболизме эндоперекисей, появляющихся в ходе циклооксигеназного пути; они представляют собой важные регуляторы взаимодействий тромбоцитов с сосудистой стенкой. Простациклин (ПГI2) в больших количествах продуцируется эндотелиальными и гладкомышечными клетками сосудов, где его образование модулируется гидроперекисными метаболитами липооксигеназного пути [59]. ПГI2 является высокоактивным ингибитором агрегации тромбоцитов, а его продукция в эндотелиальных клетках стимулируется тромбином и тормозится липопротеинами низкой плотности. Имеются также данные, свидетельствующие о возможной роли снижения способности гладкомышечных клеток сосудов продуцировать ПГI2 в развитии атеросклероза.
Позднее обнаруженный липооксигеназный путь обусловливает превращение арахидоновой кислоты в оксижирные кислоты, в том числе в гидропероксиэйкозатетраеновую кислоту (ГПЭТЕ), которая затем разрушаясь превращается в оксиэйкозатетраеновую кислоту (ОЭТЕ). Эти метаболиты липооксигеназного пути играют существенную роль в воспалительных реакциях, в том числе хемотаксисе нейтрофилов и других следствиях активации циклооксигеназы в тромбоцитах и продукции ПГI2 в ткани сосудов. Недавно полученные данные свидетельствуют также о том, что липооксигенированные метаболиты арахидоновой кислоты могут опосредовать действие ГнРГ на высвобождение гормонов гипофизарными гонадотрофами [60].
Рис. 4— 22. Образование и метаболизм арахидоновой кислоты. Ненасыщенная жирная кислота, высвобождаемая фосфолипазой А2 из мембранных фосфолипидов, превращается в активные производные в ходе липоксигеназного, циклоксигеназного и простагландинсинтетазного ферментативных процессов.
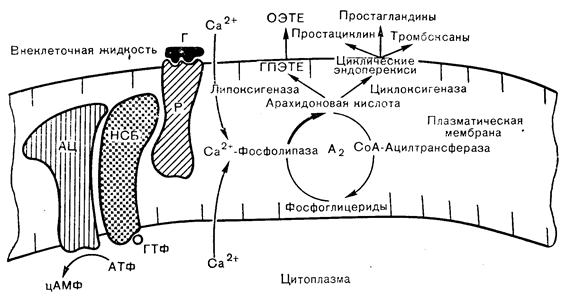
Любой из перечисленных путей продукции активных метаболитов арахидоновой кислоты зависит от адекватного поступления ненасыщенного жирокислотного предшественника из мембранных фосфолипидов. В настоящее время известно, что многие формы опосредованной рецепторами активации клеток сопровождаются повышением активности связанных с мембранами фосфолипаз, которые катализируют гидролиз эфирных связей в глицерофосфолипидах. Наиболее важна в этом отношении фосфолипаза А2, отщепляющая жирные кислоты во 2-м положении диацилглицерофосфолипидов, которая образует лизофосфолипид и ненасыщенную жирную кислоту, обычно арахидонат. Деацилированный фосфолипид быстро реацилируется за счет переноса активированной СоА жирной кислоты, что легко можно измерить по включению меченой арахидоновой кислоты в фосфолипиды клеток. Этот кругооборот глицерофосфолипида служит источником арахидоновой кислоты для метаболизма по цикло- и липооксигеназному путям (рис. 4—23) и может влиять на проницаемость мембраны и активность других связанных с мембраной ферментов [61]. Активация фосфолипазы А2 зависит от кальция; она происходит при стимуляции клеток надпочечников АКТГ, что приводит к ускорению кругооборота арахидонилфосфатидилинозитола [62]. Этот эффект вызывается также кальциевым ионофором А23187 и может отражать повышение внутриклеточного уровня кальция при действии АКТГ и вторичной стимуляцией фосфолипазы А2 в качестве ранней реакции, сопутствующей АКТГ-рецепторному взаимодействию. Известно, что действие АКТГ на стероидогенез в надпочечниках зависит от кальция, а не только от образования цАМФ. По крайней мере, часть потребностей в кальции для действия АКТГ может быть связана с опосредуемым фосфолипазой A2 кругооборотом мембранных фосфолипидов при активации коры надпочечников.
Рис. 4—23. Кругооборот фосфоглицеридов в плазматической мембране с эффектами опосредованного рецепторами (Р) потока кальция на фосфолипазу А2 и продукцию арахидоновой кислоты. ОЭТЕ — оксиэйкозатетраеновая кислота: Г — гормон; АЦ — аденилатциклаза НСБ — нуклеотид связывающий белок; ГПЭТЕ — гидропероксиэйкозатетраеновая кислота.
Хотя механизм, включающий активацию фосфолипазы, может отражать общее свойство гормонрегулируемых секреторных клеток, при гормональной стимуляции специфических клеток-мишеней меняются и другие этапы метаболизма фосфолипидов. Так, в клетках гранулемы яичника, где ЛГ увеличивает продукцию простагландинов, гормон не повышает образование арахидоновой кислоты, а действует на более поздних этапах, увеличивая активность простагландинсинтетазы [63]. Этот эффект Л Г на синтез простагландинов в граафовом фолликуле (пузырчатый яичниковый фолликул), по-видимому, не опосредует стероидогенного действия гонадотропина, но играет важную роль в развитии овуляции [64].
Стимуляция кругооборота фосфатидилинозитола и образования полифосфоинозитидов. Инозитоловые фосфолипиды составляют небольшую, но важную часть фосфолипидов плазматической мембраны в большинстве эукариотических клеток. Главным инозитоловым липидом в большинстве клеток является фосфатидилинозитол (ФИ), в котором миоинозитол присоединен к диэфирной фосфатной группе диацилглицеринового скелета. Полифосфоинозитиды (ди- и трифосфоинозитолы), содержащие моно- или дважды фосфатированные гидроксильные группы пнозитола, присутствуют в плазматической мембране в меньших количествах. Инозитоловые фосфолипиды превращаются друг в друга под действием АТФ-зависимых киназ и фосфомоноэстераз и разрушаются фосфодиэстеразами до инозитолфосфатов и диацилглицерина. Уже в течение нескольких лет известно, что при стимуляции секреторных клеток усиливается метаболизм ФИ с увеличением включения радиоактивного фосфата и инозитола в ФИ и его предшественник фосфатидат. В настоящее время установлено, что эта реакция отражает распад и ресинтез ФИ и, как постулировал Nichell [65], является общим следствием взаимодействия между лигандами и рецепторами клеточной поверхности. Позднее выяснилось, что эта реакция характеризует гормонрецепторные взаимодействия, приводящие к повышению внутриклеточной концентрации кальция.
Реакция ФИ часто не зависит от внеклеточной и внутриклеточной концентрации кальция и представляется общим процессом, сопутствующим активации рецепторов, приводящей к притоку или мобилизации кальция и повышению его концентрации в цитозоле. Отсюда было сделано предположение, что распад ФИ принимает участие в общем механизме, с помощью которого активация рецепторов клеточной поверхности контролирует мобилизацию кальция [65]. Повышение концентрации кальция в цитоплазме могло бы определяться увеличением проницаемости плазматической мембраны или высвобождением кальция из запасов в плазматической мембране или митохондриях. До сих пор в стимулируемых гормонами тканях отмечали отчетливую корреляцию между реакцией ФИ и мобилизацией кальция. В отличие от этого было показано, что некоторые гормоны, которые повышают внутриклеточный уровень цАМФ, но не кальция, практически не влияют на метаболизм фосфоинозитидов. Таким образом, реакция ФИ — это не просто общий ответ клеток на активацию их поверхностных рецепторов, но, по-видимому, характерная особенность стимулов, для которых мобилизация кальция является существенным компонентом реакции клеток-мишеней [65]. Дополнительной особенностью гормонрецепторных взаимодействий, обусловливающих реакцию ФИ, является повышение активности гуанилатциклазы и уровня цГМФ в клетке. Как уже отмечалось, это, вероятно, представляет собой следствие повышения внутриклеточной концентрации кальция, а не необходимый этап процесса активации, который вызывает характерную реакцию клетки-мишени на гормональную стимуляцию. Хотя между реакцией ФИ и мобилизацией кальция при активации многих клеточных рецепторов наверняка существует тесное сопряжение, природа связи между этими процессами пока не ясна. По всей вероятности, опосредование рецепторами кругооборота ФИ происходит в плазматической мембране клетки, в результате чего и увеличивается проницаемость для кальция и/или высвобождение кальция в цитоплазму. Стимулируемый гормоном распад ФИ мог бы являться важным компонентом некоторых механизмов, связанных с активацией рецепторов, вызывая открытие кальциевых каналов на клеточной поверхности, а также модулируя эффекты других рецепторов, которые активируют аденилатциклазу [65]. Другой важный аспект метаболизма ФИ связан с возможной ролью полифосфоинозитидов в действии пептидных гормонов. Эти сильно заряженные липиды подвергаются быстрому метаболическому кругообороту, особенно в головном мозге, и ускоряют свой распад при стимуляции a-адренергических и мускариновых рецепторов. В отличие от реакции ФИ, эти изменения зависят от уровня кальция и могут представлять собой вторичные ответы на повышение его концентрации в цитозоле подобно общему изменению активности гуанилатциклазы [28]. Потенциальная роль полифосфоинозитидов в действии гормонов установлена для коры надпочечников, в которой АКТГ остро повышает содержание дифосфо-и трифосфоинозитидов. Эти эффекты воспроизводятся и цАМФ, причем, как и эффекты АКТГ, они блокируются ингибиторами синтеза белка. Добавление дифосфоинозитида к надпочечниковым митохондриям или изолированным клеткам повышает продукцию прегненолона и кортикостерона, что свидетельствует об опосредующей роли полифосфоинозитидов в стимуляции стероидогенеза в надпочечниках под влиянием АКТГ и цАМФ [66].
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 672; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.221.19 (0.02 с.) |