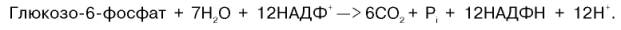Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пентозофосфатный путь(ПФП) окисления УВ
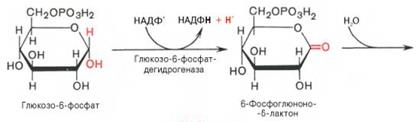
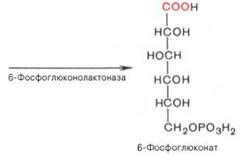
Расхождение пентозофосфатного пути – нач-тся со стадии обр-ния гексозомонофосфата. Если глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат, к-рый фосфо-рилируется второй раз и превращается во фруктозо-1,6-бисфосфат, то в этом случае дальнейший распад УГов происходит по обычному гликолитическому пути с обр-нием пировиноградной к-ты, к-рая, окисляясь до ацетил-КоА, затем «сгорает» в цикле Кребса. Если второго фосфорилирования гексозо-6-монофосфата не происходит, то фосфорилированная глюкоза может подвергаться прямому окислению до фосфопентоз. В норме доля пентозофосфатного пути в количественном превращении глюкозы обычно невелика, варьирует у разных орг-мов и зависит от типа ткани и ее функционального состояния. У млекопитающих активность пентозофосфатного цикла (ПФЦ) относительно высока в печени, надпочечниках, эмбриональной ткани и мол железе в период лактации. Значение: поставляет восст-ный НАДФН, необход для биосинтеза ЖК, холестерина и т.д. За счет пентозофосфатного цикла примерно на 50% покрывается потребность орг-ма в НАДФН. Др функция пентозофосфатного цикла заключается в том, что он поставляет пентозофосфаты для синтеза НК и многих коф-тов. При ряде патологических сост удельный вес пентозофосфатного пути окисления глюкозы возрастает. Пентозофосфатный цикл нач-тся с окисления глюкозо-6-фосфата и последующ окислит декарбоксилир-ния продукта (в результ от гексозофосфата отщепляется первый атом углерода). Это первая, т.наз. окис-ная, стадия ПФЦ. 2-ая стадия включ неокислительные превращения пентозофосфатов с обр-нием исходного глюкозо-6-фосфата. Р-ции ПФЦ протекают в цитозоле клетки. Первая р-ция – дегидрирование глюкозо-6-фосфата при участии ф-та глюкозо-6-фосфатдегидрогеназы и коф-та НАДФ+. Образовавшийся в ходе р-ции 6-фосфоглюконо-δ-лактон – соединение нестабильное и с большой скоростью гидролизуется либо спонтанно, либо с помощью ф-та 6-фосфоглюконолактоназы с обр-нием 6-фос-фоглюконовой к-ты (6-фосфоглюконат):
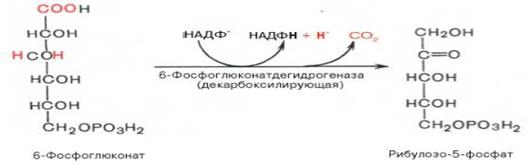
Во второй – окислительной – р-ции, катализируемой 6-фосфоглюко-натдегидрогеназой (декарбоксилирующей), 6-фосфоглюконат дегидрируется и декарбоксилируется. В результате обр-ется фосфорилированная кетопентоза – D-рибулозо-5-фосфат и еще 1 мол-ла НАДФН:
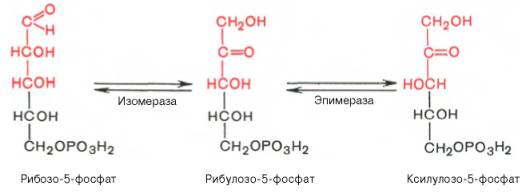
Под действием соотв-ующей эпимеразы из рибулозо-5-фосфата может образоваться другая фосфопентоза – ксилулозо-5-фосфат. Кроме того, рибулозо-5-фосфат под влиянием особой изомеразы легко превращается в рибозо-5-фосфат. М/у этими формами пентозофосфатов устанавливается состояние подвижного равновесия:
При определенных условиях пентозофосфатный путь на этом этапе может быть завершен. Однако при других условиях наступает так называемый неокислительный этап (стадия) пентозофосфатного цикла. Р-ции этого этапа не связаны с использованием кислорода и протекают в анаэробных условиях. При этом обр-ются в-ва, хар-рные для первой стадии гликолиза (фруктозо-6-фосфат, фруктозо-1,6-бисфосфат, фосфотрио-зы), а другие – специфические для пентозофосфатного пути (седогептуло-зо-7-фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат). Основными р-циями неокислительной стадии ПФЦ явл транскетолазная и трансальдолазная. Эти р-ции катализируют превращение изомерных пентозо-5-фосфатов:
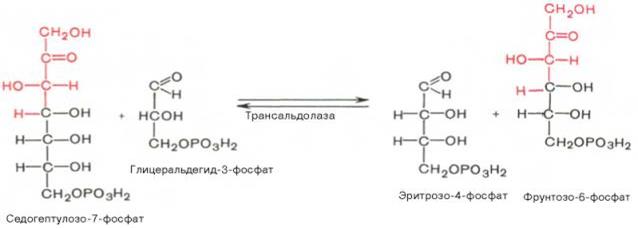
Коф-том в транскетолазной р-ции служит ТПФ, играющий роль промежуточного переносчика гликольальдегидной группы от ксилулозо-5-фосфата к рибозо-5-фосфату. В результате обр-ется семиуглеродный моносахарид седогептулозо-7-фосфат и глицеральдегид-3-фосфат. Транскетолазная р-ция в пентозном цикле встречается дважды, второй раз – при обр-нии фруктозо-6-фосфата и триозофосфата в результате вз-действия второй мол-лы ксилулозо-5-фосфата с эритро-зо-4-фосфатом:
Ф-т трансальдолаза кат-ует перенос остатка диоксиацетона (но не свободного диоксиацетона) от седогептулозо-7-фосфата на гли-церальдегид-3-фосфат:
Шесть мол-л глюкозо-6-фосфата, вступая в ПФЦ, обр-ют 6 мол-л рибулозо-5-фосфата и 6 мол-л СО2, после чего из 6 мол-л рибулозо-5-фосфата снова регенерируется 5 мол-л глюко-зо-6-фосфата. Однако это не означает, что мол-ла глюкозо-6-фосфата, вступающая в цикл, полностью окисляется. Все 6 мол-л СО2 обр-ются из С-1-атомов 6 мол-л глюкозо-6-фосфата. Валовое ур-ние окислительной и неокислительной стадий пенто-зофосфатного цикла можно представить в следующем виде:
или
Обр-шийся НАДФН используется в цитозоле на восстановительные синтезы и не уч-ет в окислительном фосфорилировании, протекающем в митох.
Билет 22 -моносахариды Моносахариды можно рассм как производные многоатомных спиртов, содержащие карбонильную (альдегидную или кетонную) группу. Если карбонильная гр нах в конце цепи, то моносахарид предст собой альдегид и наз альдозой; при любом др положении этой гр моносахарид явл кетоном и наз кетозой. Простейшие представители моносахаридов – триозы: глицеральдегид и диоксиацетон. При окислении первичной спиртовой группы трехатомного спирта – глицерола – обр-ется глицеральдегид (альдоза), а окисление вторичной спиртовой группы приводит к обр-нию диоксиацетона (кетоза). Стереоизомерия моносахаридов. Все моносахариды содержат асимметричные атомы углерода: альдотриозы – один центр асимметрии, альдо-тетрозы – 2, альдопентозы – 3, альдогексозы – 4 и т.д. Кетозы содержат на один асимметричный атом меньше, чем альдозы с тем же числом углеродных атомов. след, кетотриоза диоксиацетон не содержит асимметричных атомов углерода. Все остальные моносахариды могут существовать в виде различных стереоизомеров. Общее число стереоизомеров для любого моносахарида выражается формулой N = 2n, где N – число стереоизомеров, а n – число асимметричных атомов углерода. Как отмечалось, глицеральдегид содержит только один асимметричный атом углерода и поэтому может существовать в виде двух различных стереоизомеров. Изомер глицеральдегида, у к-рого при проекции модели на плоскость ОН-группа у асимметричного атома углерода расположена с правой стороны, принято считать D-глицеральдегидом, а зеркальное отражение – L-глицеральдегидом:
Альдогексозы содержат четыре асимметричных атома углерода и могут существовать в виде 16 стереоизомеров (24), представителем к-рых явл, например, глюкоза. Для альдопентоз и альдотетроз число сте-реоизомеров равно соотв-енно 23 = 8 и 22 = 4. Все изомеры моносахаридов подразделяются на D- и L-формы (D-и L-конфигурация) по сходству расположения групп атомов у последнего центра асимметрии с расположением групп у D- и L-глицеральдегида. Природные гексозы: глюкоза, фруктоза, манноза и галактоза – принадлежат, как правило, по стереохимической конфигурации к соединениям D-ряда (схема 5.1). Известно, что природные моносахариды обладают оптической активностью. Способность вращать плоскость поляризованного луча света – одна из важнейших особенностей в-в (в том числе моносахаридов), мол-лы к-рых имеют асимметричный атом углерода или асимметричны в целом. Св-во вращать плоскость поляризованного луча вправо обозначают знаком плюс (+), а в противоположную сторону – знаком минус (–). Так, D-глицеральдегид вращает плоскость поляризованного луча вправо, т. е. D-глицеральдегид явл D(+)-альдотриозой, а L-гли-церальдегид – L(–)-альдотриозой. Однако направление угла вращения поляризованного луча, к-рое определяется асимметрией мол-лы в целом, заранее непредсказуемо. Моносахариды, относящиеся по стереохимической конфигурации к D-ряду, могут быть левовращающими. Так, обычная форма глюкозы, встречающаяся в природе, явл правовращающей, а обычная форма фруктозы – левовращающей. Циклические (полуацетальные) формы моносахаридов. Любой моносахарид с конкретными физическими св-вами (температура плавления, растворимость и т.д.) хар-ризуется специфической величиной удельного вращения [α]D20.
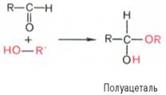
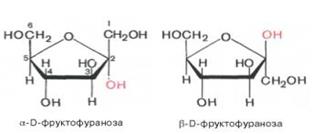
Явление мутаротации имеет объяснение. Известно, что альдегиды и ке-тоны легко и обратимо реагируют с эквимолярным количеством спирта с обр-нием полуацеталей:
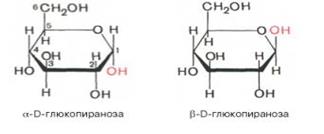
Р-ция обр-ния полуацеталя возможна и в пределах одной мол-лы, если это не связано с пространственными ограничениями. По теории А. Байера, внутримол-лярное вз-действие спиртовой и карбонильной групп наиболее благоприятно, если оно приводит к обр-нию пяти- или шестичленных циклов. При обр-нии полуацеталей возникает новый асимметрический центр (для D-глюкозы это С-1). Шестичленные кольца сахаров называют пиранозами, а пятичленные – фуранозами. α-Форма – это форма, у к-рой расположение полуацетального гидроксила такое же, как у асимметричного углеродного атома, определяющего принадлежность к D- или L-ряду. Иными словами, в формулах с α-моди-фикацией моносахаридов D-ряда полуацетальный гидроксил пишут справа, а в формулах представителей L-ряда – слева. При написании β-формы поступают наоборот. Т.об., явление мутаротации связано с тем, что каждый твердый препарат УГов представляет собой какую-либо одну циклическую (полуацетальную) форму, но при растворении и стоянии растворов эта форма через альдегидную превращается в другие таутомерные циклические формы до достижения состояния равновесия. При этом значение удельного вращения, хар-рное для исходной циклической формы, постепенно меняется. Наконец, устанавливается постоянное удельное вращение, к-рое хар-рно для равновесной смеси таутомеров. Например, известно, что в водных растворах глюкоза находится главным образом в виде α- и β-глюкопираноз, в меньшей степени – в виде α- и β-глюкофураноз и совсем небольшое количество глюкозы – в виде альдегидной формы. Следует подчеркнуть, что из различных таутомерных форм глюкозы в свободном состоянии известны лишь α- и β-пиранозы. Существование малых количеств фураноз и альдегидной формы в растворах доказано, но в свободном состоянии они не могут быть выделены вследствие своей неустойчивости. Наконец, следует помнить, что при написании стр-рных формул по Хеуорсу гидроксильная группа при С-1 должна быть расположена ниже плоскости кольца в α-форме и выше – в β-форме:
Проекционные формулы Хеуорса не отражают подлинной конформации моносахаридов. Подобно циклогексану, пиранозное кольцо может принимать две конфигурации – форму кресла и форму лодки (конформацион-ные формулы). Форма кресла обычно более устойчива, и, по-видимому, именно она преобладает в большей части природных сахаров (рис. 5.1).
|
|||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 461; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.149.94 (0.016 с.) |